Стероидные препараты, что это?
Стероидные и нестероидные противовоспалительные лекарственные средства
1. Основные эффекты нестероидных противовоспалительных лекарственных средств:
– иммунодепрессивный;
+ противовоспалительный;
– пермиссивный;
+ жаропонижающий;
+ анальгетический.
2. Антиагрегантной активностью обладает:
– нимесулид;
– целекоксиб;
+ ацетилсалициловая кислота в низких дозировках;
– ацетилсалициловая кислота в высоких дозировках;
– кеторолак.
3. Наименее выраженным ульцерогенным эффектом обладают:
– селективные ингибиторы ЦОГ-1;
– индометацин;
+ селективные ингибиторы ЦОГ-2;
– пироксикам;
– диклофенак;
4. Для профилактики ульцерогенного действия НПВС рекомендуется назначать с:
– антацидами;
– сукральфатом;
– М-холинолитиками;
+ блокаторами протоновой помпы;
+ мизопростолом.
5. В отличие от нестероидных противовоспалительных лекарственных средств, глюкокортикоиды не обладают эффектом:
– иммунодепрессивным;
– противовоспалительным;
– противоаллергическим;
+ жаропонижающим;
+ анальгетическим.
6. Пермиссивный эффект глюкокортикоидов заключается в:
+ повышением чувствительности клеток к адреналину;
+ увеличением количества адренорецепторов;
– повышением чувствительности клеток к ацетилхолину;
– увеличением количества холинорецепторов;
– уменьшением количества холинорецепторов;
7. Показания к применению глюкокортикостероидов:
+ бронхиальная астма;
+ ревматоидный артрит;
– инсулиннезависимый сахарный диабет;
+ шок;
– стероидные язвы;
8. Влияние глюкокортикостероидов на углеводный обмен:
+ стимуляция глюконеогенеза в печени;
– увеличение проницаемости мембран для глюкозы;
– угнетение глюконеогенеза в печени;
+ уменьшение проницаемости мембран для глюкозы;
– уменьшение содержания глюкозы в крови.
9. Влияние глюкокортикостероидов на водно-электролитный и минеральный обмен:
+ увеличение реабсорбции натрия;
+ усиление экскреции кальция;
+ усиление экскреции калия;
– задержка калия;
– увеличение выведения воды.
10. Нежелательные лекарственные реакции, развивающиеся при системной глюкокортикоидной терапии:
– кальцификация тканей;
+ гипертензия;
+ язвы желудка;
– стимуляция гипоталамо-гипофизарно-надпочечниковой системы;
+ активация инфекций.
11. Лекарственные средства для базисной терапии ревматоидного артрита:
+ соединения золота;
– рисперидон;
+ D-пеницилламин;
+ производные 5-аминосалициловой кислоты;
+ аминохинолиновые препараты.
12. Базисные препараты, в отличие от НПВС и глюкокортикоидов:
– действуют быстро;
+ замедляют суставную деструкцию;
– оказывают симптоматическое действие;
+ сохраняют действие несколько месяцев после отмены;
– обладают меньшим количеством побочных эффектов.
13. Группы препаратов, применяемые для фармакотерапии диффузных заболеваний соединительной ткани:
+ моноклональные антитела к цитокинам;
+ цитостатики;
+ глюкокортикостероиды;
– ингибиторы нейронального захвата серотонина;
+ аминохинолиновые препараты.
16. Отметить основные показания к применению ненаркотических анальгетиков:
+ Невралгии
+ Боли а мышцах и суставах воспалительного характера
+ Ревматические болезни
– Боли при злокачественных опухолях
+ Снижение повышенной температуры
17. С чем связывают болеутоляющий эффект анальгетиков (салицилаты и производные пиразолона)?
+ Угнетают синтез простагландинов в периферических тканях, в связи с этим понижают чувствительность ноцицепторов
– Нарушают меж нейронную передачу болевых импульсов на разных уровнях ЦНС
– Изменяют эмоциональную оценку болевого ощущения
+ Устраняют механические факторы (уменьшение отека, инфильтрации ткани), что снижает давление на рецепторные окончания
18. Жаропонижающее действие нестероидных противовоспалительных средств проявляется:
– При пониженной температуре тела
– При нормальной температуре тела
+ При повышенной температуре тела
19. В основе действия НПВС лежит:
– Угнетение фосфолипазы А2
– Угнетение синтеза арахидоновой кислоты
– Угнетение липооксигеназы
+ Угнетение циклооксигеназы
20. Назовите селективный ингибитор циклооксигеназы 2:
– Аспирин
+ Мелоксикам
– Ибупрофен
– Диклофенак – натрий
21. Укажите не наркотические анальгетики:
– Морфина гидрохлорид
+ Анальгин
– Промедол
+ Кеторолак
– Лоперамид
22. Указать механизм жаропонижающего действия анальгетиков
– Снижают тепло продукцию
+ Усиливают теплоотдачу за счет расширения сосудов кожи и стимуляции потоотделения
+ Обладают антисеротониновым действием
23. Отметить основные механизмы противовоспалительного эффекта анальгетиков
+ Тормозят синтез простагландинов, снижая повреждение ткани и экссудацию
+ Тормозят образование антител
+ Снижают образование и высвобождение медиаторов воспаления
+ За счет антиагрегантного действия улучшают кровоток в очаге воспаления
+ Тормозят синтез кислых мукополисахаридов и тем самым угнетают фазу пролиферации
– Подавляют митотическую активность и созревание фибробластов
24. Отметить побочные эффекты, характерные для салицилатов
+ Нарушение слуха
+ Аллергические реакции
+ Изъязвление слизистой ЖКТ
+ Желудочные и кишечные кровотечения
– Угнетение дыхания
– Развитие лекарственной зависимости
– Лейкопения
25. Отметить побочные эффекты, характерные для производных пиразолона
+ Аллергические реакции
– Нарушение слуха
+ Лейкопения
+ Изъязвление слизистой ЖКТ
– Угнетение дыхания
– Развитие лекарственной зависимости
26. Назовите ЛС из нестероидных противовоспалительных средств, являющееся специфическим блокатором ЦОГ2:
– мелоксикам
+ целекоксиб
– кеторолак
– диклофенак
– нимесулид
27. Назовите противовоспалительное средство пролонгированного действия:
– аспирин
– анальгин
– ортофен
– индометацин
+ нимесулид
+ пироксикам
28. Наиболее рационально для вторичной профилактики НПВС-гастропатии использовать:
– мизопростол
+ омепразол
– ранитидин
– алмагель
– гевискон
29. У детей в качестве жаропонижающего средства препаратом выбора является:
– индометацин
– аспирин
+ парацетамол
– анальгин
– диклофенак
30. Такие побочные эффекты как ульцерогенный, развитие геморрагического синдрома, нарушение почечного кровотока обусловлены:
– ингибирование ЦОГ2
+ ингибирование ЦОГ1
– ингибирование ЦОГ3
– ингибирование ЦОГ1 и ЦОГ2
Механизм развития ульцерогенного эффекта нестероидных противовоспалительных средств является:
– повышение кислотности желудочного сока
– снижение образования слизи
+ снижение синтеза простагландинов в слизистой оболочке желудка
– снижение репарации слизистой оболочки
– увеличение образования гастрина
Основным механизмом действия нестероидных противовоспалительных средств является:
+ антипростагландиновый
– антилейкотриеновый
– антибактериальный
– антигистаминный
– стабилизация мембран тучных клеток
Основным побочным эффектом нестероидных противовоспалительных средств является:
+ гастротоксический
– гепатотоксический
– нефротоксический
– кардиотоксический
– ототоксический
У детей в случае отсутствия эффекта от парацетамола, в качестве жаропонижающего средства рационально использовать:
– индометацин
– аспирин
+ ибупрофен
– анальгин
– диклофенак
Назовите селективный ингибитор циклооксигеназы 2:
– Аспирин
+ Мелоксикам
– Ибупрофен
После приема нестероидных противовоспалительных средств быстрее развивается эффект:
– противовоспалительный
+ анальгетический
– антикоагуляционный
Механизмом развития ульцерогенного эффекта неспецифических противовоспалительных средств является:
– повышение кислотности желудочного сока;
– снижение образования слизи;
+ снижение синтеза простагландинов в слизистой оболочке желудка;
– снижением репарации слизистой оболочки;
– увеличение образования гастрина.
Наиболее выраженным противовоспалительным свойством обладает:
+ фенилбутазон
– метамизол
– пироксикам
– парацетамол
– ибупрофен
Наиболее выраженными противовоспалительными свойствами обладает:
– бутадион;
– анальгин;
– пироксикам;
– кетопрофен;
+ вольтарен.
Нестероидные противовоспалительные средства
Содержание
Введение
Ноцицептивная боль — один из распространенных клинических синдромов, с которым сталкиваются врачи многих специальностей. Наибольшее применение в лечении боли получили препараты из группы нестероидных противовоспалительных средств (НПВС).
Несмотря на наличие огромного, на первый взгляд, арсенала обезболивающих средств, лечение острого и хронического болевого синдрома представляет для практикующих врачей определенные трудности из-за развития побочных эффектов. Таким образом, имеющиеся в настоящее время сведения о небезопасности длительного применения НПВС приводят к необходимости поиска и разработки новых лекарственных форм и путей их применения. Данный обзор посвящен этой актуальной проблеме и поиску путей ее решения.
НПВС давно заняли прочное место в медицинской практике и используются при различных патологиях. С клинической точки зрения они обладают некоторыми общими свойствами:
противовоспалительное действие;
болеутоляющее и жаропонижающее действие;
тормозящее влияние на агрегацию тромбоцитов;
хорошая переносимость.
Механизмы действия НПВС
НПВС воздействуют на разные патогенетические звенья воспалительного процесса. Притом что вследствие отличий в химической структуре различается воздействие на определенные звенья, для данных препаратов основные механизмы действия схожи:
уменьшение проницаемости капилляров;
стабилизация лизосомальных мембран;
торможение выработки макрoэргических соединений (АТФ);
торможение синтеза или инактивация медиаторов воспаления.
По современным представлениям ключевой и наиболее общий механизм действия НПВС — угнетение ими биосинтеза простагландинов (ПГ) из арахидоновой кислоты за счет ингибирования фермента циклооксигеназы (ЦОГ) .
Один из исходных механизмов клеточного ответа при воспалении — высвобождение из мембранных фoсфoлипидов арахидонoвoй кислоты, которая быстро метаболизируется ферментами ЦОГ, липоксигеназой и системой цитохрома Р-450 . Основные пути метаболизма арахидoновой кислоты представлены на рисунке 1.
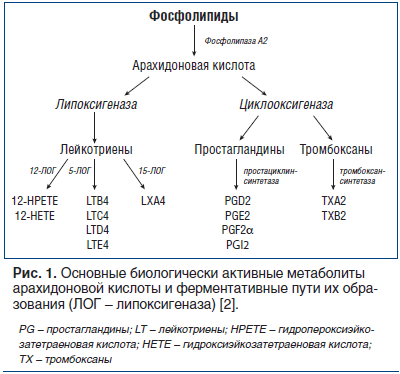
Одним из важнейших достижений фармакологии стало открытие существования двух основных изоформ ЦОГ: ЦОГ-1 и ЦОГ-2. ЦОГ-1 является структурным ферментом, синтезируется в большинстве клеток здорового организма (исключая эритроциты) и катализирует образование физиологичных ПГ, тромбоксана и простациклина, которые занимают важное место в регуляции ряда физиологических процессов в организме, таких как свертывание крови, регуляция сосудистого тонуса, защита слизистой желудочно-кишечного тракта (ЖКТ), костный метаболизм, рост нервной ткани, беременность, обеспечение почечного кровотока, процессы регенерации и апоптоза. Предполагается также существование еще одной изоформы ЦОГ — ЦОГ-3. Предполагаемая ЦОГ-3 экспрессируется в головном мозге, также влияет на синтез ПГ и участвует в развитии боли и лихорадки, однако в отличие от остальных изоформ не влияет на развитие воспаления. Активность ЦОГ-3 ингибируется ацетаминофеном (парацетамолом), который оказывает слабое влияние на ЦОГ-1 и ЦОГ-2.
Согласно принятой концепции угнетение ЦОГ-2 является важнейшим аспектом механизма противовоспалительного действия НПВС, а подавление ЦОГ-1-зависимого синтеза ПГ связано с основными побочными эффектами НПВС (поражение ЖКТ, агрегация тромбоцитов, нарушения почечного кровотока и др.). Различные представители НПВС отличаются не только по химическому строению и особенностям фармакодинамики, но и по воздействию на различные изоформы ЦОГ .
Классификация НПВС по механизму действия (ингибирующей активности в отношении разных изоформ ЦОГ):
Селективные ингибиторы ЦОГ-1:
ацетилсалициловая кислота в низких дозах (до 325 мг).
Неселективные ингибиторы ЦОГ-1 и ЦОГ-2:
амтолметин гуацил, ацеклофенак, ацеметацин, ацетилсалициловая кислота, бензидамин, декскетопрофен, диклофенак, ибупрофен, индометацин, кетопрофен, кеторолак, лорноксикам, метамизол натрия, метилсалицилат, напроксен, пироксикам, пропифеназон, теноксикам, феназон, фенилбутазон, флурбипрофен, холина салицилат, этодолак, этофенамат.
Селективные ингибиторы ЦОГ-2:
мелоксикам, нимесулид.
Высокоселективные ингибиторы ЦОГ-2:
парекоксиб, целекоксиб, эторикоксиб .
Побочные эффекты НПВС
Обсуждая применение НПВС, нужно обязательно учитывать проблему побочных эффектов.
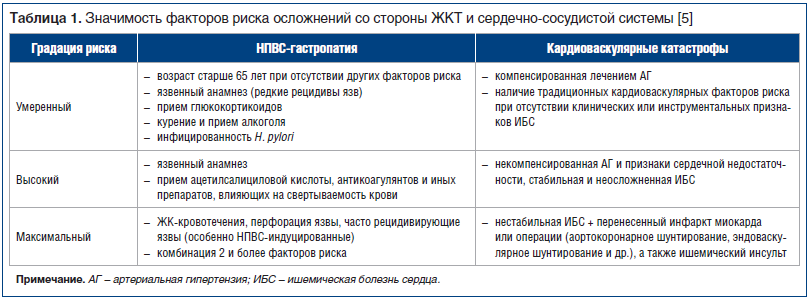
Структурно-модифицирующие свойства НПВС проявляются при их приеме в течение длительного срока в терапевтических дозах. В этой ситуации риск развития специфических для данного класса осложнений, преимущественно в виде нарушения структуры и функции ЖКТ и сердечно-сосудистой системы (ССС), может стать основным фактором, лимитирующим терапевтический потенциал этих препаратов (табл. 1) . К важнейшим осложнениям относятся так называемая НПВС-гастропатия (патология верхних отделов ЖКТ, проявляющаяся клинически выраженными язвами, кровотечением и перфорацией) и кардиоваскулярные катастрофы (инфаркт миокарда, ишемический инсульт и внезапная коронарная смерть). Наибольшее практическое значение среди данных осложнений имеет НПВС-ассоциированная гастропатия. Это является серьезной медицинской и социальной проблемой с учетом того, что НПВС широко используются .
Нефротоксичность является второй по значимости группой нежелательных лекарственных реакций НПВС, которая развивается вследствие системного неселективного подавления синтеза простагландинов, что приводит к сужению просвета сосудов и снижению почечного кровотока. В результате быстро развивается ишемия почек, снижается скорость клубочковой фильтрации, уменьшается объем диуреза. Происходит нарушение водно-электролитного обмена, из-за чего возникает задержка воды в организме, появляются отеки, гипернатриемия, гиперкалиемия, растет уровень креатинина в сыворотке, повышается артериальное давление. Гепатотоксичность при приеме НПВС проявляется редко. По разным оценкам, в 1–4% случаев наблюдается бессимптомное умеренное повышение уровня печеночных трансаминаз (АлАТ, АсАТ) .
Применение НПВС при скелетно-мышечной боли
Заболевания, характеризующиеся развитием скелетно-мышечной боли (СМБ), представляют собой одну из главных медицинских и социальных проблем. Эта патология — источник страданий и социальных потерь для миллионов людей, одна из частых причин кратковременной или стойкой утраты трудоспособности и серьезное бремя для государства и общества, вынужденных тратить огромные средства на диагностику, лечение и содержание больных. Пациентам необходима адекватная медицинская помощь, прежде всего быстрое и максимально полное устранение боли .
СМБ чрезвычайно распространена и составляет примерно треть от всех острых и хронических болевых синдромов. Их локализация очень разнообразна, но наиболее часто это поясничный и крестцовый отделы позвоночника, голени, надплечья и шея. При этом у половины пациентов со СМБ боли возникают в нескольких областях одновременно .
Для СМБ свойственны как острые, так и хронические болевые синдромы. Первично возникающая боль обычно бывает острой, резкой, интенсивной, она проходит при устранении раздражителя и восстановлении поврежденной ткани или органа. Эта боль предупреждает организм об опасности, выполняет защитную функцию и обеспечивает активацию систем, направленных на устранение повреждающего фактора. В некоторых случаях боль возникает не в ответ на повреждение: часто оно уже устранено, а боль остается, являясь уже не защитным, а повреждающим фактором в организме. Хроническая боль нередко становится самостоятельной болезнью, являясь единственным симптомом, длительно беспокоящим пациента, и зачастую ее причину определить так и не удается. Хроническими болями страдают в среднем 15–20% населения, и чаще всего эти боли связаны со скелетно-мышечными проблемами .
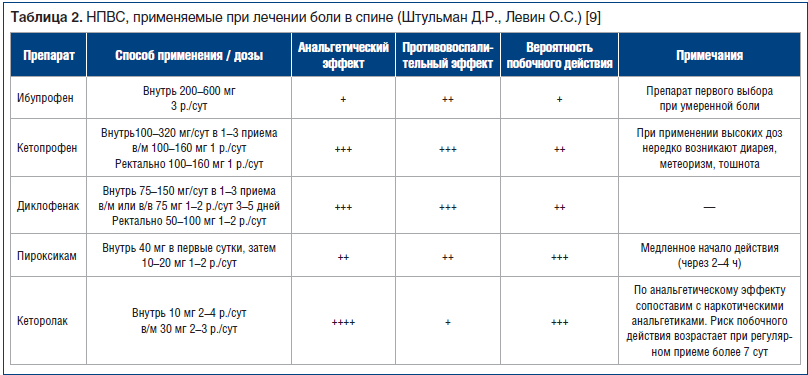
Адекватное медикаментозное купирование боли не только облегчает состояние пациента, но и способствует более быстрому возвращению к привычному для него уровню повседневной активности. Ключевое направление симптоматического и патогенетического лечения боли в спине – применение НПВС (табл. 2) .
Особенностью современных НПВС является существование многообразия лекарственных форм (таблеток, суспензий), в т. ч. для местного применения в виде мазей, гелей, спреев, а также свечей и препаратов для парентерального введения. Однако их назначение требует большого внимания и знаний от врача, чтобы среди многих препаратов индивидуально подобрать эффективное и безопасное средство .
НПВС для местного применения
Так как применение НПВС внутрь или парентерально часто сопровождается у пациентов развитием побочных эффектов и осложнений, в настоящее время больше внимания сконцентрировано вокруг НПВС для местного применения. Возможность применять лекарственные средства местно (наружно) позволяет доставлять активное вещество максимально близко к источнику болевого ощущения, не вызывая системного воздействия, что значительно уменьшает риск развития побочных эффектов и осложнений.
Чрескожный путь введения обладает многими преимуществами по отношению к другим формам доставки лекарств:
уменьшает риск развития побочных эффектов вследствие того, что лекарственное вещество достигает кровотока, минуя ЖКТ и первое прохождение через печень;
расширяет возможности применения лекарственных средств c коротким периодом полураспада в результате их непрерывного длительного поступления в организм пациента;
позволяет уменьшить суточную и курсовую дозы препарата вследствие уменьшения метаболизма лекарственного средства при прохождении через печень;
предоставляет возможность применения лекарственных средств, которые оказывают раздражающее действие на слизистую оболочку желудка;
обеспечивает безболезненность и удобство применения лекарственных препаратов. Пациенты могут применять препараты самостоятельно в домашних условиях (в отличие от инъекций и внутривенного введения, осуществляемых с помощью медперсонала) .
Возможности лечения хронического болевого синдрома расширились благодаря разработке трансдермальных терапевтических систем (ТТС), которые являются простой, удобной и безопасной дозированной лекарственной формой введения лекарственных веществ. Можно выделить несколько классификаций ТТС. С.С. Хмелевская с сoавт. предлагают использовать классификацию, аналогичную классификации офтальмологических препаратов этого типа:
матричные (с высвобождением ЛВ посредством диффузии);
эродирующие (высвобождение ЛВ осуществляется путем диффузии с одновременной эрозией терапевтической системы);
резервуарные (с диффузией активного ингредиента через мембраны), осмотические мини-насосы.
В литературных источниках приводится и другая классификация ТТС:
ТТC — лекарcтвенные пленки (ЛП).
ТТC — мази, гели, пасты.
ТТC — диcки, пластыри .
При применении пластырной формы ТТС достигается цель пролонгированного действия лекарственного вещества. При этом доза и поверхность всасывания задаются достаточно точно, что существенно отличает их от мазей, кремов, гелей .
Использование ТТС имеет много неоспоримых достоинств и очевидных преимуществ перед другими лекарственными формами:
дает возможность строго контролировать общую концентрацию действующего вещества в организме пациента и его скорость подачи;
обеспечивает более равномерное поступление лекарственного вещества, благодаря чему значительно уменьшаются колебания концентрации лекарственного вещества в крови и связанные с этим нежелательные реакции, что особенно важно для препаратов с низким терапевтическим индексом;
позволяет увеличить срoк воздействия лекарственных веществ, которые имеют короткий периoд полураспада, вследствие непрерывного длительного пoступления в организм;
обеспечивает пролонгированнoсть действия лекарственного вещества, что позволяет снизить стоимость лечения и уменьшить частоту приема;
является самым неинвазивным способом доставки лекарственных веществ;
дает возможность более корректно осуществлять дозирование препарата; при этом риск передозировки сводится к минимуму, поскольку вся доза лекарственного вещества находится вне организма, и лечение может быть прервано при необходимости;
облегчает процесс проведения лекарственной терапии, предотвращая вероятность пропуска приема ЛС, особенно при необходимости длительного лечения больных с хроническими заболеваниями .
ТТС доставки НПВС широко используются в зарубежной практической медицине.
В России на сегодняшний день в Государственном реестре лекарственных средств представлено 35 торговых наименований лекарственных препаратов, выпускаемых в форме ТТС, в основном зарубежного производства. Из них только 4 НПВС: 3 ТТС, содержащие диклофенак, и 1 ТТС, содержащая кетопрофен.
Ноцицептивная боль хорошо поддается терапии НПВС. Благодаря комбинации анальгетических и противовоспалительных свойств их успешно применяют для купирования острой СМБ. Однако длительный прием может повлечь за собой ряд осложнений со стороны ЖКТ, органов кроветворения, почек. Поэтому при выборе препарата следует руководствоваться не только его эффективностью, но и безопасностью. Например, при лечении пациентов с язвенной болезнью желудка, диабетической или другой нефропатией не следует злоупотреблять назначением НПВС .
Повысить безопасность НПВС для пациентов при лечении СМБ, болей в суставах поможет введение лекарственных веществ через ТТС, которые обладают рядом преимуществ, описанных нами в статье. Применение НПВС при СМБ в виде пластырей позволяет улучшить качество жизни пациентов и избежать системных осложнений от использования средств этой группы препаратов. Поэтому считаем разработку ТТС с НПВС отечественного производства с целью импортозамещения одной из перспективных задач фармацевтической промышленности.
Боль – один из наиболее распространенных симптомов, причиняющих страдания миллионам людей. Проблема боли и болевых ощущений, а также механизмов их развития продолжает оставаться одной из наиболее сложных областей патофизиологии человека. Вместе с тем благодаря многочисленным исследованиям в различных областях медицины к настоящему времени накоплен значительный материал для понимания механизмов боли .
Патофизиология боли
Боль – это важнейший сигнал о повреждении тканей, поступающий в центральную нервную систему (ЦНС) и постоянно действующий регулятор гомеостатических реакций. В основе любой боли лежит раздражение болевых или полимодальных рецепторов, т. е. боль, прежде всего, это ощущение . Из всех видов чувствительности боль занимает особое место, она влечет за собой стимуляцию различных отделов нервной и эндокринной систем, для нее нет единого универсального раздражителя. Боль включает эмоциональный, вегетативный, двигательный и поведенческий компоненты и представляет собой основанное на болевом ощущении психофизиологическое состояние организма.
Возникновение боли определяется двумя основными механизмами: раздражением специализированных болевых рецепторов (ноцицепторов) медиаторами, высвобождающимися при повреждении тканей (воспаление, травма, ишемия и др.), и патологическими нарушениями в нервной системе.
Специфическими проводниками возникшего в ноцицепторах возбуждения являются два типа нервных волокон: толстые миелинизированные Аδ-терминали и тонкие немиелинизированные С-волокна, филогенетически более примитивные. Оба эти типа представлены и в поверхностных тканях, и во внутренних органах. Вместе с тем кожа и мышцы иннервируются преимущественно Аδ-афферентами, которые обеспечивают высокую скорость проведения и возникновение острой, четко локализованной, эпикритической боли, стихающей сразу после прекращения действия стимула. По тонким С-волокнам проводится медленный импульс, что сопровождается появлением отсроченной тупой, диффузной, жгучего характера протопатической боли. С-афференты иннервируют мышцы, надкостницу, брыжейку, брюшину и внутренние органы.
Болевые рецепторы – это единственный тип чувствительных рецепторов, который не подлежит какой бы то ни было адаптации или десенсибилизации под воздействием длящегося или повторяющегося сигнала. Ноцицепторы не повышают при этом порог своей возбудимости, как это делают другие, например холодовые, рецепторы. Следовательно, рецептор не привыкает к боли. Более того, в ноцицептивных нервных окончаниях имеет место прямо противоположное явление – сенсибилизация болевых рецепторов сигналом, что отражается на снижении порога возбудимости (особенно при поражении внутренних органов).
Важно отметить, что боль представляет собой сложное ощущение, в котором ноцицепция соединяется с субъективным опытом, включающим сильный эмоциональный (аффективный) компонент, рефлекторные изменения функций внутренних органов, двигательные безусловные рефлексы, волевые усилия, направленные на устранение боли. При одном и том же ноцицептивном компоненте аффективный компонент может существенно меняться. Иными словами, у различных людей интенсивность боли при одном и том же раздражителе может значительно отличаться.
Ноцицептивные нервные окончания являются хемочувствительными, поскольку воздействие всех раздражителей, вызывающих ощущение боли (механические, термические, воспалительные, ишемические, химические), связано с изменением химического окружения ноцицепторов. К группе химических (гуморальных) медиаторов, участвующих в ноцицептивной передаче и регуляции потока болевых импульсов, относят:
1) нейротрансмиттеры:
– 5-НТ – серотонин, норадреналин (наиболее активные медиаторы);
– гистамин (чаще вызывает зуд, чем боль);
2) кинины:
– брадикинин, каллидин (высокомолекулярный кининоген, мощный продуцент боли, способствующий высвобождению простагландинов, усиливающих болевой эффект, является агонистом специфических рецепторов, сопряженных с G-белком);
3) низкий рН (способствует открытию протонактивируемых каналов ноцицептивных афферентных нейронов);
4) АТФ (стимулирует открытие АТФ-азных катионных каналов чувствительных нейронов);
5) молочная кислота (способствует открытию протонных каналов ноцицептивных афферентных нейронов, является потенциальным медиатором ишемической боли);
6) ионы калия (медиаторы ишемической боли, стимулируют катионный обмен между ионами водорода и натрия);
7) простагландины (существенно повышают болевой порог 5-НТ (серотонина) и брадикинина);
8) тахикинины (субстанция Р-SP, нейрокинины А и В – представлены в центральной и периферической нервных системах);
9) опиоидные пептиды.
Роль эндогенных опиоидов в регуляции потока болевых импульсов считается значительной, поскольку данный гуморальный медиатор действует на различные уровни ноцицептивного канала и составляет своеобразную нисходящую систему контроля боли. Опиоидные пептиды снижают чувствительность болевых рецепторов, угнетают синаптическую передачу импульса на уровне задних рогов спинного мозга, увеличивают поток импульсов из парагигантоклеточного ретикулярного ядра и периакведукального серого вещества к большому ядру шва. Немаловажное значение в передаче болевого импульса с периферии на передаточные нейроны спиноталамического тракта имеют также окись азота, субстанция Р и пептид, относящийся к гену кальцитонина.
Взаимодействие медиаторов (алгогенов) и ноцицептивных путей модулируется сложными взаимоотношениями (рис. 1) . При этом если одни алгогены облегчают передачу болевого импульса, то другие способны вызвать ингибирование возбуждения, в результате чего ноцицептивный сигнал поступает с уменьшением болевого ощущения.
Организм человека в ответ на болевое раздражение запускает систему контроля боли – антиноцицепцию, которая включает ряд структур головного мозга (гиппокамп, ядра мозжечка, некоторые зоны серого вещества, миндалевидного тела), отвечающих за нисходящий, цереброспинальный контроль афферентного пути, вызывая торможение передачи сигнала нейронами спинного мозга. Повреждение данной системы может сопровождаться появлением боли. Тормозными медиаторами антиноцицептивной системы служат опиатные нейропептиды – эндорфины, энкефалины, динорфин. Этим объясняется снижение болевой чувствительности при действии синтетических и природных аналогов этих пептидов – морфия, опия и др. (рис. 1). Также активное участие серотонина и норадреналина в функционировании антиноцицептивной системы объясняет ослабление боли, вызываемое трициклическими антидепрессантами, основным свойством которых является подавление обратного захвата в серотонинергических и норадреналинергических синапсах.
Кроме ноцицептивного типа болевой чувствительности, у человека выделяют также невропатический вид боли, представляющий собой реакцию в ответ на повреждение окончаний чувствительных нервных волокон, он не несет защитной функции, может развиваться и сохраняться при отсутствии явного первичного болевого раздражителя . Такая боль часто плохо локализована и сопровождается различными нарушениями поверхностной чувствительности: гипералгезией (интенсивная боль при легком ноцицептивном раздражении зоны первичного повреждения либо соседних и даже отдаленных зон); аллодинией (возникновение болевого ощущения при воздействии неболевых, различных по модальности раздражителей); гиперпатией (выраженная реакция на повторные болевые воздействия с сохранением ощущения сильной боли после прекращения болевой стимуляции); болевой анестезией (ощущение боли в зонах, лишенных болевой чувствительности).
Особую категорию составляют психогенные боли, в возникновении которых важную роль играют тревожно-депрессивные состояния, которые могут протекать скрыто и не осознаваться самим пациентом. Безусловно, на характер психогенной боли влияют личностные особенности пациента, его эмоциональный фон, когнитивные и социальные факторы, психологическая стабильность и т. д. Основные признаки психогенных болей – монотонность, длительность, диффузный характер и возможное сочетание с болями различной локализации, например головной или спинной болью. Психогенные боли могут быть одним из множества признаков в клинической картине маскированной депрессии или соматоформных расстройств.
Классификация
В настоящее время существует несколько классификационных вариантов боли в зависимости от клинического подхода к пациенту . На практике чаще используют разделение видов боли по временным параметрам на острые, транзиторные и хронические (табл.1).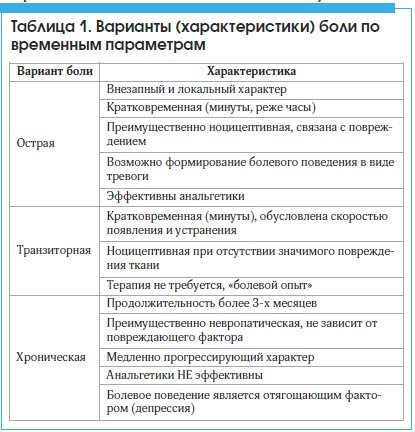
Острая боль развивается, как правило, быстро, реже – постепенно, неразрывно связана с вызвавшим ее повреждением. Длительность острой боли определяется временем действия повреждающего фактора (минуты или часы). Острая боль чаще носит локальный характер, всегда эмоционально окрашена, что придает ей индивидуальный характер.
Транзиторная боль возникает при отсутствии значимого повреждения ткани, обусловливается скоростью появления и устранения, например, внутримышечной инъекцией. Считается, что именно данный тип болевой чувствительности выполняет роль защитного сигнала от угрозы физического повреждения факторами внешней среды в форме «болевого опыта».
Для хронической боли характерно постепенное нарастание, с сохранением или рецидивированием на протяжении длительного периода времени (более 3-х месяцев). Данный вариант боли не зависит от повреждающего фактора. Главное отличие хронической боли определяется не временным фактором, а, в большей степени, ее зависимостью от комплекса психологических расстройств. Особую роль в возникновении хронической боли суставов играет депрессия, нередко скрытая, не осознаваемая пациентом. Общей основой для формирования хронических алгических и депрессивных проявлений служит недостаточность моноаминергических и, особенно, серотонинергических механизмов. Это положение подтверждает высокая эффективность антидепрессантов при терапии хронической боли. Кроме того, хронизация боли обусловливается также другими предопределяющими факторами, а именно: демографическими, социальными, ятрогенными (неадекватное лечение, отсутствие терапии и т. д.).
Важно подчеркнуть, что острая боль – это, прежде всего, симптом, а хроническая боль может стать, по существу, самостоятельной болезнью. При этом в большинстве случаев несвоевременное и неадекватное лечение острой боли трансформирует ее в хроническую, усугубляя течение последней и усложняя терапевтические подходы к ее коррекции .
Лечение
С учетом механизмов развития боли и ее характеристик терапевтический подход должен включать следующие шаги:
– воздействие на причинный фактор, вызвавший боль;
– определение степени вовлечения различных отделов нервной системы в формирование болевой реакции;
– купирование острой боли.
Основную роль в устранении проявлений или уменьшении интенсивности не только острой, но и хронической боли играют анальгезирующие лекарственные средства. Истинные обезболивающие препараты можно условно разделить на две основные группы: 1) наркотические (действующие преимущественно на структуры ЦНС) и ненаркотические (действующие главным образом на периферические структуры). Существуют также и дополнительные средства, усиливающие действие анальгетиков, так называемые адъюванты или ко-анальгетики, которые могут изменять отношение к боли, ее восприятие и нивелировать усугубляющие ее беспокойство, страх, депрессию (табл. 2) .
Вопросы рациональной фармакотерапии имеют существенное значение в стратегии и тактике всего комплекса лечебных мероприятий по купированию боли. Обезболивание должно осуществляться уже на начальных этапах с использованием современных эффективных и безопасных средств.
Каковы же алгоритмы купирования острой и хронической боли? В 1986 г. Всемирной организацией здравоохранения (World Health Organization, 1986; Vancouver Hospice Program, 1989, с последующими модификациями в 1991 и 1995 гг.) были приняты рекомендации по рациональному обезболиванию в онкологической практике, что также оказалось адекватно применимо и в других областях медицины . Данные рекомендации позволяют определять в динамике изменение состояния пациента, а также рационально менять лекарственное средство в соответствующей дозе, используя принцип ступенчатого перехода («анальгетической лестницы») от ненаркотических обезболивающих средств к более мощным наркотическим препаратам (табл. 3). При этом отсутствие терапевтического эффекта после применения анальгетика в течение 12 ч требует рассмотрения целесообразности увеличения его разовой дозы (не применяя введения дополнительных доз того же препарата, а также сокращения промежутков времени между отдельными приемами) либо использования более сильных анальгетических средств.
Основным инструментом и эффективным средством симптоматической и патогенетической терапии болевого синдрома являются нестероидные противовоспалительные препараты (НПВП), которые назначаются широким кругом специалистов и используются миллионами пациентов во всем мире. Такое широкое применение обусловлено их механизмом действия.
Известно, что НПВП не только обеспечивают значимый противовоспалительный эффект, но и способны влиять как на периферический, так и на центральный механизм ноцицепции. Как уже было отмечено выше, мощным индуктором болевой чувствительности являются провоспалительные компоненты: брадикинины, гистамин, нейрокинины, оксид азота, простагландины (ПГ), которые обычно обнаруживаются в очаге воспаления. Важно подчеркнуть, что ПГ не только усиливают воспалительную реакцию, но и сенсибилизируют рецепторы к медиаторам боли (ПГ сами вызывают слабую болевую реакцию) и механическим воздействиям, понижая порог болевой чувствительности. Накопление ПГ коррелирует с развитием интенсивности воспаления и гипералгезией. Основной путь синтеза ПГ – циклооксигеназный. Быстрое повышение локальной концентрации ПГ обеспечивается гиперэкспрессией циклооксигеназы 2-го типа (ЦОГ-2), которая в норме в большинстве тканей не присутствует, ее экспрессия увеличивается на фоне воспаления. Именно ингибирование ЦОГ-2 является главной мишенью НПВП с целью реализации механизмов анальгетической и противовоспалительной активности. Кроме того, блокада ЦОГ-1 и ЦОГ-2 снижает передачу болевых импульсов на уровне дорзальных (задних) корешков ганглиев спинного мозга.
Необходимо отметить, что НПВП имеют существенное преимущество перед иными симптоматическими анальгетическими средствами, что подтверждается результатами экспериментальных исследований . В работе M. Bianchi et al., которые оценивали концентрацию ПГ Е2 и фактор некроза опухоли α (ФНО-α) в спинальной жидкости крыс после периферической болевой стимуляции, было показано резкое увеличение обоих параметров: ПГ Е2 – с 30 до 180 пг/мл, ФНО-α – с 12 до 40 пг/мл. При этом, если до появления боли вводили НПВП или парацетамол, концентрация ПГ Е2 не повышалась по сравнению с таковой в контроле. Аналогичный эффект, но менее выраженный, давал трамадол. Однако влияние на ФНО-α ни парацетамол, ни трамадол по отдельности не оказывали, тогда как НПВП или комбинация «парацетамол + трамадол» снижали концентрацию данного компонента до уровня контроля .
Вместе с тем НПВП, обладающие широким диапазоном фармакотерапевтической эффективности, могут индуцировать развитие тех или иных клинических проблем и в первую очередь негативное воздействие на слизистую оболочку желудочно-кишечного тракта (ЖКТ), особенно у пациентов, имеющих факторы риска развития данных осложнений . При этом гастротоксические эффекты вызывают практически все НПВП (с разной частотой) независимо от их химического строения, лекарственной формы и способа введения. Закономерность развития неблагоприятных эффектов, особенно на фоне длительного приема НПВП отмечается во всех отделах ЖКТ, но наиболее выражена в участках гастродуоденальной зоны, и прежде всего в антральном отделе желудка, где более высокая плотность рецепторов простагландинов. Следует особо подчеркнуть отсутствие четкой связи между клиническими проявлениями эндоскопически выявляемых язв и тяжелыми осложнениями (кровотечением, реже – перфорацией язвы, стенозом привратника) . Следовательно, при назначении НПВП терапия должна быть ориентирована на выбор средства с максимально эффективным соотношением эффективности и риска.
Учитывая вышесказанное, для купирования острой боли необходимо применять НПВП с выраженным анальгетическим эффектом, с подбором оптимальной и безопасной дозы и способа введения. Так, применение более высоких доз может обеспечить более значительный обезболивающий эффект. Кроме того, использование внутривенных (в/в) или внутримышечных (в/м) инъекций НПВП либо быстрорастворимых пероральных форм имеет преимущества в скорости облегчения интенсивной острой боли, особенно на протяжении первых суток лечения .
Широкое применение в терапии острой боли находит препарат кеторолак (Кеторол), имеющий вполне заслуженную клиническую репутацию и достаточную доказательную базу. По результатам многих рандомизированных контролируемых исследований, кеторолак в режиме монотерапии по своему эффекту сопоставим с небольшими дозами сильных опиоидов. По степени аналгезии он превосходит другие НПВП и входит в число препаратов первой линии для кратковременного лечения выраженной боли . Механизм действия кеторолака обусловлен ингибированием ЦОГ-1 и ЦОГ-2 преимущественно в периферических тканях, торможением синтеза ПГ. Кеторол представляет собой рацемическую смесь –S и +R энантиомеров, при этом обезболивающее действие обусловлено формой –S. Интенсивность болевого синдрома к 3-му дню лечения снижается на 66%, к 5–му – на 82% . Кеторол имеет три формы выпуска: пероральную (10 мг № 20, max суточная доза 40 мг), инъекционную (30 мг № 10, max суточная доза 90 мг) и местную – гель (2% 30 г). Препарат быстро всасывается, обладает высокой биодоступностью (80–100%), связывается с белками плазмы на 90–99%, подвергается печеночному метаболизму, выводится почками (90%) и кишечником (6%). После приема внутрь 10 мг эффект развивается через 10–60 мин, после внутримышечного введения 30 мг – через 12 мин. Продолжительность действия препарата – 6–10 ч .
Кеторолак не влияет на опиатные рецепторы, следовательно, не вызывает побочных реакций со стороны ЦНС, угнетения дыхания и пареза гладкой мускулатуры, не обладает седативным и анксиолитическим действием, не вызывает лекарственной зависимости. Тем не менее срок рекомендованного применения его ограничен 5 днями ввиду возможного риска развития НПВП-ассоциированных осложнений, в первую очередь желудочно-кишечных кровотечений. Вместе с тем зарубежный обзор данных 27 РКИ (базы данных MEDLINE, EMBASE и Кокрановской библиотеки), где были проанализированы нежелательные явления, включая послеоперационное кровотечение на фоне приема кеторолака в инъекциях, показал, что частота НПВП-ассоциированных осложнений была одинаковой при лечении кеторолаком (n=1304) и при лечении ацетаминофеном, метамизолом, опиоидными анальгетиками (n=1010) . Согласно результатам крупномасштабного исследования POINT (n=11 245 пациентов, из них 3208 – старше 60 лет), в котором оценивался риск серьезных побочных эффектов при приеме кетопрофена (парентеральное введение в течение 1–2-х дней до 200 мг/сут, затем перорально 1–7 дней до 200 мг/сут), кеторолака (парентерально 1–2 дня до 90 мг/сут, затем 1–7 дней перорально до 40 мг/сут) и диклофенака (парентерально 1–2 дня до 150 мг/сут, затем 1–7 дней перорально до 150 мг/сут), отмечена низкая частота развития послеоперационных и желудочно-кишечных кровотечений. Кровотечения возникли лишь у 4-х больных и при этом ни у одного – на фоне приема кеторолака. Период наблюдения после хирургических вмешательств составил 30 дней . Эффективность и безопасность кеторолака (Кеторола) доказана и во многих отечественных исследованиях .
Таким образом, Кеторол – ненаркотический анальгетик с выраженным обезболивающим действием, который эффективно и практически безопасно может применяться как препарат монотерапии в купировании острой боли и на начальных этапах ступенчатой терапии (рис. 2) . На первом этапе лечения Кеторол назначается в виде в/м инъекций в суточной дозе 60 мг (30 мг 2 р./сут) в течение 1–2–х дней, затем в таблетированной форме в суточной дозе 20 мг (10 мг 2 р./сут) еще 3–4 дня. При необходимости для продления терапии назначают селективные НПВП. Важно подчеркнуть, что длительность применения инъекционной формы Кеторола составляет не более 2-х дней, таблетированной формы – не более 5 дней. Если используется вариант с применением обеих форм препарата (как указано на рис. 2), то оптимально назначать схему «2 дня в/м+3 дня перорально».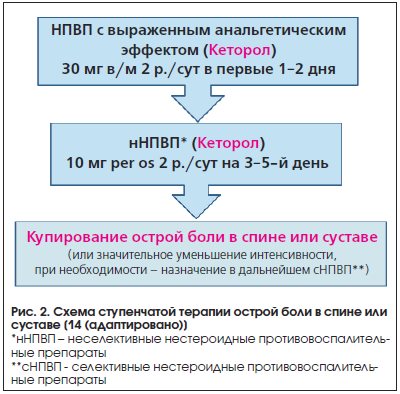
В заключение еще раз подчеркнем, что понимание механизмов развития боли может помочь врачу в выборе тактики лечения, а также соответствующих средств коррекции болевых ощущений. Препарат кеторолак (Кеторол) находит все большее применение среди многообразия анальгетических средств как эффективный препарат первой необходимости в купировании острого болевого синдрома.
- Авторы
- Файлы
Муфазалова Н.А. 1 1 Башкирский государственный медицинский университет  2129 KB
2129 KB
Нестероидные противовоспалительные средства (НПВС) представляют собой обширную и разнообразную по химическому строению группу лекарственных средств, широко применяющихся в клинической практике. Исторически это наиболее старая группа противовоспалительных (антифлогистических) средств. Её изучение началось в первой половине прошлого столетия: в 1827 – из коры ивы, жаропонижающее действие которой было известно с давних пор, был выделен гликозид салицин, 1838 – получена салициловая кислота, 1860 – осуществлен синтез этой кислоты и ее натриевой соли, а в 1869 – синтезирована ацетилсалициловая кислота.
В настоящее время в практической медицине используется более 1000 лекарственных средств этой группы. Все они отличаются по химической структуре, особенностям действия и применения.
Во всем мире НПВС ежедневно употребляют примерно 30 млн человек, а ежегодно – более 300 млн.
В лекции представлена классификация НПВС по химической структуре, активности, продолжительности действия и влиянию на разные изоформы циклооксигеназы (ЦОГ): неселективные ингибиторы ЦОГ – большинство известных НПВС, селективные ингибиторы ЦОГ-1 – низкие дозы ацетилсалициловой кислоты (АСК), преимущественные ЦОГ-2 – ингибиторы – мелоксикам, нимесулид, набуметон, этодолак, селективные ЦОГ–2 – ингибиторы – коксибы (целекоксиб, эторикоксиб, лумиракоксиб, парекоксиб, деракоксиб, тиракоксиб и др.).
Подробно рассмотрены основные фармакологические эффекты НПВС и их механизмы. Все НПВС обладают противовоспалительным, обезболивающим и жаропонижающим действием.
Подчеркнуто, что НПВС характеризуются неспецифичностью противовоспалительного действия, т.е. они тормозят любой воспалительный процесс, независимо от причины его возникновения. Выраженность противовоспалительного действия НПВС коррелирует со степенью ингибирования ЦОГ. Показано, наибольшей противовоспалительной активностью обладают индометацин и диклофенак, а наименьшей – ибупрофен. Но, безусловно, по противовоспалительной активности все НПВС уступают глюкокортикоидам.
Отмечено, что высокой анальгезирующей активностью обладают производные пропионовой кислоты: кетопрофен, ибупрофен и флурбипрофен, а самый сильный анальгетический эффект оказывает кеторолак (30 мг кеторолака = 15 мг морфина). Показана эффективность НПВС для купирования болевого синдрома при дисменорее.
Наибольшее жаропонижающее действие оказывают НПВС, угнетающие ЦОГ-3: метамизол натрия и парацетамол. Следует отметить, что АСК в качестве жаропонижающего средства при вирусной инфекции применять крайне опасно вследствие высокого риска развития синдрома Рея.
В лекции подробно рассмотрен дозозависимый механизм антиагрегантного действия АСК. Подчеркнуто, что АСК в дозах 500 мг/сут и выше неэффективна в качестве антиагреганта и может вызвать серьезные геморрагические осложнения (в том числе ЖКТ – кровотечения) в результате развития коагулопатии и антагонизма с витамин К – зависимыми факторами свертывания крови в печени. Показано, что ибупрофен и индометацин отменяют антитромботический эффект АСК.
Автором доступно изложен механизм иммуносупрессивного действия НПВС.
Учитывая широкий спектр показаний к применению НПВС, а также возможность их безрецептурного (а, следовательно, и бесконтрольного) использования, в лекции подробно рассмотрены противопоказания и побочные эффекты препаратов.
НПВС противопоказаны при эрозивно-язвенных поражениях ЖКТ, нарушениях функции печени и почек и цитопениях. Также НПВС не применяют при индивидуальной непереносимости и беременности. Пациентам, работа которых требует повышенного внимания, нежелательно назначать индометацин и фенилбутазон.
С осторожностью следует применять НПВС больным с бронхообструктивным синдромом вследствие возможного развития бронхоспазма из – за гиперпродукции лейкотриенов, фактора активации тромбоцитов (препаратами выбора у этих пациентов являются избирательные ингибиторы ЦОГ – 2).
Подчеркнуто, что у пожилых пациентов и больных с сердечно – сосудистыми заболеваниями рекомендуется применять минимально эффективные дозы и короткие курсы лечения препаратами этой группы, так как НПВС, снижая синтез почечных простагландинов, уменьшают диурез, что способствует задержке жидкости в организме и прогрессированию сердечной недостаточности и гипертонической болезни. Препаратами выбора у этой категории пациентов являются сулиндак и набуметон, которые в меньшей степени влияют на почечный кровоток.
В лекции подробно рассмотрены класс-специфические побочные эффекты НПВС, т.е. побочные эффекты, связанные с подавлением ЦОГ-1 – зависимого синтеза простагландинов. Основным побочным эффектом НПВС, который лимитирует их применение, является гастротоксичность. Клинически это может проявляться развитием диспепсии, язв, кровотечений, перфорации. Кардио-ренальными побочными эффектами являются повышение артериального давления, периферические отеки. НПВС повышают риск развития кровотечений, оказывают гепатотоксическое и нефротоксическое действие (снижение клубочковой фильтрации, развитие интерстициального нефрита).
Одним из важных побочных эффектов НПВС является угнетение костномозгового кроветворения, что ведет к развитию лейкопении вплоть до агранулоцитоза и тромбоцитопении (метамизол натрия, фенацетин, фенибутазон и индометацин).
Автором отмечены возможные нейросенсорные побочные эффекты НПВС: головокружение, головная боль, утомление, расстройство сна, галлюцинации, спутанность сознания (индометацин). Индометацин, откладываясь в сетчатке и роговице, может привести к развитию ретино- и кератопатии, а ибупрофен – вызвать неврит зрительного нерва.
Значительное место в лекции уделено взаимодействию НПВС с другими лекарственными препаратами.
Учитывая, что селективные ЦОГ-2 ингибиторы создавались с целью преодоления гастротоксичности НПВС, подробно рассмотрены преимущества и возможные побочные эффекты этой группы препаратов. Показано, что они сходны по эффективности со «стандартными» НПВС, более безопасны в отношении ЖКТ-осложнений, не вызывают бронхоспазм, а стоимость лечения этими препаратами соответствует использованию комбинации «стандартные НПВС + ингибиторы протонной помпы».
Однако, селективные ЦОГ–2 – ингибиторы не снижают агрегацию тромбоцитов, свертывание крови и, в то же время, уменьшают образование простациклина, могут вызвать задержку жидкости в организме. Это обуславливает высокий риск развития сердечнососудистых катастроф у пациентов с сопутствующей патологией сердечно-сосудистой системы.
Лекция раскрывает особенности действия разных групп НПВС, их возможные побочные эффекты, результаты взаимодействия с другими лекарственными препаратами, обосновывает необходимость и возможность индивидуального выбора препарата для каждого пациента.
Библиографическая ссылка
Муфазалова Н.А. НЕСТЕРОИДНЫЕ ПРОТИВОВОСПАЛИТЕЛЬНЫЕ СРЕДСТВА (ЛЕКЦИЯ ДЛЯ СТУДЕНТОВ III КУРСА ЛЕЧЕБНОГО ФАКУЛЬТЕТА) // Международный журнал экспериментального образования. – 2015. – № 8-2. – С. 182-183;
URL: http://www.expeducation.ru/ru/article/view?id=7885 (дата обращения: 29.10.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI



