Гиперплазия в желудке
УДК 616.33-002.2-053.2
ОСОБЕННОСТИ ФОВЕОЛЯРНОЙ (МИКРОАНАТОМИЧЕСКОЙ) ПОВЕРХНОСТИ СЛИЗИСТОЙ ОБОЛОЧКИ ЖЕЛУДКА ДЕТЕЙ И ПОДРОСТКОВ С ФУНКЦИОНАЛЬНОЙ ДИСПЕПСИЕЙ © Баженов С.М., Дубенская Л.И., Парменова Л.П., Сурменев Д.В.
Смоленский государственный медицинский университет, Россия, 214019, Смоленск, ул. Крупской, 28
Резюме: целью исследования явилось количественное изучение ямочного аппарата и площади фовеолярной (ямочной) поверхности антрального отдела желудка при различных состояниях слизистой оболочки у детей и подростков. Проведена системная детальная морфометрическая оценка биоптатов слизистой оболочки антрума у 187 детей в возрасте от 7 до 14 лет с диагнозом «функциональная диспепсия». По результатам гистологического заключения сформировано 3 группы: 62 ребенка с неизмененной слизистой оболочкой, 65 детей с признаками адаптационной перестройки и 60 пациентов с хроническим неатрофическим гастритом. В последней группе выявлено достоверное уменьшение относительного и абсолютного количества ямок. Показано значительное увеличение площади поверхности одной ямки. Изучены морфологические аспекты механизма редукции и деструкции ямок, предложены возможные варианты уменьшения количества ямок. Полученные данные свидетельствуют об увеличении площади фовеолярной и, соответственно, суммарной поверхности слизистой оболочки при хроническом неатрофическом антральном гастрите.
Ключевые слова: дети, хронический гастрит, слизистая оболочка, фовеолярная поверхность, морфометрия
FOVEOLAR (MICROANATOMICAL) SURFACE OF CHILDREN AND ADOLESCENTS GASTRIC MUCOSA WITH FUNCTIONAL DISPEPSIA
Bazhenov S.M., Dubenskaya L.I., Parmenova L.P., Surmenev D.V.
Smolensk State Medical University, Russia, 214019, Smolensk, Krupskaya St., 28
Key words: children, chronic gastritis, gastric mucosa, fovea surface, morphometry Введение
Поверхность слизистой оболочки желудка (СОЖ) человека условно можно разделить на макроанатомическую (видимую невооруженным глазом) и микроанатомическую (видимую с помощью увеличивающих изображение приборов). Поверхность, образуемая складками, межскладочным пространством и бороздками, разделяющими желудочные поля, образует макроанатомический рельеф. Размеры желудка, количество складок СОЖ, их общая протяженность, высота и ширина складок, а также длина, глубина и ширина бороздок, разделяющих желудочные поля, определяют площадь внутренней макроанатомической поверхности органа. Ямки составляют микроанатомический рельеф СОЖ. Относительное и абсолютное количество ямок, глубина и диаметр их просветной части обусловливают площадь невидимой (добавочной) поверхности СОЖ. Под ямками понимают углубления в слизистой оболочке той или иной формы, выстланные однорядным призматическим эпителием, имеющие просвет и открывающиеся в полость желудка . Ямки (fovea) долгое время назывались в цитируемой нами научной литературе ямочками (foveolae), поэтому вполне возможно назвать поверхность СОЖ, ими определяемую, как «фовеолярную поверхность» (ФП). По аналогии с «фовеолярной гиперплазией» и «фовеолярным слоем» .
Общая (суммарная) площадь СОЖ складывается из анатомической поверхности органа, дополнительной поверхности складок слизистой оболочки, добавочной поверхности за счет бороздок, разделяющих и очерчивающих желудочные поля и, наконец, фовеолярной поверхности просвета ямок. Под «фовеолярной поверхностью» СОЖ понимали суммарную площадь внутренней (просветной) поверхности всех ямочек органа вне зависимости от их локализации, размеров, конфигурации и связи с подлежащими железистыми образованиями.
Целью исследования явилось количественное изучение ямочного аппарата и площади фовеолярной (ямочной) поверхности антрального отдела желудка при различных состояниях слизистой оболочки у детей и подростков.
Методика
Материалом исследования послужили прицельные щипцовые гастробиоптаты из антрального отдела СОЖ 187 детей и подростков. Все дети при госпитализации в СОДКБ имели диагноз «функциональная диспепсия», «хронический гастрит» (ХГ) или «хронический гастродуоденит». Для формирования выборок и рандомизации были разработаны клинические, эндоскопические, лабораторные и гистологические критерии включения пациентов в анализируемые группы или исключения из них.
Критериями включения послужили: 1) возраст от 7 до 14 лет; 2) наличие синдрома желудочной диспепсии; 3) отсутствие эндоскопических признаков гиперплазии и гипертрофии складок СОЖ; 3) отсутствие дуоденогастрального рефлюкса; 4) удовлетворительное общее состояние детей; 5) отсутствие по данным ИФА антител к лямблиям (Lamblia intestinalis), аскаридам (Ascaris lumbricoides); 6) нормальная или умеренно повышенная внутрижелудочная кислотность, что минимизировало возможность выраженной адаптационной перестройки в неизмененной СОЖ детей и подростков; 7) толщина СОЖ антрального отдела от 400 до 500 мкм по данным гистологического исследования.
Критериями исключения являлись: 1) выявленные признаки атрофических изменений пилорических желез; 2) наличие острых и хронических эрозий, язв желудка и двенадцатиперстной кишки; 3) наличие других острых или хронических заболеваний или синдромов нижележащих отделов желудочно-кишечного тракта; 4) прием антибактериальных, антисекреторных или нестероидных противовоспалительных препаратов в течение последних 3 мес. , предшествовавших забору гастробиоптата. 5) наличие хронических заболеваний и состояний со стороны других органов и систем; 6) установленное табакокурение; 7) толщина СОЖ антрального отдела менее 400 мкм или более 500 мкм.
Кислотообразующую функцию желудка изучали с помощью внутрижелудочной рН-метрии на аппарате «Гастроскан-5». Первичную диагностику Helicobacter pylori (HP) — инфекции осуществляли с помощью серологического, цито- и гистобактериоскопического методов исследования.
Серийно резался весь парафиновый блок, последовательность срезов биоптата строго маркировалась — от первого до последнего. В среднем получали 42,7±8,2 информативных среза с каждого биопсийного кусочка. Микропрепараты окрашивались гематоксилином и эозином, проводилась ШИК-реакция и окраска альциановым синим при рН 2,5; окраска альциановым синим (при рН 1,0); окраска по Романовскому и пикрофуксином по ван Гизон.
По результатам гистологического анализа было сформировано 3 группы пациентов: 1-я группа -62 ребенка (средний возраст 10,4±2,5) с неизмененной СОЖ (1-А — 32 НР- , 1-Б — 30 НР+); 2-я группа — 65 пациентов (средний возраст 10,7±3,2) с признаками выраженной адаптационной перестройки СОЖ (2-А — 34 НР- , 2-Б — 31 НР+); 3-я группа — 60 детей (средний возраст 11,2±2,6) с неатрофическим хроническим гастритом (3-А — 29 НР- , 3-Б — 31 НР ). Различий по половому признаку в группах не выявлено. Признаками адаптационной перестройки считали: достоверное снижение высоты клеток покровно-ямочного эпителия, сочетающееся с одновременным увеличением площади их ядер и снижением интенсивности ШИК-реакции; расширение и суперфициализацию перешеечно-шеечной зоны; плотность лейкоцитарного инфильтрата от 6000 до 8000 клеток в 1 мм2, если индивидуальный лейкоцитарно-стромальный индекс не превышал 1,5. В каждом биоптате находили следующие морфометрические параметры: количество ямок на 1 мм длины биоптата, количество ямок в имеющемся объеме биоптата с последующим пересчетом на 1 мм3 , общую глубину и ширину ямки, глубину и ширину просветной части ямки, среднюю высоту 30 эпителиоцитов на уровне средней трети ямки, среднее количество эпителиоцитов, расположенное на 100 мкм длины базальной мембраны, среднюю площадь 30 ядер эпителиоцитов, среднюю ширину и высоту 30 валиков, подсчитывали количество межэпителиальных лимфоцитов,
нейтрофилов и эозинофилов в 100 эпителиоцитах средней трети ямки, подсчитывали абсолютное количество фибробластов, фиброцитов, эпителиоцитов, гладкомышечных клеток, лимфоцитов, плазмоцитов, нейтрофильных и эозинофильных гранулоцитов, макрофагов и тучных клеток в 500 малых квадратах сетки Глаголева при увеличении микроскопа ><600 раз; находили митотическую активность шеечного эпителия (%о) и длину шеечной зоны, ориентируясь на слабопозитивные ШИК-зоны .
Просвет большинства ямок по форме был наиболее близок к цилиндру или перевернутому конусу, площадь просвета ямок находили по формуле общей площади поверхности цилиндра или конуса, исключая площадь верхнего круга .
Исследование было ретроспективным, одномоментным, поперечным с формированием сопоставимых на момент исследования групп.
Статистический анализ включал: определение типа распределения изучаемых переменных, нахождение среднего арифметического, среднеквадратического и стандартного отклонения, моды, медианы, коэффициентов асимметрии и эксцесса. Во всех трех изучаемых группах полученные эмпирические данные соответствовали закону нормального распределения на принятом 5% уровне значимости. Для внутригруппового сравнения количественных показателей применялся 1-критерий Стьюдента. Для сравнения выделенных, независимых групп вводился поправочный коэффициент Бонферрони. В качестве системы статистического анализа и визуализации данных использовался свободно распространяемый пакет Я версия 3.2.2. Дистрибутив системы вместе с базовым набором из 29 пакетов расположен на основном сайте проекта http://cran.r-project.org.
Результаты исследования и их обсуждение
В неизмененной СОЖ антрального отдела (1-я группа) количество ямок в среднем составляет 196,4±15,6 на мм2 поверхности и не отличается в подгруппах НР- и НР+. Имеется устойчивая тенденция к уменьшению их количества во 2-й, особенно НР+ группе (табл. 1). При хроническом поверхностном или хроническом неатрофическом антральном гастрите количество ямок уменьшается более чем в 2 раза.
Таблица 1. Морфометрические показатели поверхностно-ямочных отделов СОЖ у детей и подростков в норме, при адаптационной перестройке и хроническом антральном гастрите
Группы / Показатели Неизмененная СОЖ СОЖ с признаками адаптационной перестройки Хронический неатрофический гастрит
1-А (НР-) группа (п =32) 1-Б (НР+) группа (п =30) 2-А (НР-) группа (п =34) 2-Б (НР+) группа (п =31) 3-А (НР-) группа (п=29) 3-Б (НР+) группа (п=31)
Количество ямок на 1мм длины биоптата 13,6±1,1 13,7±1,2 13±1,1 12,6±1,4 9,4±0,8** 9,7±0,9**
Количество ямок на 1 мм2 (расчетное) 186,4±15,6 188,5±16,8 169,7±14,2 158,1±25,4 88,2±9,3** 94,5±11,6**
Количество ямок на 1 мм2 (реальное) 195,1±17,1 197,7±30,7 177,5±18,6 164,1±18,3 96,7±11,9** 102,4±12,7**
Ширина ямок СОЖ (мкм) 55,6±4,3 54,7±5,2 58,6±6,5 60,1±5,7 65,9±6,6 ** 67,2±8,3**
Ширина валиков СОЖ (мкм) 15,8±2,2 16,3±2,5 18,3±2,3 19,5±1,9 40,6±5,7** 38,7±5,1**
Количество лейкоцитов на 1 мм2 3982±456 4734±533 6948±572* 7213±704* 8611±570** 8467±709**
Примечание: * — достоверность отличий показателей 1-й и 2-й групп, р<0,05;
** — достоверность отличий показателей 1-й и 3-й групп, р<0,05
Относительное количество ямок в СОЖ зависит от трех параметров: ширины (диаметра) ямок, их формы и, главным образом, от ширины (толщины) стромы между ямками. Ширина ямок при ХГ достоверно больше по сравнению с контрольной группой, но прирост не большой и составляет в среднем 18,5±3,7%. Ширина валиков при хроническом воспалении возрастает в 2,5 раза. Это дает основание считать, что именно увеличение расстояния между ямками приводит к уменьшению плотности их взаиморасположения. Расширение валиков при хроническом гастрите объясняют,
по аналогии с острым гастритом, наличием лейкоцитарного инфильтрата. Считается, что последний способен раздвигать структурные элементы паренхимы, включая железы . В то же время не выявлено зависимости между плотностью лейкоцитарного инфильтрата и шириной стромы между элементами паренхимы . Остается предположить, что увеличение размеров (площади) валиков происходит за счет активного стромообразования и фиброзирования и уже этот расширенный плацдарм занимают лейкоциты. Это отличает хроническое воспаление от острого, при котором белковый экссудат и отек стромы способен временно (на период воспаления) раздвигать структурные элементы паренхимы СОЖ.
Сравнение размеров желудка, характера макроанатомического рельефа СОЖ и морфометрических показателей у пациентов различных групп дает основание утверждать, что при ХГ происходит не только относительное (на единицу площади поверхности), но и абсолютное уменьшение количества всех компартментов паренхимы, включая ямки.
По результатам наблюдения, можно выделить несколько механизмов исчезновения ямок и, следовательно, уменьшения их количества (гипоплазии). Первый механизм морфорегресса ямок связан с редукцией, т. е. постепенным исчезновением валика разделяющего две смежные ямки и объединением двух «старых» ямок в одну «новую». Данный вариант гипоплазии ямочного аппарата можно назвать «путем редукции межъямочных валиков». Второй механизм, приводящий к уменьшению количества ямок, состоит в прогрессирующих атрофических изменениях эпителия ямок вплоть до полной деэпителизации с дальнейшим исчезновением просвета ямки и консолидацией (объединением) стромы двух смежных валиков. Как вариант может происходить постепенное уменьшение глубины (уплощение) ямки, вплоть до ее исчезновения. Это механизм гипоплазии ямок «путем объединения двух смежных валиков». Чаще всего он наблюдается при полной атрофии или разрушении впадавших в ямку желез. Помимо этого количество ямок и подлежащих элементов паренхимы уменьшается в местах активного стромообразования, например, в зоне возникновении и роста лимфоидных фолликулов. Наконец микроабсцедирование и/или эрозирование СОЖ приводит к очаговому исчезновению ямок и формированию зоны фиброза. Упрощение ямочной структуры СОЖ происходит «путем замещения паренхимы лимфоидной или фиброзной тканью». У детей, вероятно, преобладают дисрегенераторные механизмы, у взрослых существенную роль играют деструктивно-воспалительные звенья морфодеструкции.
Одновременно с морфорегрессом у детей постоянно происходило образование новых ямок путем врастания акантотических тяжей «молодого» покровного эпителия с последующей его дифференцировкой, формированием просвета и развитием нижележащих железистых структур. В детском возрасте оба процесса протекают одновременно, но скорость морфодеструкции ямок при ХГ, по-видимому, превышает скорость появления молодых ямок. В зрелом, и тем более в пожилом возрасте, преобладают разрушительные тенденции и утрата структурной стабильности, в основном, за счет фиброзирования СОЖ и снижения объема регенерации ямочного и железистого аппарата.
Прямой подсчет количества ямок в биоптате и расчеты, сделанные на основании ширины ямок и валиков, дают весьма близкие результаты, что позволяет сделать выбор в пользу гораздо менее трудоемкого способа морфометрии, связанного с измерением ширины ямок и валиков. Устойчивая и достоверная редукция ямочного аппарата, по-видимому, является одним из наиболее убедительных критериев начальной хронизации воспалительного процесса и ранним (пока не используемым) признаком атрофии паренхимы. При так называемых неатрофических формах гастрита имеются признаки атрофических изменений СОЖ, но не в традиционном виде атрофии желез, а в виде атрофии (гипоплазии) ямок.
Удельная плотность лейкоцитарного инфильтрата достоверно нарастает в группе детей с выраженной адаптационной перестройкой СОЖ (2-я группа). Различия между 2-А (НР-) и 2-Б (НР+) группами не выявлено, что, возможно, связано с большим количеством микрофлоры других морфотипов, постоянно выявляемой в цитологических препаратах бактериоскопическим методом и/или наличием герпетического инфицирования .
Высота эпителиоцитов несколько снижается уже во 2-й группе, но достоверные отличия выявляются только между контрольной группой и группой с ХГ (табл. 2). Ширина просвета ямок больше нормы во 2-й и в 3-й группах. Глубина ямок при хроническом поверхностном гастрите имеет лишь тенденцию к увеличению. Ряд авторов указывает на увеличение глубины ямок при ХГ
. Данное противоречие, по-видимому, объясняется тем фактом, что были отобраны для количественной оценки только пациенты со средней толщиной СОЖ (400-500 мкм), невзирая на наличие или отсутствие признаков хронического воспаления.
Площадь поверхности просвета ямок во 2-й группе увеличивается почти вдвое, а в 3-й более чем в три раза превышает норму в расчете на одну ямку. В пересчете на 1 мм2 площади макроанатомической поверхности получается прирост в 1-й группе на 0,92 мм2 , во 2-й на 1,26 мм2, в 3-й — на 1,41 мм2. Незначительные различия площади ФП в группе с адаптационной перестройкой и хроническим гастритом объясняются резким уменьшением количества ямок в последней группе.
Таблица 2. Морфометрические показатели площади ямочной поверхности слизистой оболочки антрального отдела желудка у детей и подростков_
Группы / Показатели Неизмененная СОЖ СОЖ при адаптационной перестройке Хронический неатрофический гастрит
1-А (НР-) группа (П =32) 1-Б (НР+) группа (П =30) 2-А (НР-) группа (П =34) 2 (НР+) группа (П =31) 3-А (НР-) группа (П=29) 3-Б (НР+) группа (П=31)
Высота Эпителия ямок (мкм) 24,2±1,5 23,4±1.8 23,1±1,7 23,8±2,1 20,4±2,4 20,1±2,5
Ширина просвета ямок (мкм) 7,1±1,5 7,9±1,6 13,4±2,3* 13,6±2,6* 25,1±3,3** 23,7±3,4**
Глубина просвета ямок (мкм) 194,3±16,2 188,1±17,6 195,7±18,5 197,7±16,9 195,4±19,6 206,2±21,1
Площадь просвета 1-й ямки 4332 ±382 4666 ±417 8234 ±676* 8443 ±659* 15400 ±1029** 15345 ±1131**
Площадь ФП (мм) на 1 мм2 0,92±0,01 0,93±0,009 1,27±0,09* 1,25±0,08* 1,36±0,11** 1,45±0,13**
Количество МЭЛф (%) ямок 9,2±1,7 11,5±1,8 15,9±2,1* 16,7±2,3* 24,4±2,9** 21,8±3,1**
Количество МЭНф (%) ямок 2,7±0,3 3,3±0,4 5,1±0,4* 4,8±0,9* 7,7±1,2** 8,8±1,2**
Другими словами под видимой ad oculus поверхностью лежит такая же или даже большая по площади «невидимая» поверхность слизистой оболочки — активная рабочая зона органа. О важной роли ФП косвенно свидетельствует нарастание количества межэпителиальных лимфоцитов и сегментоядерных нейтрофилов уже при адаптационной перестройке и далее при хроническом воспалении. Если бы при ХГ не происходило значительное уменьшение количества ямок, то площадь ямочной поверхности увеличилась бы еще почти на 100% и приблизилась бы к 2,7 мм2 «дополнительной» площади. Напрашивается предположение о том, что редукция ямок способствует ограничению фовеолярной поверхности антрального отдела СОЖ.
Выводы
1. Общая площадь поверхности неизмененной слизистой оболочки желудка увеличивается, за счет фовеолярной поверхности, в среднем на 0,92 мм2 на каждый квадратный миллиметр макроанатомической поверхности, при адаптационной перестройке — на 1,26 мм2, при хроническом антральном гастрите — на 1,41 мм2. Расчетное количество ямок уменьшается, составляя соответственно около 187 (в 1-й группе), 164 (во 2-й группе) и 91 (в 3-й группе).
2. При хроническом воспалительном процессе в СОЖ происходит не только относительное, но и абсолютное уменьшение количества ямок. Наряду с постоянным образованием новых ямочных структур идет разрушение существующих ямок. Имеется ряд механизмов морфодеструкции ямок: «путем редукции межъямочных валиков», «путем объединения двух смежных валиков», «путем замещения паренхимы лимфоидной или фиброзной тканью».
3. В свете устоявшихся в отечественной патологической анатомии представлений о хроническом воспалении понятия «хронизации» и «атрофии» следует считать неразрывными, в связи с чем не оправдано выделение «неатрофической» формы хронического гастрита. В рабочей классификации хронических антральных гастритов у детей целесообразно выделение таких форм, как хронический гастрит с атрофией и/или гипоплазией ямок, шеечных отделов желез и тел желез в различных сочетаниях.
4. Атрофические изменения слизистой оболочки должны оцениваться клиническим морфологом во всех структурных элементах паренхимы, включая ямки, шеечные и главные части желез желудка.
Литература
1. Автандилов Г.Г. Проблемы патогенеза и патологоанатомической диагностики болезней в аспектах морфометрии. — М., 1984. — 288 с.
2. Аруин Л.И., Капуллер Л.Л., Исаков В.А. и др. Морфологическая диагностика болезней желудка и кишечника. — М.: «Триада — Х», 1998. — 496 с.
4. Баженов С.М. Хронический неатрофический гастрит — морфологическая иллюзия или реальность? // Актуальные вопросы патологической анатомии: Материалы III съезда Российского общества патологоанатомов. Т.2. — Самара, 2009. — С. 29-32.
5. Гартнер Л.П., Хайат Дж. Л. Цветной атлас гистологии: Пер. с англ. / Под ред. В. П. Сапрыкина. — М., 2008. — 480 с.
7. Иллюстрированный словарь. Математика: Пер. с англ. А. Банкрашкова. — М., 2007. — 127 с.
9. Салупере В. П. Проблема хронического гастрита. — Таллинн, 1978. — 144 с.
10. Успенский В.М. Функциональная морфология слизистой оболочки желудка. — Л., 1986. — 291 с.
11. Чернин В.В. Хронический гастрит. — Тверь, 2006. — 304 с.
13. Rugge M, Genta RM. Staging and grading of chronic gastritis // Human Pathology. — 2005. — V.36, N3. — P. 228-233.
Информация об авторах
Баженов Сергей Михайлович — кандидат медицинских наук, старший научный сотрудник научно-исследовательского центра (отдел патоморфологии) ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: smbazhenov@mail.ru
Дубенская Людмила Игоревна — кандидат медицинских наук, старший научный сотрудник научно-исследовательского центра (отдел патоморфологии) ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: VL-Muhin@mail.ru
Парменова Людмила Павловна — доктор медицинских наук, профессор, профессор кафедры педиатрии ФДПО ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: parmenova_l@mail.ru
Сурменев Дмитрий Викторович — научный сотрудник научно-исследовательского центра ФГБОУ ВО «Смоленский государственный медицинский университет» Минздрава России. E-mail: surmenevD@rambler.ru
Содержание
Список литературы диссертационного исследования кандидат медицинских наук Костюнин, Кирилл Юрьевич, 2010 год
1. Акопян И.Г., Барышникова Н.В., Григорян Т.М. и др. Методы диагностики хеликобактериоза. СПб.: Диалект, 2008.
3. Ардатская М.Д., Минушкин О.Н., Иконников Н.С. Дисбактериоз кишечника: понятие, диагностические подходы и пути коррекции. Возможности и преимущества биохимического исследования кала. Пособие для врачей. М., 2004.
5. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. Москва: Триада-Х, 1998.
7. Бондаренко В.М., Грачева Н.М., Мацулевич Т.В. Дисбактериозы кишечника у взрослых. М., 2003.
8. Довгаль С.Г. Методы лабораторной диагностики хеликобактериоза. // Акт. пробл. инф. патол. 1993. — Вып.1. — С.21.
12. П.Ивашкин В. Т. Helicobacter pylori: революция в гастроэнтерологии // Мед. кафедра. 2005. — № 1. — С. 4-17
13. Ковальчук JI.B., Ганковская JI.B., Рубакова Э.И. Система цитокинов. -М., 2000.
16. Кононов А.В. Местный иммунный ответ на инфекцию Helicobacter pylori. II Материалы 7-й сессии Российской группы по изучению Н.pylori. 1998. — С.14—19.
18. Копанев Ю.А., Соколов A.JI. Дисбактериоз кишечника: микробиологические, иммунологические и клинические аспекты микроэкологических нарушений у детей. М.: МНИИ педиатрии и детской хирургии., 2002.
19. Минушкин О.Н., Ардатская М.Д., Бабин В.Н. и др. Дисбактериоз кишечника. // Рос. мед. журнал. 1999. — Вып.З. — С.40-45.
21. Окороков А.Н. Диагностика болезней внутренних органов. Т.1. М.: Мед. лит., 1999.
23. Пиманов С.И. Эзофагит, гастрит и язвенная болезнь. Москва: Мед. кн., 2000.
24. Пиманов С.И., Макаренко Е.В. Диагностика и лечение инфекции Helicobacter pylori: рекомендации Консенсуса Маастрихт III и комментарии. Витебск, 2007.
25. Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ Statistica. — М: МедиаСфера., 2003.
26. Рожавин М.А. Патогенные свойства Campylobacter pylori. // Клин. мед. 1989. — Вып. 11. — С. 20-24.
27. Симбирцев А.С. Интерлейкин-8 и другие хемокины. // Иммунология -1999. Вып.4. — С.9-14.
29. Симбирцев А.С. Цитокины: классификация и биологические функции. // Цитокины и воспаление 2004. — Вып.З. — С.16-21.
30. Соколов Е.И., Глан П.В., Гришина Т.И. Клиническая иммунология. -М.: Медицина, 1998.
34. Ярилин А.А. Основы иммунологии. М.: Медицина, 1999.
35. Ярилин А.А. Система цитокинов и принципы ее функционирования в норме и при патологии. // Иммунология. 1997. — Вып.5. — С.7-14.
37. Akira S., Hemmi H. Recognition of pathogen-associated molecular patterns by TLR family. // Immunol. Lett. 2003. — V.85. — P.85-95.
41. Atherton J.C. H. pylori virulence factors. // Br. Med. Bull. 1998. — V.54. -P. 105-20.
51. Brookes A.J. The essence of SNP. // Gene. 1999. — V.234. — P.177-186.
55. Cellini L. Donelli G. Microbial Ecology in Health and Disease. // Microb. Ecol. Health. Dis. 2000. — Suppl.2. — P.259-262.
59. Crabtree J. Gastric mucosal inflammatory responses to Helicobacter pylori. II Aliment. Pharmacol. Ther. 1996. — V.10. — P.29-37.
61. Dixon M., Genta R., Yardley J. et al. Classification and grading of gastritis. // Am. J. Surg. Pathol. 1996. — V.20. — P.1161-1181.
67. Dzierzanovska-Fangra K., Lehours P. Diagnosis of Helicobacter pylori infection. // Helicobacter 2003. — V.l. — P.6-13.
69. Erickson K.L., Hubbard N.E. Probiotic immunomodulation in health and disease. // J. Nutr. 2000. — V.130. — P403-09.
78. Figura N. Determinants of pathogenicity of Helicobacter pylori. // J. Chemother. 1999. — V.l 1. — P.22.
84. Freedberg A.S., Barron L.E. The presence of spirochetes in human gastric mucosa. // Am. J. Dig. Dis. 1940. — V.7. — P.443-445.
99. Hemmi H. et al. A Toll-like receptor recognizes bacterial DNA. // Nature 2000. — V.408. — P.740-745.
102. Janeway C.A., Medzhitov R. Innate immune recognition. // Annu. Rev. Immunol. 2002. — V.20. — P. 197-216.
113. Krienitz W. Ueber das auftreten von mageninhalt bei carcinoma ventriculi. // Dtsch. Med. Wochenschr. 1906. — V.22. — P.872.
114. Kruglyak L, Nickerson DA. Variation is the spice of life. // Nat. Genet. 2001. — V.27. — P.23^236.
115. Kuipers EJ. Helicobacter pylori, MALT lymphoma and gastric cancer. // J. Chemother. 1999. — V.ll. — P.25.
123. Lehours P., Yilmaz O. Epidemiology of Helicobacter pylori infection. // Helicobacter 2007. — V.12. — P. 1-3.
127. Maeda S., Mentis A.F. Pathogenesis of Helicobacter pylori infection. // Helicobacter 2007. — V.12. — P. 1-14.
137. Michetti P. Lactobacilli for the management of Helicobacter pylori. // Nutrition 2001. — V.17. — P.268-269.
142. Moran A.P. The role of lipopolysacchande in Helicobacter pylory pathogenesis. // Aliment. Phatmacol. Ther. 1996. — V.10. — P.57-64.
144. Morris A., Nicolson G., Loud G. at al. Seroepidemiology of Campylobacter pylori II N. Z. Med. J. 1986. — V.99. — P.657-659.
147. Nalin D.R., Levine R.J., Levine M.M. et al. Cholera, non-vibrio cholera, and stomach acid. // Lancet 1978. — V.2. — P.856-859.
150. O’Toole P.W., Lane M.C., Porwollik S. Helicobacter pylori motility. // Microbes Infect. 2000. — V.2. — P. 1207-1214.
151. Oppenheim J., Feldman M. et al. Cytokine Reference. — London: Academic Press, 2000.
152. Palmer E.D. Investigation of the gastric mucosa spirochetes of the human. // Gastroenterol. 1954. — V.27. — P.218-220.
153. Parsonnet J. The incidence of Helicobacter pylori infection. // Aliment. Pharmacol. Ther. 1995. — V.9. — P.45-51.
160. Perez-Perez G.I., Rothenbacher D., Brenner H. Epidemiology of Helicobacter pylori infection. // Helicobacter — 2004. V.9. — P. 1-6.
161. Perez-Perez G.I., Witkin S.S., Decker M.D., Blaser M.J.• Seroprevalence of Helicobacter pylori infection in couples. // J. Clin.
162. Microbiol. 1991. — V.29. — P.642-644.
170. Remmele W. Magen in Pathologie, Bd2. // Berlin. 1984. — P.141-229.
177. Rugge M., Genta R.M. Staging and grading of chronic gastritis. // Human Pathology. 2005. — V.36. — P.228-33
182. Savage D.C. Microbial ecology of gastrointestinal-tract. // Annu. Rev. Microbiol. 1977.- V.31. -P.107-133.
185. Schwarz K. Ueber penetrierende Magen — und Jejunageschwure. // Beitr. Klin. Chir. 1910. — V.67. — P.96-128.
186. Scott D., Weeks D., Melchers K., Sachs G. The life and death of Helicobacter pylori. // Gut. 1998. — V.43. — P.56-60.
191. Sidebothman R.L., Baron J.H. Hypothesis: Helicobacter pylori, urease, mucus, and gastric ulcer. // Lancet 1990. — V.27. — P. 193-195.
197. Steinman R. The dendritic cell system and its role in immunogenicity. // Ann. Rev. Immunol. 1991. — V.9. — P.271-96.
202. Thanos D., Maniatis T. NF-kappa B: a lesson in family values. // Cell 1995. — V.80. — P.529-532.
204. Tytgat G.N. Endoscopic transmission of Helicobacter pylori. II Aliment. Pharmacol. Ther. 1995. -V.9. — P. 105-10.
206. Underhill D.M., Ozinsky A. Toll-like receptors: key mediators of microbe detection. // Curr. Opin. Immunol. 2002. — V.14. — P. 103-110.
207. Vaara M., Vaara T. Polycations as outer membranedisorganizing agents. // Antimicrob. Agents Chemother. 1983. — V.24. — P. 114-22.
211. NF-B in the Antrum of the Human Stomach. // J. Immunology 2000. -V.164. — P.3353-3359.
217. Weis W.I., Taylor M.E., Drickamer K. The C-type lectin superfamily in the immune system. // Immunol. Rev. 1998. — V.l63. — P. 19-34.
221. Xu J., Gordon J.I. Honor thy symbionts. // PNAS USA. 2003. -V.100. — P. 10452-10459.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Курусин В.М. 1 Власов А.П. 1 Полозова Э.И. 1 Землякова К.В. 1 Лещанкина Н.Ю. 1 1 ФГБОУ ВПО «МГУ им. Н.П. Огарева» В работе представлены результаты клинического исследования по использованию эффективного и безопасного метода лечения больных пожилого и старческого возраста, способствующего регрессии предраковых и ранних стадий злокачественных образований желудка. Клинико-инструментальный и лабораторно-морфологический анализ 58 больных старших (60–89 лет) возрастных групп с предраковыми заболеваниями и ранними стадиями рака желудка показал, что применение комбинированного метода лечения с использованием фитотерапии, включающего настой из чистотела большого (Chelidonium majus) и настойку золотого уса (Callisia fragrans), приводит к положительному клинико-морфологическому эффекту. Местное лечебное действие разработанной терапии проявлялось в трансформации патологически измененных тканей желудка в неизмененные. На примере исследования мембранодестабилизирующих явлений по липидному метаболизму доказано отсутствие отрицательного воздействия комплексной лекарственной терапии на организм больных.  487 KB пожилой и старческий возраст золотой ус чистотел большой желудок предраковые заболевания 1. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. – М.: Триада-Х, 1998. – 496 с. 2. Бакайкин В.М., Курусин В.М. Тактика и результаты терапевтического лечения предраковых заболеваний верхних отделов желудочно-кишечного тракта // Технические и естественные науки: проблемы, теория, практика. Межвузовский сборник научных трудов. — Саранск, 2010. – С. 228–230. 3. Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2006 г. //Вестник РОНЦ им. Н.Н. Блохина РАМН. — 2008. — Т. 19. — № 2. (прил. 1). — С. 52–90. 4. Курусин В.М. Способ лечения предраковых и ранних стадий раковых заболеваний желудка. Патент на изобретение № 2467758 от 27.11.12 г. 5. Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность). — М.: ФГУ «МНИОИ им. П.А. Герцена Минздравсоцразвития России», 2011. – С. 144–145. 6. Correa P., Haenszel W., Cuetlo C. et al. Gastric, precancerous process in a high-risk, population: cohort follow-up // Cancer Res. – 1990. – Vol. 50. – P. 4737–4740. 7. Do Youn Park, MD; Gregory Y. Lauwers, MD. Gastric Polyps: Classification and Management. Archives of Pathology and Laboratory Medicine. — 2005. — Vol. 132, № 4. — Р. 633–635.
487 KB пожилой и старческий возраст золотой ус чистотел большой желудок предраковые заболевания 1. Аруин Л.И., Капуллер Л.Л., Исаков В.А. Морфологическая диагностика болезней желудка и кишечника. – М.: Триада-Х, 1998. – 496 с. 2. Бакайкин В.М., Курусин В.М. Тактика и результаты терапевтического лечения предраковых заболеваний верхних отделов желудочно-кишечного тракта // Технические и естественные науки: проблемы, теория, практика. Межвузовский сборник научных трудов. — Саранск, 2010. – С. 228–230. 3. Давыдов М.И., Аксель Е.М. Заболеваемость злокачественными новообразованиями населения России и стран СНГ в 2006 г. //Вестник РОНЦ им. Н.Н. Блохина РАМН. — 2008. — Т. 19. — № 2. (прил. 1). — С. 52–90. 4. Курусин В.М. Способ лечения предраковых и ранних стадий раковых заболеваний желудка. Патент на изобретение № 2467758 от 27.11.12 г. 5. Чиссов В.И., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность). — М.: ФГУ «МНИОИ им. П.А. Герцена Минздравсоцразвития России», 2011. – С. 144–145. 6. Correa P., Haenszel W., Cuetlo C. et al. Gastric, precancerous process in a high-risk, population: cohort follow-up // Cancer Res. – 1990. – Vol. 50. – P. 4737–4740. 7. Do Youn Park, MD; Gregory Y. Lauwers, MD. Gastric Polyps: Classification and Management. Archives of Pathology and Laboratory Medicine. — 2005. — Vol. 132, № 4. — Р. 633–635.
Рак желудка остается одним из самых распространенных заболеваний в мире. Ежегодно регистрируется почти 800 тыс. новых случаев и 628 тыс. смертей от этого заболевания. В числе стран-«лидеров» находится и Россия. Заболеваемость данным видом новообразований значительно возрастает в возрасте после 50 лет, т.е. у лиц пожилого и старческого возраста. Вероятность возникновения опухоли у мужчин в 2 раза выше, чем у женщин .
Проведенными клиническими исследованиями было достоверно доказано, что риск возникновения злокачественного образования в здоровом желудке крайне низок. Более 99% больных с раком желудка до постановки этого диагноза имели различные предраковые заболевания. Наиболее распространенные предраки – это хронический атрофический гастрит, язва желудка, полипы желудка. Кроме того, к предопухолевым заболеваниям желудка относят метаплазии и дисплазии II, III степеней. Все эти заболевания, постепенно развиваясь, повышают риск развития злокачественного образования .
Лечение рака желудка на сегодняшний день основывается на комплексном подходе. Наряду с хирургической тактикой и лучевой терапией используется консервативное ведение больных с предраковыми заболеваниями желудка и раком желудка. При этом социальное положение людей пожилого возраста не позволяет приобретать дорогие препараты, а также использовать дорогостоящие эндоскопические операции.
Цель работы
Разработать эффективный и безопасный фитотерапевтический метод лечения больных пожилого и старческого возраста, способствующий регрессии предраковых и ранних стадий злокачественных образований желудка; на примере состояния липидного метаболизма доказать отсутствие отрицательного его влияния на организм в целом.
Материалы и методы исследования
Клинико-лабораторные исследования проведены у 58 больных возрастом от 60 до 89 лет с различными предраковыми заболеваниями желудка. Больные были разделены на 2 группы. Первая группа (группа сравнения) – больные (n=16), которым после обнаружения изменений в слизистой оболочке желудка проводилась симптоматическая терапия (они отказывались от какого-либо другого лечения). Пациентам второй группы (основная группа) (n=42) назначалось комбинированное терапевтическое лечение. Средний возраст обследуемых в первой группе составлял 62,3±5,4 лет, во второй – 63,7±4,9 года. Полипы желудка в первой группе больных диагностированы у 7 мужчин (из них аденоматозные – у 2, гиперплазиогенные – у 5 больных) и 3 женщин (из них аденоматозные – у 1, гиперплазиогенные – у 2 больных), дисплазии III степени – у 4 больных (1 мужчина, 3 женщины), доброкачественные подслизистые опухоли – у 2 пациентов (1 мужчина, 1 женщина). Полипы желудка во второй группе больных диагностированы у 11 мужчин (из них аденоматозные – у 3, гиперплазиогенные – у 8 больных) и 22 женщин (из них аденоматозные – у 13, гиперплазиогенные – у 9 больных), дисплазии III степени – у 5 больных (3 мужчины, 2 женщины), ранние раки – у 4 больных (4 женщины).
При подтверждении предракового заболевания желудка (метаплазии, дисплазии) больным предлагалось комбинированное лечение в несколько этапов.
I этап направлен на ликвидацию раздражающего фактора, эрадикацию геликобактер пилори, состоял из двух антибактериальных препаратов: кларитромицина 500 мг 2 раза в день и метронидазола 250 мг 3 раза в день с добавлением препарата висмута – викаира по 1 т. 3 раза в день (предпочтение викаиру отдавалось из-за дешевизны: он дешевле Де-Нола в десятки раз). С целью эрадикации геликобактер пилори длительность лечения составляла 7–8 дней. Микроорганизмы в ряде случаев по-прежнему оставались на слизистой оболочке, но количество их значительно уменьшалось. Это отмечалось визуально по интенсивности окраски геликотест-полосок, а также при микроскопическом исследовании. При дуоденогастральном рефлюксе назначали антирефлюксные препараты, в частности церукал, мотилиум в таблетированном или в инъекционном виде. Одновременно с антибактериальными препаратами назначался настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды лежа 15 мин 7 дней.
II этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 18–20 дней.
III этап: настой чистотела большого по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели.
IV этап: настойка золотого уса по 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.
Настой чистотела большого и настойка золотого уса приготавливались по рецепту, их дозировка была щадящей для организма человека (патент на изобретение № 2467758 от 27.11.2012 г.) .
Научные исследования проводились при информированном согласии больного согласно международным требованиям ВОЗ (правила GCP – Good Clinical Practice), предъявляемым к медицинским исследованиям с участием человека (Женева, 1993).
Больным проводилось эндоскопическое обследование верхних отделов желудочно-кишечного тракта. Использовалось эндоскопическое оборудование: эзофагогастрофиброскопы японских фирм «Olympus»-Gif-E и «Pentax» PG-29P, для взятия биопсийного материала применялись биопсийные щипцы. При подозрении на предраковое заболевание желудка обязательно производилась биопсия. Биоптат помещался в 10%-ный раствор формалина. Также производился забор (биопсия) тканей на микрофлору желудка биопсийными щипцами. Для оценки микрофлоры в момент эндоскопии брались два кусочка тканей со слизистой оболочки средней трети и антрального отдела желудка. Определяли геликобактер пилори (Нр) и дрожжеподобный мицелий. Нр оценивался и по геликотесту с помощью специальных тест-полосок. Гистологические исследования проводились в патологоанатомических отделениях Республиканской клинической больницы № 4 г. Саранска и в Республиканском онкологическом диспансере.
Методы исследования
Больным выполняли общеклинические и биохимические исследования. Биохимические анализы крови больным проводились до и после комбинированного лечения в динамике с целью определения возможного токсического воздействия разработанной лечебной схемы на организм.
Оценивали состояние липидного обмена в плазме крови. Липиды из плазмы крови экстрагировали хлороформметаноловой смесью (Хиггинс Дж. А., 1990). Липиды фракционировали методом тонкослойной хроматографии (Хиггинс Дж. А., 1990; Vaskovsky V.E. et al., 1975). Молекулярный анализ проводили на денситометре Model GS-670 (BIO-RAD, США) с соответствующим программным обеспечением (Phosphor Analyst/PS Sowtware). Контрольные сроки оценки биохимических показателей и показателей липидного обмена: до лечения, 5-е, 10-е, 15-е, 30-е сутки в процессе лечения.
Полученные цифровые экспериментальные данные обработаны методом вариационной статистики с использованием t-критерия Стьюдента и χ2.
Результаты исследования и их обсуждение
Проведенные исследования показали, что чаще предраковые заболевания локализуются в антральном отделе желудка (31 (73,8%) больной), реже (11 (26,2%) больных) – в верхней трети тела или свода желудка по данным эндоскопической диагностики. Макровизуальная эндоскопическая картина слизистой оболочки желудка определялась в виде ее истончения, на фоне которой могли быть гиперплазии разных оттенков или разной высоты, протрузии, полипы, дефекты в виде эрозий или язвенных поражений.
У всех обследованных больных, как в основной группе, так и в группе сравнения, на тест-полосках определялся геликобактер пилори. При микроскопическом исследовании же Нр не всегда (12 (28,6%) больных) регистрировался визуально. В ряде случаев (19 (42,5% больных) геликобактер пилори в пищеводе в количественном отношении определялся больше, чем в желудке.
По данным эндоскопических исследований желудка после первого сеанса комбинированного терапевтического лечения в 32 (76,2%) наблюдениях у больных основной группы полипы исчезали полностью, в остальных – уменьшались в размерах. Дисплазии тяжелой степени (III степени), а также ранние стадии злокачественных образований регрессировали после одного сеанса лечения. Это подтверждалось и при гистологических исследованиях. В биоптатах микроскопически не обнаруживалась патологическая картина в виде аденоматозных или гиперпластических полипов, дисплазий, а также аденокарцином. Подчеркнем, что после трех сеансов комбинированной терапии полипы до 2,0 см высотой полностью регрессировали (рис. 1, 2).
Клинические примеры приведены ниже.
Больная П., 62 лет. 4.05.07г. жалобы на тяжесть в эпигастрии, отрыжку воздухом. ЭГДФС: Полушаровидный полип (0,8×0,8см) большой кривизны середины тела желудка. Смешанный гастрит. Дуоденит. НР (+++). Микроскопия от 7.05.2007 г.: аденоматозный полип слизистой желудка с признаками полиморфизма желез, осклизнением эпителия, очагами поверхностных эрозий и элементами грубой интестинальной перестройки. Лечение: I этап — Пилобакт 1 полоска утр., 1 полоска на ночь 7 дней, чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели.ЭГДФС: Регрессия полипа. Субатрофический гастрит. НР (+) с антрального отдела желудка. Микроскопия от 9.08.2007 г.: слизистая желудка с признаками очаговой атрофии желёз, слабовыраженной полиморфноклеточной инфильтрацией в строме.
Больная М., 60 лет. Жалобы на тошноту после еды и тяжесть в эпигастрии. 12.05.2009 г. ЭГДФС: Афтозные гиперплазии антрального отдела (эрозии до 0,2 см, гиперемированные гиперплазии до 0,7 см) желудка. Смешанный гастрит. Поверхностный дуоденит. Дуоденогастральный рефлюкс. НР (+++). Микроскопия от 17.05.2009 г.: картина гиперпластического полипа желудка. Лечение: I этап — Викаир по 1 таб. 3 раза в день, метронидозол по 1 таб. 3 р. за 30 мин. до еды 7 дней, Чистотел большой по 2 ст. л. 3 раза в день 7 дней. II этап — золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. III этап — чистотел большой по 2 ст. л. 3 раза в день за 40 мин до еды 3 недели; IV этап – золотой ус 1 ч. Л. 3 раза в день за 40 мин до еды 3 недели. 16.10.2009 г.: жалоб нет. ЭГДФС: Полная регрессия полипа. Атрофический гастрит. Микроскопия от 16.10.2009 г.: фрагмент слизистой желудка с диффузной умеренно выраженной воспалительной инфильтрацией в строме.
|
|
|
|
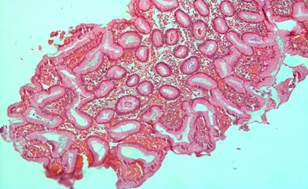
Рис. 1. Фрагменты гиперпластического (аденоматозного) полипа слизистой желудка (до лечения). Окраска гематоксилин эозином. × 200 |
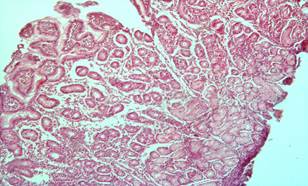
Рис. 2. Фрагменты слизистой желудка с признаками гиперплазии отдельных желёз, участками атрофии желёз, полиморфноклеточной инфильтрацией в строме (после лечения). Окраска гематоксилин эозином. × 200 |
Эндоскопический контроль в отдаленном периоде (до 5 лет) удалось провести 34 (81,0%) больным. Рецидивов не выявлено ни в одном случае.
Положительный эффект терапии выражался и в том, что на ее фоне не отмечались существенные расстройства гомеостаза, подтвержденные биохимическими исследованиями. В биохимических показателях крови до лечения и после проведенного комбинированного лечения по специальной схеме не было значительных отклонений от нормы. Общее состояние больных при проведении терапии и после нее не страдало, а в конце терапии субъективно отмечалось улучшение состояния.
В патогенезе различных заболеваний, в том числе и предопухолевой патологии, значительную роль играют нарушения липидного обмена, что обусловлено важностью липидов в молекулярной организации и функционировании живых структур. Проведенные нами исследования показали, что предопухолевые заболевания желудка тесно сопряжены с липидными дестабилизациями в плазме крови (табл. 1).
Таблица 1
Содержание некоторых липидов в плазме крови (M±m)
Примечание: группа I (группа сравнения); группа II (основная группа); * – данные, изменение которых достоверно по отношению к норме при p<0,05; жирный шрифт – достоверность между первой и второй группы при р<0,05
Исследования показали, что в обеих анализируемых группах имели место дислипидные явления в плазме крови. До начала лечения у больных с предопухолевыми заболеваниями желудка обеих групп на 48,7 и 45,8% (р<0,05) соответственно возрастал уровень эфиров холестерола. Зафиксировано также увеличение показателя свободных жирных кислот на 48,6 и 49,3% (р<0,05) соответственно. При этом удельный вес суммарных фосфолипидов снижался на 16,5 и 16,8% (р<0,05) соответственно относительно нормы. Показатели триацилглицеридов и холестерола в обеих анализируемых группах статистически значимо от нормы не отличались (табл. 1).
В процессе лечения в основной группе больных наблюдалась отчетливая тенденция к снижению уровня эфиров холестерола, свободных жирных кислот и увеличению суммарных фосфолипидов с 5-е по 30-е сутки терапии. Важно отметить, что данные показатели достигали нормы к 30-м суткам наблюдения. В группе сравнения существенной динамики данных показателей не наблюдалось. Уровень холестерола и триглицеридов в обеих анализируемых группах не имел достоверной динамики во время всего периода наблюдения.
При анализе полученных результатов в сравнительном аспекте нами установлен весьма интересный факт, что на фоне проводимой комплексной терапии дислипидные явления в основной группе по сравнению с группой сравнения не увеличивались, а, напротив, через 15–30 суток терапии имели явную тенденцию к уменьшению, и по некоторым показателям зафиксировано достоверное уменьшение. В итоге можно констатировать, что использованная фитотерапия не приводила к увеличению расстройств гомеостаза, а по ряду показателей корригировала их.
Таким образом, в работе показана возможность широкого применения данного комбинированного метода лечения у пациентов пожилого и старческого возраста с целью лечения и профилактики возникновения предраковых заболеваний желудка.
Заключение
Клинико-инструментальный и лабораторно-морфологический анализ 42 больных старших (60–89 лет) возрастных групп с предраковыми заболеваниями и ранними стадиями рака желудка показал, что применение комбинированного метода лечения с использованием фитотерапии, включающей настой из чистотела большого и настойку золотого уса, приводит к положительному клинико-морфологическому эффекту и коррекции нарушений липидного обмена. Получен положительный местный лечебный эффект, проявляющийся в трансформации патологически измененных тканей желудка в неизмененные. Доказано отсутствие отрицательного воздействия комплексной лекарственной терапии на организм больных. К положительным преимуществам отнесем доступность и дешивизну разработанной схемы терапии.
Библиографическая ссылка
Курусин В.М., Власов А.П., Полозова Э.И., Землякова К.В., Лещанкина Н.Ю. КОМБИНИРОВАННЫЙ ТЕРАПЕВТИЧЕСКИЙ МЕТОД ЛЕЧЕНИЯ ПРЕДРАКОВЫХ ЗАБОЛЕВАНИЙ ЖЕЛУДКА У БОЛЬНЫХ СТАРШИХ ВОЗРАСТНЫХ ГРУПП // Современные проблемы науки и образования. – 2015. – № 2-3.;
URL: http://www.science-education.ru/ru/article/view?id=23744 (дата обращения: 29.10.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Различные состояния, в основе которых лежат пролиферативные, воспалительные и инфильтративные процессы, связаны с появлением крупных или гигантских складок желудка . При всех этих состояниях внешний вид складок сходен, несмотря на первичное вовлечения слизистой оболочки, подслизистого слоя или их обоих при каждой конкретной патологии. Таким образом, причина увеличения складок не может быть определена только путем внешнего осмотра.
Определение
Термин «Болезнь Менетрие» часто применяется к любому состоянию при котором размер складок желудка увеличен . Это неточное определение ведет к возникновению путаницы в литературе и не позволяет провести различие между гиперплазией (увеличением числа клеток, что имеет место при болезни Менетрие и синдроме Золлингера-Эллисона) и гипертрофией (увеличение массы клетки или органа, что так же наблюдается при некоторых состояниях) . Наилучшим способом классификации состояний связанных с увеличением складок желудка является разделение их на две больших категории:
- Гиперпластические гастропатии
- Увеличение складок желудка связанное с другими причинами
Гиперпластическая гастропатия
Гиперпластическая гастропатия относится к состояниям ограниченным телом и дном желудка и связанным с избыточным количеством эпителиальных клеток слизистой оболочки . Выделяют два основных типа данной патологии:
- Эпителиальная гиперплазия захватывающая поверхностные и фовеолярные клетки слизистой (фовеолярная гиперплазия); кислотопродуцирующие клетки могут быть в нормальном или атрофированном состоянии. Это характерные изменения для болезни Менетрие.
- Увеличение количества париетальных без изменений в поверхностных и фовеолярных клеток слизистой. Эти изменения наблюдаются при синдроме Золингера-Элисона.
Смешанный тип гиперпластической гастропатии, при котором как слизь продуцирующие так и кислотопродуцирующие клетки дают картину гиперплазии, может так же наблюдаться при таких состояниях как лимфоцитарный и Нр ассоциированный гастрит.
Большинство пациентов, у которых при эндоскопическом исследовании выявляются увеличенные складки желудка, не имеют болезни Менетрие. В одном исследовании, например, петлевая эндоскопическая биопсия выполнялась у 52 пациентов с большими желудочными складками (больше 1 см шириной и сохраняющиеся при инсуфляции воздуха) . Основными находками были:
- Хронический гастрит/лимфоидная гиперплазия — 40 %
- Доброкачественные опухоли — 16 %
- Рак желудка — 12 %
- Синдром Золлингера-Эллисона — 10 %
- Болезнь Менетрие — 8 %
Болезнь Менетрие
Менетрие описал два типа нарушений ассоциированных с полиповидными разрастаниями в желудке, которые он попытался связать с карциномой желудка .
- Первый (называемый «polyadenomes polypeux») состоит из множественных не сливающихся полипов желудка, которые в настоящее время классифицируются как гиперпластические полипы .
- Второй (который он назвал полиаденоматозом Менетрие, или множественными простыневидными (sheet-like) аденомами) является новым типом ассоциированным с фовеолярной гиперплазией и должен по закону носить его имя .
Патогенез
Патогенез болезни Менетрие не вполне понятен, но может реализовываться через трансформирующий фактора роста альфа (TGF-alpha). TGF-alpha усиливает продукцию желудком слизи и ингибирует секрецию кислоты . Уровень TGF-alpha в клетках слизистой желудка у пациентов с болезнью Менетрие значительно увеличен . Роль TGF-alpha дополнительно подтверждается при исследовании на мышах в котором гиперпродукция TGF-alpha связанна со значительной гиперплазией слизь продуцирующих клеток желудка, сравнимой с таковой обнаруживаемой у людей с болезнью Менетрие . Эти мыши так же имели сниженную базальную и гистамин стимулированную секрецию кислоты, сходную с наблюдаемой у людей с болезнью Менетрие . TGF-alpha может оказывать свой эффект путем связывания с эпидермальными рецепторами фактора роста. Это было предположено на основании сообщения о пациенте с наступившим клиническим улучшением после лечения моноклональными антителами, направленными против эпидермальных рецепторов фактора роста . Сходную связь с цитомеголовирусной инфекцией наблюдается при так называемой детской болезни Менетрие. Ее механизм может так же реализовываться через TGF-alpha . Однако при различных видах воспаления и регенеративного ответа в желудке могут так же наблюдаться увеличения фовеолярного TGF-alpha, демонстрируя, что эти находки могут быть неспецифичными . В дополнение к этому, данная патология может быть примером неправильного использования термина болезнь Менетрие к другим формам гипертрофической гастропатии.
Клиническая манифестация
Пациенты с болезнью Менетрие могут иметь различные клинические симптомы, включая эпигастральную боль, значительную потерю веса, тошноту, рвоту, желудочно-кишечное кровотечение, диарею и гастроэнтеропатию с потерей белка . В одном исследовании включавшим 40 пациентов без морфологического подтверждения болезни Менетрие, основными жалобами были:
- Боль в эпигастрии — 65 %
- Астения — 60 %
- Анорексия — 45 %
- Потеря веса — 45 %
- Отек — 38 %
- Рвота — 38 %
В дополнение к этому примерно 80 % пациентов имели гипоальбуминенмию и увеличенную кишечную потерю белка. В других исследованиях, гипоальбуминемия присутствовала у 20-100 % пациентов, но ее наличие не служит отличительным признаком болезни Менетрие от других причин увеличения складок желудка, кроме синдрома Золлингера-Эллисона . Базальная и стимулированная желудочная секреция соляной кислоты при болезни Менетрие обычно снижена или нормальная, но варьирует в зависимости от стадии заболевания . Может присутствовать незначительное и среднее повышение концентрации гастрина в сыворотки крови . Дополнительные клинические и лабораторные данные сходны с таковыми при других формах гастроэнтеропатий с потерей белка.
Диагноз
Диагноз болезни Менетрие выставляется на основе выявления экстремальной степени фовеолярной гиперплазии с атрофией желез при биопсии у пациента со значительным увеличением складок желудка наблюдаемым при эндоскопическом исследовании или рентгенографии с барием. Биопсия «на всю толщу» или петлевая биопсия обычно необходима . Увеличенные складки ограничены телом и дном желудка. Складки обычно увеличены симметрично, хотя редко может встречаться асимметричное «полиповидное» увеличение.
Лечение
Множество медикаментов (включая антациды, антихолинергические препараты, преднизолон, Н2-блокаторы, ингибиторы протонной помпы и простогландины) используются в лечении пациентов с болезнью Менетрие, но стабильная эффективность не одного из них не доказана . Одним исключением может быть лечение направленное на эрадикацию Нр, однако, такие пациенты, возможно, имеют гастрит ассоциированный с Нр как причину увеличения складок желудка (смотри ниже). На основе результатов лечения пациента с болезнью Менетрие сообщают об эффективности октреотида (100 мг подкожно 2 раза в сутки) в уменьшении энтеральной потери белка . Другое подобное сообщение свидетельствует об улучшении после лечения моноклональными антителами направленными против эпидермальных рецепторов фактора роста . Хирургическое лечение оправдано для пациентов с некупируемой болью, гипоальбуминемией с отеком, кровотечением, обструкцией привратника и у тех пациентов, у которых злокачественное поражение не может быть . Боль часто облегчается и гипоальбуминемия корригируется после резекции желудка. Хотя субтотальная гастрэктомия является наиболее часто используемой операцией, тотальная гастрэктомия так же оправдана т.к. эта операция позволяет удалить всю патологическую слизистую и предупредить развитие рака желудка (смотри ниже) . В дополнении к этому, большинство смертей в послеоперационный период имеет место у пациентов перенесших субтотальную гастрэктомию. Многие из этих смертей связанны с недостаточностью анастомоза, что, возможно, отражает сложность создания крепкого анастомоза между нормальной и гиперплазированной слизистой .
Прогноз
Естественное течение болезни Менетрие не вполне изучено. Симптомы могут существовать в течение десятилетий . Имеются разрозненные сообщения о прогрессировании болезни Менетрие в атрофию слизистой оболочки желудка через 4-8 лет заболевания с возращением концентрации альбумина сыворотки к нормальным цифрам . Однако, в свете современных воззрений, по крайне мере часть из этих пациентов, возможно, имели гастрит ассоциированный с Нр, а не болезнь Менетрие. Риск развития рака желудка у пациентов с болезнью Менетрие не вполне ясен и по разным оценкам варьирует от 2 до 15 % . Одним из возможных объяснений такого разброса в цифрах — неточная диагностика болезни Менетрие во многих случаях, когда это состояние было ассоциировано с карциномой желудка. Существует только небольшое количество сообщений о болезни Менетрие предшествующей раку желудка на один или более лет . Гипотеза, что риск развития карциномы при болезни Менетрие ниже, чем считалась ранее возникла после наблюдения 43 пациентов с данным заболеванием у которых в течение 10 лет не было выявлено ни одного случая рака . Другие сообщения свидетельствуют, что сепсис и сосудистые тромбоэмболические осложнения могут являться большей угрозой для пациентов с болезнью Менетрие, чем злокачественная трансформация .
Синдром Золлингера-Эллисона
Синдром Золлингера-Эллисона (гиперсекреция гастрина из-за развития гастриномы) является гиперпластической гастропатией вовлекающей тело и дно желудка. Гиперплазируются (в отличие от болезни Менетрие) париетальные клетки, что приводит к гиперсекреции гастрина и кислоты. Увеличенные складки желудка связанные с другими заболеваниями Увеличенные складки желудка так же описаны при других состояниях включая гастрит ассоциированный с Нр и неоплазию.
Helicobacter pylori
Острый ассоциированный с Нр гастрит может вызывать выраженное воспаление и увеличение складок желудка, которые даже могут иметь вид сходный с таковым при злокачественных заболеваниях. При хроническом Нр ассоциированном гастрите может так же наблюдаться увеличение складок желудка симулирующее болезнь Менетрие . Несколько сообщений указывают на обнаружение увеличенных складок желудка в его дне и теле с железистой гиперплазией, гиперсекрецией и с наличием или отсутствием гипоальбыминемии у пациентов без синдрома Золлингера-Эллисона . В прошлом эти случаи относили к гастриту с гипертрофией желез , гипертрофической гиперсекреторной гастропатии , и болезни Schindler . Однако существуют два наблюдения указывающих на роль играемую Helicobacter pylori в развитии данной патологии:
- Обследование опубликованных микрофотографий этих пациентов показали, что буквально все они имели гастрит соответствующий вызванному Нр инфекцией .
- В одном исследовании, 18 из 32 пациентов с утолщенными складками желудка были инфицированы Нр . Анти Нр терапия вела к нормализации размеров складок желудка. Подобные находки были описаны и в других сообщениях . Заслуживает упоминания факт, что в двух из этих сообщений , термин «болезнь Менетрие» неоправданно применялся для обозначения состояния связанного с увеличенными складками желудка.
Неоплазия
Неопластические заболевания, в особенности лимфома, аденокарцинома и карцинойдные опухоли должны быть исключены у пациентов с увеличением складок желудка .
Другие причины
Различные другие заболевания могут быть связанны с увеличением складок желудка включая лимфоцитарный гастрит (который может быть в некоторых случаях ассоциированным с Нр ), саркоидоз, эозинофильный гастроэнтерит и синдром Cronkhite-Canada .