Гиперплазия эндометрия аденомиоз
V.F. Snegirev Archives of Obstetrics and Gynecology. 2016, 3 (3) DOI http://dx.doi.org/1Q.18821/2313-8726-2016-3-3-13Q-135
Literature reviews
Обзоры литературы
© КОЛЛЕКТИВ АВТОРОВ, 2016 УДК 618.14-006.03-092-08
Кудрина Е.А., Жолобова М.Н., Масякина А.В.
СОВРЕМЕННЫЕ АСПЕКТЫ ПАТОГЕНЕЗА И ЛЕЧЕНИЯ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ, МИОМЫ МАТКИ И АДЕНОМИОЗА
ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России, кафедра акушерства и гинекологии № 1, 119045, Москва
Для корреспонденции: Жолобова Мария Николаевна, канд. мед. наук, доцент кафедры акушерства и гинекологии № 1 ФГБОУ ВО «Первый Московский государственный медицинский университет им. И.М. Сеченова» Минздрава России; e-mail: angel1345@mail.ru
В обзоре представлены современные аспекты патогенеза доброкачественных заболеваний матки (миома матки, аденомиоз, гиперплазия эндометрия). Освещены вопросы дифференцированного подхода к лечению данных заболеваний.
Ключевые слова: миома матки; аденомиоз; гиперплазия эндометрия.
Kudrina E.A., Zholobova M.N., Masyakina A.V.
MODERN ASPECTS OF PATHOGENESIS AND TREATMENT OF ENDOMETRIAL HYPERPLASIA, UTERINE FIBROIDS AND ADENOMYOSIS
Keywords: uterine fibroids; adenomyosis; endometrial hyperplasia.
Conflict of interest. The authors declare no conflict of interest.
Funding. The study had no sponsorship.
Received 06.09.2016 Accepted 20.09.2016
Доброкачественные гиперпластические заболевания матки (ДГЗМ) представляют собой актуальную медико-социальную проблему, причем за последнее время ее значимость существенно выросла, что связано с неуклонным ростом числа подобных заболеваний среди населения. К данной группе заболеваний ряд авторов относят гиперплазию эндометрия (ГЭ), миому матки (ММ) и аденомиоз (АМ) .
Отечественные исследователи И.С. Сидорова (2011 г.), С.А. Леваков (2011 г.), И.В. Станоевич (2013 г.) описывают сочетанную доброкачественную патологию матки как «гиперпластический синдром», подчеркивая тем самым схожие черты патогенеза ГЭ, ММ и АМ. В основе развития данных заболеваний лежат патогенетически сходные патологические процессы тканей эндо- и миометрия.
В последние десятилетия отмечен неуклонный рост заболеваемости ГЭ, ММ и АМ в индустриально раз-
витых странах, что позволяет отнести их к «болезням цивилизации» .
Для гиперпластических заболеваний матки характерна общность факторов риска, а именно: наследственная предрасположенность, искусственное подавление генеративной функции, хронические воспалительные заболевания как генитальной, так и экстрагениталь-ной локализации, эндокринно-обменные нарушения (ЭОН), хроническая ановуляция, гиперпролактинемия, гормонпродуцирующие опухоли яичников .
С современных позиций в качестве основных вза-имопотенциирующих механизмов развития и про-грессирования ГЭ, ММ и АМ следует рассматривать гиперэстрогению, хроническое воспаление, изменение экспрессии прото- и антионкогенов .
Многие исследователи считают, что решающим фактором, индуцирующим развитие ГЭ, ММ и АМ, является гиперэстрогенемия, а именно локальная гипер-
Архив акушерства и гинекологии им. В.Ф. Снегирева. 2016, 3 (3) РР! http://dx.doi.org/10.18821/2313-8726-2016-3-3-130-135_
Обзоры литературы
эстрадиолемия, не сбалансированная локальной гипер-прогестеронемией .
Современный этап изучения гиперпластических процессов миометрия и эндометрия характеризуется определением роли факторов роста в реализации ауто-и паракринных влияний на опухолевый процесс в матке .
Вопросы патогенеза ММ и эндометриоза остаются предметом многочисленных научных исследований . Развитие молекулярной биологии, медицинской генетики, клинической иммунологии позволило доказать наличие генетических, гормональных и иммунологических нарушений в патогенезе ММ, АМ и гиперпластических процессов эндометрия .
Установлено, что в модуляции активности эндо- и миометрия помимо гормонов могут играть роль и другие биологически активные соединения, осуществляющие ауто-паракринную регуляцию клеточного роста, такие как полипептидные факторы роста и цитокины .
Многие авторы отмечают ведущую роль в развитии ДГЗМ таких процессов, как повышение пролифератив-ного потенциала, снижение апоптоза, патологический неоангиогенез, повышенная экспрессия инсулиноподоб-ного фактора роста 1 (ИФР-1, или англ. ЮР-1) .
Усиление экспрессии вышеперечисленных факторов роста и их рецепторов в ММ, АМ и ГЭ, регулирующих процессы ангиогенеза, пролиферации и апоптоза, приводит к возникновению патологических кровотечений.
Предположительно основную роль в этом процессе играют не только сосудистый эндотелиальный фактор роста, но и фактор роста фибробластов, трансформирующий Р-фактор роста, паратиреоидный гормонопо-добный протеин и пролактин .
Миома матки традиционно считается наиболее распространенным гинекологическим заболеванием, частота встречаемости которого среди женщин старше 35 лет колеблется по данным разных авторов в интервале 25—50% .
ММ — доброкачественная гормонально-чувствительная опухоль, развивающаяся в результате гипертрофии и пролиферации элементов мышечной и соединительной ткани матки .
Многие авторы, в том числе и зарубежные , подчеркивают, что начало возникновения узлов ММ приходится на поздний репродуктивный возраст, когда у женщин накапливаются соматические, гинекологические заболевания и эндокринно-обменные нарушения (ЭОН).
Суммирование патологических факторов в этом возрасте вызывает соматическую мутацию клеток в органах репродуктивной системы, что, вероятно, играет ведущую роль на стадии формирования пролифератив-ного компонента при процессах регенерации поврежденных клеток миометрия .
Многие авторы также указывают, что для последующего роста узлов опухоли требуется дальнейшее
накопление неблагоприятных факторов, вызывающих опухолевую прогрессию: отсутствие родов и лактации к 30 годам, искусственные аборты, длительная неадекватная контрацепция, хронические, подострые и острые воспалительные заболевания матки и придатков, стрессы, ультрафиолетовое облучение, наличие доброкачественных опухолей яичников .
Особенности клинического течения ММ и прогноз заболевания определяются прежде всего вариантом ее развития, морфологической формой (простая и проли-ферирующая ММ), локализацией миоматозных узлов, их размерами и ростом .
Простая ММ представлена короткими пучками гладкомышечных клеток с признаками гипертрофии, с редкими фигурами митозов и хорошо развитой зрелой стромой, бедной сосудами. Пролиферирующая форма наиболее часто представлена клеточной и митотиче-ски активной ММ. Клеточная ММ характеризуется выраженной гипертрофией лейомиоцитов и незрелой стромой, а также выраженной васкуляризацией при редких митозах. Митотически активная ММ отличается заметным увеличением количества фигур митозов, появлением значительного количества «зон роста» и периартериолярных клеточных муфт .
У пациенток в перименопаузальном возрасте в сочетании с ММ часто выявляется АМ, характеризующийся инвазией клеток эутопического эндометрия в подлежащие слои миометрия и автономным ростом эктопической эндометриоидной ткани, возникающих в результате нарушения баланса между пролифератив-ной активностью и интенсивностью процессов апопто-за клеток эндометрия, усиленным неоангиогенезом . Инвазия и метастазирование при АМ сближает его с неопластическим процессом.
Однако частота «озлокачествления» очагов АМ, по данным литературы, сильно варьирует и составляет 0,1—24%, включая эндометриоидные гетеротопии других локализаций .
Примечательно, что АМ характеризируется значительной вариабельностью проявлений: от малосим-птомного течения до выраженной симптоматики с прослеживающейся тенденцией в виде активного и неактивного течения патологического процесса .
Очаги АМ представлены эпителиальным и стро-мальным компонентами в различных соотношениях. Активному АМ соответствуют очаги с преобладанием стромального компонента, неактивному АМ — очаги с преобладанием эпителиального компонента. В окружающем эндометриоидные очаги миометрии наблюдаются признаки дегенерации соединительной ткани, неоангио-генез с образованием сосудов синусоидного типа .
Гиперпластические процессы эндометрия у женщин в перименопаузе являются наиболее часто встречающейся патологией и часто сочетаются с патологией миометрия.
Частота встречаемости гиперпластических процессов эндометрия в структуре гинекологических за-
болеваний занимает 10—50% и неуклонно растет . Истинную распространенность ГЭ оценить очень сложно . Исследование молекулярных механизмов гиперпластических процессов и поиск их фармакологической коррекции — одна из самых динамично развивающихся областей современной молекулярной медицины. Понимание базисных основ индукции клеточного роста, особенно в условиях опухолевой трансформации клеток, является неотъемлемой частью управления и мониторирования пролиферативной активности . Особенную актуальность приобретает возникновение пролиферации в условиях старения — перименопаузы.
ГЭ представляет собой гетерогенную группу патологических процессов, включающих в себя изменения, распределяющиеся от доброкачественной эстроген-зависимой пролиферации желез до моноклональных разрастаний генетически измененной ткани . Частота рецидивирования ГЭ составляет около 30% после лечения до 50% без лечения . Частота ма-лигнизации зависит от предшествующей формы ГЭ и изменяется в пределах 0,25—50% .
Простая ГЭ без атипии — наиболее часто встречающийся вариант заболевания. Для него характерно повышенное количество железистых и стромальных элементов без структурной перестройки эндометрия. Комплексная (сложная) ГЭ без атипии предполагает изменение расположения желез, изменение их формы и размера, уменьшение выраженности стромального компонента, то есть наличие структурных изменений ткани при отсутствии клеточной атипии. Простая ГЭ с атипией отличается наличием атипичных клеток желез. При этом структурные изменения желез, имеющих причудливую форму, отсутствуют, а эпителий демонстрирует повышенную митотическую активность.
Комплексная (сложная) ГЭ с атипией характеризуется выраженной пролиферацией железистого компонента, сочетающейся с явлениями атипии как на тканевом, так и на клеточном уровне, но без инвазии ба-зальной мембраны железистых структур. Железистый эпителий многорядный с признаками полиморфизма. Цитоплазма эпителиальных клеток увеличена в размерах, эозинофильна; ядра клеток также увеличены, бледные. Отчетливо идентифицируются глыбки хроматина и крупные ядрышки. Увеличена митотическая активность, возрастает число и спектр патологических митозов.
Проблема лечения больных с гиперпластическими заболеваниями матки (ГЭ, ММ, АМ), по мнению большинства исследователей, продолжает оставаться актуальной в современной гинекологии ввиду не только высокой частоты их встречаемости, но и значительного отрицательного влияния на репродуктивную систему, качество жизни и общее состояние здоровья женщины .
Многочисленные исследования свидетельствуют, что в позднем репродуктивном возрасте (35—44 года)
V.F. Snegirev Archives of Obstetrics and Gynecology. 2016, 3 (3) DOI http://dx.doi.org/10.18821/2313-8726-2016-3-3-130-135
Literature reviews
происходит снижение функциональной активности яичников и их чувствительности к гонадотропной стимуляции, синхронное увеличение продукции гонадо-тропных гормонов, возникает хроническое напряжение функциональных систем регуляции (нейроэндокрин-ной, гормональной, иммунной), нарушение гемостаза и гомеостаза, что инициирует рост и прогрессирование гиперпластических заболеваний матки .
В современных условиях лечение больных с ММ и АМ включает в себя применение оперативных и консервативных методов терапии с учетом индивидуального и дифференцированного подхода в зависимости от возраста больной, выраженности клинической симптоматики, распространенности процесса, длительности заболевания, наличия экстрагенитальной патологии, эффективности от ранее проведенной терапии .
Самая высокая частота оперативных вмешательств приходится на возраст 44—54 года (чаще всего это гистерэктомия), показанием к ним являются манифестные пролиферативные заболевания матки: ГЭ, ММ, АМ и их сочетания с опухолями яичников .
Как правило, в случае сочетанной доброкачественной патологии матки предпочтение отдается гистерэктомии. Преимуществом радикального хирургического лечения является полное устранение патологического процесса матки, к недостаткам относятся его травма-тичность для женщины, более длительная реабилитация в послеоперационном периоде, утрата менструальной и репродуктивной функции. В случае изолированной миомы матки возможно проведение оперативного лечения в объеме миомэктомии. Основным преимуществом миомэктомии является сохранение фертиль-ности, к основным недостаткам относится высокая частота рецидивирования патологического процесса. При наличии сочетанной патологии матки проведение органосохраняющего лечения следует признать малоэффективным .
При наличии изолированной гиперплазии эндометрия существует методика аблации эндометрия, которая является менее травматичным вмешательством, чем гистерэктомия, может использоваться в старшей возрастной категории, когда применение эндотрахе-ального наркоза становится нежелательным .
Современные новые медицинские технологии предлагают применять при лечении миомы матки эмболи-зацию маточных артерий, а также фокусированную ультразвуковую (ФУЗ) аблацию очагов аденомиоза. Эти новые методики в настоящее время тщательно изучаются, их эффективность анализируется многими исследователями .
С учетом многофакторности патогенетических механизмов, приводящих к возникновению сочетания ММ и АМ, применение монотерапии в большинстве случаев не приводит к стойкому клиническому эффекту .
Главными критериями эффективности консервативного лечения служат купирование клинических
Архив акушерства и гинекологии им. В.Ф. Снегирева. 2016, 3 (3) DOI http://dx.doi.org/1Q.18821/2313-8726-2016-3-3-13Q-135_
Обзоры литературы
симптомов заболевания, отсутствие рецидивов, а также восстановление детородной функции у пациенток репродуктивного возраста .
Необходимо отметить, что ни один из существующих в настоящее время вариантов консервативного лечения не является полностью этиопатогенетическим, в связи с чем не исключается возможность дальнейшего прогрессирования заболевания, что может потребовать в дальнейшем хирургического вмешательства .
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
ЛИТЕРАТУРА
1. Сидорова И.С. (ред.). Миома матки (современные проблемы этиологии, патогененеза, диагностики и лечения). М.: МИА; 2007.
3. Адамян Л.В., Кулаков В.И. Эндометриозы: Руководство для врачей. М.: Медицина; 2006.
5. Тихомиров А.Л., Гришин Г.П., Лубнин Д.М. Современное ор-ганосохраняющее лечение миомы матки. Consilium Medicum. 2008; 10 (6): 19-23.
7. Сидорова И.С. Миома матки. М.: МИА; 2003.
8. Зайратьянц О.В., Сидорова И.С., Леваков С.А. Особенности морфогенеза и ангиогенеза лейомиомы матки. Арх. пат. 2005; 67 (3): 29-31.
12. Goodger A.M., Rogers P.A. Endometrial cell proliferation during the menstrual cycle.Hum. Reprod. 1994; 9 (3): 399-405.
13. Folkman J. Cáncer: Principales andPractice of Oncology. 5-th Ed. Lippincott-Raven Publishes; 1997: 3075-80.
14. Ищенко А.И., Кудрина Е.А. Эндометриоз: диагностика и лечение. М.: ГЭОТАР-Медиа; 2008.
15. Jequier E. Leptin signaling. Cell. Signall. 2002; 14: 655-63.
16. Бодяжина В.И., Сметник В.П., Тумилович Л.Г. Неоперативная гинекология: Руководство для врачей. М.: Медицина; 1990.
19. Игнатова В.Е. Морфологические и иммуногистохимические особенности разных гистологических типов лейомиомы матки: Дисс. . канд. мед. наук. М.; 2005.
23. Ищенко А.И., Ботвин М.А., Ланчинский В.И. Миома матки: этиология, патогенез, диагностика, лечение. М.: Видар; 2010: 6-9, 19-27.
25. Berek J.S., Hillard P.J.A., Adashi E. (Eds). Novak’s Gynecology. Lippincott Williams & Wilkins; 2002.
28. Кулаков В.И., Адамян Л.В., Аскольская С.И. Гистерэктомия и здоровье женщины. М.: Медицина; 1999.
33. Леваков С.А. Варианты развития миомы матки (простая и пролиферирующая): Дисс. … д-ра мед. наук. М.; 2001.
34. Савицкий Г.А., Савицкий А.Г. Миома матки: проблемы патогенеза и патогенетической терапии. СПб.: ЭЛБИ-СПб.; 2003.
37. Даниленко В.И., Малахов Р.В., Ягубова А.С. Морфология лейомиомы матки. Акуш. и гин. 2005; (3): 30-2.
39. Flake G.P. Etiology and pathogenesis of uterine leiomyomas: a review text. Environ. HlthPerspect. 2003; 3 (8): 1037-54.
41. Вихляева Е.М., Бохман Я.В. Системный подход к обоснованию факторов и формированию групп риска гормонзависимых опухолей. В кн.: Факторы риска гиперпластических процессов репродуктивной системы женщины: Тезисы докладов Всесоюзного симпозиума и пленума Проблемной комиссии «Охрана здоровья женщин вне беременности». Рига: МЗ Латв. ССР; 1985: 21-3.
43. Унанян А.Л. Эндометриоз тела матки и яичников: новые аспекты патогенеза, клиники и лечения: Дисс. . д-ра мед. наук. М.; 2007.
45. Акулинина И.Н. Клинико-патогенетическое обоснование выбора метода лечения больных с гиперпластическими процессами эндометрия: Дисс. . канд. мед. наук. Омск; 2002.
47. Томилова М.В. Прогностические факторы и патогенетические механизмы развития гиперпластических процессов эндометрия у женщин с хронической ановуляцией: Дисс. … канд. мед. наук. М.; 2006.
48. Epstein E., Valentin L. Managing women with post-menopausal bleeding. BestPractic. Res. Clin. Obstet. Gynecol. 2004; 18: 125-43.
49. Ho S.P., Tan K.T., Pang M.W., Ho T.H. Endometrial hyperplasia and the risk of endometrial carcinoma. Singapore Med. J. 1997; 38 (1): 11-5.
50. Василевская Л.Н., Панкина Г.И., Шкоденко В.А. Клинико-мор-фологические аспекты гиперпластических процессов эндометрия у больных миомой матки репродуктивного возраста. В кн.: Факторы риска гиперпластических процессов репродуктивной системы женщины: Тезисы докладов Всесоюзного симпозиума и пленума Проблемной комиссии «Охрана здоровья женщин вне беременности». Рига: МЗ Латв. ССР; 1985: 19-20.
51. Гаврилов A.C. Гиперпластические процессы. Профилактика рака эндометрия: Дисс. … канд. мед. наук. Благовещенск; 2005.
56. Заводова Ю.В. Сочетанная патология матки у женщин пост-менопаузального возраста: Дисс. … канд. мед. наук. М.; 2007.
7. Sidorova I.S. Uterine Fibroids. . Moscow: Ы!А; 2003. (in Russian)
12. Goodger A.M., Rogers P.A. Endometrial cell proliferation during the menstrual cycle. Hum. Reprod. 1994; 9 (3): 399-405.
V.F. Snegirev Archives of Obstetrics and Gynecology. 2016, 3 (3) DOI http://dx.doi.org/10.18821/2313-8726-2016-3-3-130-135
Literature reviews
13. Folkman J. Cancer: Principales and Practice of Oncology. 5 Ed. Lippincott-Raven Publishes; 1997: 3075-80.
15. Jequier E. Leptin signaling. Cell. Signall. 2002; 14: 655-63.
25. Berek J.S., Hillard P.J.A., Adashi E. (Eds). Novak’s Gynecology. Lippincott Williams & Wilkins; 2002.
33. Levakov S.A. Options for the Development of Uterine Fibroids (a Simple and Proliferating): Diss. Moscow; 2001. (in Russian)
37. Danilenko V.I., Malakhov R.V., Yagubova A.S. The morphology of uterine leiomyoma. Аkush. i gin. 2005; (3): 30-2. (in Russian)
Архив акушерства и гинекологии им. В.Ф. Снегирева. 2016, 3 (3) DOI http://dx.doi.org/10.18821/2313-8726-2016-3-3-130-135_
Обзоры литературы
production by different uterine leiomyomas. Hum. Reprod. 2006; 21 (21): 2545-54.
39. Flake G.P. Etiology and pathogenesis of uterine leiomyomas: a review text. Environ. Hlth Perspect. 2003; 3 (8): 1037-54.
48. Epstein E., Valentin L. Managing women with post-menopausal bleeding. BestPract. Res. Clin. Obstet. Gynecol. 2004; 18: 125-43.
49. Ho S.P., Tan K.T., Pang M.W., Ho T.H. Endometrial hyperplasia and the risk of endometrial carcinoma. Singapore Med. J. 1997; 38 (1): 11-5.
51. Gavrilov A.C. Hyperplastic Processes. Endometrial Cancer Prevention: Diss. Blagoveshchensk; 2005. (in Russian)
56. Zavodova Yu.V. Combined Uterine Pathology in Postmenopausal Women: Diss. Moscow; 2007. (in Russian)
Предраковые заболевания матки имеют риск трансформации в злокачественную опухоль.
К предраковым заболеваниям относят атипическую гиперплазию эндометрия. Атипическая гиперплазия эндометрия – процесс, который характеризуется избыточным разрастанием желез внутреннего слоя матки, причём клетки, формирующие эти железы, являются аномальными. Атипическая гиперплазия эндометрия развивается из гиперплазии эндометрия (избыточного образования желез нормального гистологического строения во внутренней оболочке матки) или из полипов эндометрия. Рак развивается приблизительно у трети женщин с атипической гиперплазией эндометрия.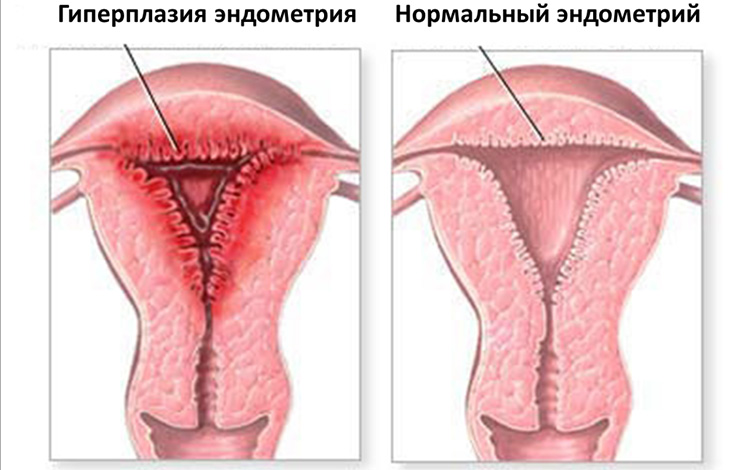
Факторами риска развития этого патологического состояния являются возраст (риск увеличивается с возрастом), гормонзаместительная терапия эстрогенами, ожирение, ожирение, раннее начало менструаций (до 12 лет) и позднее наступление климакса (после 55 лет), приём тамоксифена по поводу рака молочной железы, отсутствие родов, гиперплазия эндометрия, облучение органов таза в анамнезе.
Наиболее распространенными симптомами атипической гиперплазии эндометрия являются маточные кровотечения, иногда цитологическое исследование мазков из шейки матки (Pap-тест) выявляет наличие комплексов атипичных клеток эндометрия.
Диагностика атипической гиперплазии эндометрия основывается на биопсии эндометрия (проводится диагностическое выскабливание полости матки).
Тактика лечения атипической гиперплазии эндометрия зависит от многих факторов: степени клеточной атипии, симптомов (длительность кровотечения и объём кровопотери), желания женщины иметь возможность забеременеть.
Для женщин после периода менопаузы одним из методов хирургического лечения является удаление матки, яичников и маточных труб.
Женщинам молодого возраста, которые хотят в дальнейшем иметь ребёнка, предлагают гормональную терапию прогестероном.
Доброкачественные опухоли матки не способны к метастазированию и инвазивному росту (росту в ткань с ее разрушением), обычно не угрожают жизни.
К доброкачественным опухолям относятся миомы и фибромиомы матки. Эти опухоли состоят из мышечных клеток, аналогичных клеткам мышечного слоя матки. К 45 годам у 70% женщин имеются миомы. Эти опухоли обычно растут в молодом возрасте и уменьшаются после менопаузы.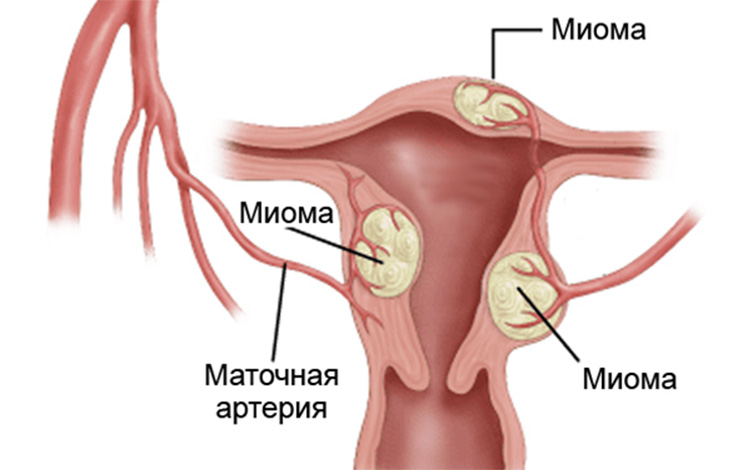
Факторы риска возникновения миом не изучены до конца, известна роль избыточного количества эстрогена и прогестерона в организме женщины. Эти опухоли чаще возникают у женщин, которые никогда не рожали, также существует связь с избыточной массой тела.
Симптомы миомы включают в себя ациклические или обильные маточные кровотечения (чаще при субмукозном расположении миомы), нарушение мочеиспускания, запоры, боль внизу живота, бесплодие.
Диагноз миомы может быть выставлен на основании данных осмотра гинеколога, трансвагинального УЗИ, МРТ, биопсии эндометрия (при субмукозном расположении узла), данных после удаления опухоли.
Лечение миомы матки может быть хирургическим и медикаментозным.
Лечение пациенток, страдающих гиперплазией эндометрия в сочетании с миомой матки
^ Л.А. Озолиня, И.А. Лапина, Е.Б. Болдина, Н.Н. Луценко
Кафедра акушерства и гинекологии Лечебного факультета Российского государственного медицинского университета им. Н.И. Пирогова
В статье представлены результаты исследования, посвященного выбору гормональной терапии у женщин в пременопаузальном периоде, имеющих гиперплазию эндометрия в сочетании с миомой матки малых размеров. Представлен сравнительный анализ эффективности и безопасности 6-месячного приема пациентками препаратов люкрин депо и дюфастон, приведены выводы и рекомендации.
Ключевые слова: гиперплазия эндометрия, миома матки, гормональная терапия.
В структуре гинекологической патологии довольно широко распространены такие гормонозависимые заболевания, как миома матки, эндометриоз, гиперплазия эндометрия; нередко они сочетаются у одной и той же пациентки, что усложняет лечение. До настоящего времени вопрос этиологии и патогенеза этих заболеваний является дискуссионным. Тем не менее не вызывает сомнений тот факт, что миома матки, эндоме-триоз и гиперплазия эндометрия являются гормонозависимыми заболеваниями и, таким образом, подвержены воздействию изменений гормонального статуса организма. Поскольку качественные и количественные изменения показателей крови во многом зависят от гормонального статуса, кратко рассмотрим особенности гормонального баланса при этой патологии.
Многие годы существовала теория, что основными причинами возникновения миомы матки, эндометриоза и гиперплазии эндометрия являются гиперэстрогения (в том числе локальная), недостаточность лютеиновой фазы (НЛФ) менструального цикла и, соответственно, прогестероновая
Контактная информация: Озолиня Людмила Анатольевна, ozolinya@yandex.ru
Лечебное дело 2.2011———————
недостаточность, а также повышенная продукция гонадотропных гормонов. Вместе с тем имеются данные о том, что у 70—75% больных содержание эстрогенов и прогестерона во время менструального цикла находится в пределах нормальных значений.
У пациенток с НЛФ и ановуляторными циклами отмечаются изменения содержания гормонов в крови, зависящие от функционального состояния репродуктивной системы, а у больных с ановуляторным циклом базальные уровни лютеинизирую-щего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) повышены на протяжении всего цикла и отсутствуют их ову-ляторные пики. Что касается эстрогенов, то у больных с данными видами патологии отмечено изменение ритма их секреции, но абсолютное содержание, как правило, не меняется.
В последние годы на первый план выходит теория, согласно которой помимо гормонального дисбаланса одним из возможных факторов, способствующих развитию миомы матки и гиперплазии эндометрия, является особенность рецепторного аппарата половых органов, тогда как системное изменение гормонального фона соответст-
Лечение гиперплазии эндометрия
вует физиологической норме данного возрастного периода.
В работах Г.А. Савицкого и соавт. большое значение придавалось изучению роли местных гормональных факторов. Было установлено, что при миоме матки имеется локальная гипергормонемия как приспособительная реакция, которая позволяет создать режим локальной гиперэстрогении.
В то же время до сих пор нет данных, подтверждающих прямое влияние эстрогенов на рост миомы. Многочисленные исследования, посвященные патогенезу опухолевого роста, показывают, что не только эстрогены, но и прогестерон и активаторы прогестероновых рецепторов стимулируют пролиферацию миомы. Рядом авторов экспериментально доказано, что опухолевый рост лейомиомы в значительной степени обусловлен повышенной прогестероновой стимуляцией.
Таким образом, несмотря на указанные противоречия в имеющихся данных и теориях, общее мнение сводится к тому, что основными факторами гормонального ге-неза доброкачественных пролиферативных заболеваний (миомы матки, эндометриоза, гиперплазии эндометрия) являются изменения содержания гормонов и соотношения между гормонами на различных уровнях эндокринной системы.
В настоящее время при лечении миомы матки, эндометриоза, гиперплазии эндометрия используют сочетание консервативных и хирургических воздействий, причем достаточно часто выполняются и радикальные операции. Вместе с тем радикальное хирургическое лечение имеет такие отрицательные стороны, как осложнения во время операции, потеря репродуктивной функции, снижение качества жизни и др. Поэтому в последние годы многочисленные исследования направлены на разработку комплексного лечения миомы матки и эндометриоза, основными методами которого являются малоинвазивные, органосохраняющие операции в сочетании с гормональной терапией. Лечение гиперплазии эндометрия в настоящее время в ос-
новном консервативное (гормональное), но некоторым больным показаны хирургические методы лечения (абляция эндометрия, оварэктомия, гистерэктомия).
Поиск методов эффективного медикаментозного лечения доброкачественных пролиферативных заболеваний продолжается. Медикаментозное лечение включает использование агонистов и антагонистов гонадотропин-рилизинг-гормона (ГнРГ), антигонадотропинов, гестагенов и анти-прогестинов, комбинированных эстроген-гестагенных препаратов и др. В последнее время всё больше внимания уделяется применению агонистов ГнРГ для лечения данных заболеваний.
В основе терапевтического действия агонистов ГнРГ лежит их связывание с рецепторами ГнРГ в гипофизе с последующей блокадой секреции гонадотропинов и, соответственно, половых стероидов, которые являются основными факторами пролиферативного роста миомы матки, а также развития гиперплазии эндометрия и эндомет-риоза. В результате обратимого подавления продукции ФСГ и ЛГ снижается концентрация в крови эстрадиола; в последующем агонисты ГнРГ воздействуют на яичники — вероятный механизм действия состоит в их прямом ингибирующем влиянии и уменьшении чувствительности к гонадотропинам. Воздействие агонистов ГнРГ приводит к снижению уровня эстрадиола до постменопаузальных значений. Это состояние сохраняется в течение всего периода лечения, сопровождается аменореей и приводит к торможению роста и обратному развитию гормонозависимых пролиферативных патологических образований. После прекращения лечения физиологическая секреция гормонов восстанавливается. «Идеальная” конечная цель терапии — полная регрессия патологической ткани, однако назначением только агонистов ГнРГ эта цель не всегда достигается, особенно при краткосрочном (3—4 мес) их применении. Таким образом, препараты данной группы целесообразно применять либо в качестве долгосрочной терапии (более 3—4 мес), либо как этап
Рекомендации по ведению больных
комплексного лечения, включающего хирургическое вмешательство.
Цель исследования — оценка эффективности применения агониста ГнРГ (лейпро-релина ацетата — ЛА) у больных с доброкачественными пролиферативными заболеваниями (гиперплазия эндометрия в сочетании с миомой матки) по сравнению с гестагенами (дидрогестероном — ДГ).
Материал и методы
Проведено обследование и лечение 60 больных гиперплазией эндометрия, сочетающейся с миомой матки малых размеров. Все обследованные пациентки были в пременопаузальном периоде, возраст 45—53 года, длительность заболевания от
14 мес до 11 лет. Больные были рандомизированы в две группы по 30 человек. Средний возраст пациенток 1-й группы составил
46.2 ± 1,6 года, 2-й группы — 47,1 ± 1,8 года.
Толщина эндометрия по результатам ультразвукового исследования (УЗИ) малого таза до раздельного диагностического выскабливания, выполненного в начале обследования, составляла в 1-й группе 12,7 ± ± 1,3 мм, а во 2-й группе — 12,1 ± 1,8 мм. При гистологическом исследовании эндометрия простая гиперплазия выявлена у
Критериями исключения были признаки атипии клеток, выраженный аденомиоз, ожирение, сахарный диабет, тяжелая артериальная гипертензия.
Размеры миоматозных узлов у обследованных больных колебались от 1,2 до 4,3 см, каждая пациентка имела от 1 до 5 узлов, и общие размеры матки не превышали ее размеры при беременности 7—8 нед.
Пациенткам 1-й группы назначали ЛА на 6 мес, пациенткам 2-й группы — ДГ также на 6 мес. Первую инъекцию ЛА в дозе 3,75 мг вводили в первые дни менструального цикла, а в дальнейшем — с интервалом в 28 дней. Дидрогестерон назначали по
20—30 мг/сут с 5-го по 25-й день менструального цикла. Динамическое наблюдение осуществляли в течение 1,5 лет.
В план обследования входило изучение анамнеза, клинической картины заболевания, специальное гинекологическое и лабораторное исследования, УЗИ органов малого таза, кольпоскопия, цитологическое исследование материала из экзо- и эн-доцервикса, гистероскопия, раздельное диагностическое выскабливание с последующим гистологическим исследованием.
По всем исследуемым параметрам группы пациенток были сопоставимы. Для оценки эффективности лечения пациенткам проводили повторные клинико-лабораторные исследования и выполняли контрольные УЗИ органов малого таза и аспи-рационную биопсию эндометрия через 3, 6 и 12 мес от начала лечения. В ряде случаев повторно было выполнено раздельное диагностическое выскабливание под контролем гистероскопии.
Результаты
Первая группа (лечение ЛА). После первых 2 мес лечения аменорея наблюдалась у 13 женщин (44,8%) 1-й группы, а у остальных 17 пациенток (55,2%) сохранялись кровяные выделения в виде метроррагий в течение первых 7—10 дней после введения препарата. Подобные выделения носили скудный характер и самостоятельно исчезали без гемостатической терапии. Согласно данным литературы, ЛА уже к 4-й неделе после его введения блокирует гипофизарно-яичниковую систему, а его непрерывное введение предупреждает появление новых рецепторов в количестве, достаточном для синтеза и секреции ЛГ. По окончании 3 мес лечения аменорея наблюдалась у 23 женщин (77%).
Толщина эндометрия по результатам УЗИ малого таза на фоне проводимого лечения достоверно уменьшалась по сравнению с состоянием до лечения: к концу 3-го месяца показатель М-эха полости матки составлял 5,3 ± 1,1 мм, а через 6 мес —
Лечение гиперплазии эндометрия
3,2 ± 0,9 мм (р < 0,01). При цитологическом исследовании образцов аспирацион-ной биопсии через 6 мес лечения гиперплазия эндометрия не выявлена ни у одной из пациенток 1-й группы. Признаки пролиферации эндометрия отмечены у
4 больных (13,3%), переходный эндометрий — у 10 (33,3%), атрофичный эндометрий — у 16 (53,3%).
На фоне применения ЛА уменьшились и общие размеры матки за счет уменьшения размеров миоматозных узлов, а также их количества. Так, размеры миоматозных узлов достоверно уменьшились через 6 мес лечения на 40% (от 3,9 ± 0,5 до 2,4 ± 0,4 см), а количество визуализирующихся миоматозных узлов — почти наполовину (от 3,2 ± ± 0,5 до 1,5 ± 0,6). Последнее обусловлено уменьшением диаметра узлов, в связи с чем некоторые узлы становятся практически невидимыми при УЗИ.
Гипоэстрогенные эффекты у пациенток имели прогрессирующий характер и отмечались уже после второй инъекции препарата в 19 наблюдениях (62%), что отражено на рисунке. Наиболее характерные жалобы: приливы жара, повышенное потоотделение, сухость во влагалище; также отмечались снижение либидо, депрессивные состояния и бессонница. Однако данные проявления гипоэстрогении не были критическими и не лишали пациенток трудоспособности. Для уменьшения интенсивности данных проявлений назначались витаминотерапия, седативная терапия, гомеопатические препараты (климактоплан, климадинон).
Ни в одном случае не выявлено местных реакций на введение препарата. Других нежелательных эффектов — прибавки массы тела, повышения артериального давления, признаков андрогенизации или задержки жидкости — отмечено также не было.
Применение ЛА у больных гиперплазией эндометрия в сочетании с миомой матки обеспечило также коррекцию хронической анемии благодаря возникшей аменорее, повысило показатель резистентности маточных артерий и уменьшило интенсив-
После 1-го месяца лечения ■ После 6-го месяца лечения
Гипоэстрогенные эффекты ЛА (р < 0,05).
ность артериального кровотока в матке. Так, уровень гемоглобина до начала лечения составлял 86—113 г/л (в среднем
100,3 ± 9,8 г/л), а после проведенного лечения средний уровень гемоглобина повысился до 124,5 ± 3,8 г/л (р < 0,05).
Шестимесячный курс использования ЛА не привел к развитию стойкой аменореи у пациенток моложе 48 лет, а побочные эффекты (в частности, приливы жара) не снижали трудоспособность и имели обратимый характер в течение 1 мес после отмены препарата. Из 12 пациенток, которые были старше 48 лет, у 10 наступила стойкая менопауза, а у 2 скудные метрорра-гии после отмены ЛА продолжались еще в течение 6—8 мес, а затем прекратились без дополнительного лечения. У пациенток моложе 48 лет после окончания лечения препаратом ЛА самостоятельные менструации появлялись через 2—3 мес, однако величина кровопотери при этом была невелика, и рецидива гиперпластических процессов эндометрия в течение года после окончания лечения не наблюдалось. Роста миоматозных узлов в течение последующего года наблюдения отмечено не было.
Вторая группа (лечение ДГ). У пациенток, получавших ДГ с 5-го по 25-й день менст-
Рекомендации по ведению больных
руального цикла, величина кровопотери постепенно сокращалась в течение первых 3 мес лечения и при УЗИ отмечалось уменьшение показателя М-эха от 12,1 ± 1,8 до 8,1 ± 0,6 мм. К концу 6-го месяца лечения средняя толщина эндометрия у пациенток по данным УЗИ составляла 5,8 ± 1,6 мм, что было достоверно ниже, чем до начала лечения, но выше, чем у пациенток 1-й группы (р < 0,05). Материал, полученный из полости матки путем аспирационной биопсии через 6 мес от начала лечения, был оценен цитологами следующим образом: у
15 пациенток (50%) — пролиферативный эндометрий, у 10 (33,3%) — переходный и у
5 (16,7%) — атрофичный эндометрий. Эндометрий в состоянии гиперплазии не был выявлен ни у одной из обследованных пациенток, что свидетельствует об эффективности проводимого лечения, однако характер изменений в эндометрии у половины пациенток оставался в виде пролиферативных, что настораживало в связи с возможным рецидивом.
Размеры миомы матки на фоне проводимого лечения ДГ практически не менялись, также отсутствовала динамика количества миоматозных узлов. Вместе с тем не было и случаев увеличения размеров узлов, которое нередко отмечается у пациенток в пре-менопаузальном периоде, не получавших гормонального лечения.
В качестве побочного действия ДГ можно отметить некоторое увеличение массы тела — от 1,5 до 4,8 кг (в среднем на 3,1 ± ±1,7 кг), что, по-видимому, связано с задержкой жидкости и носит временный характер. После отмены ДГ масса тела у большинства пациенток вернулась к первоначальной в течение первых 3 мес, повышенная масса тела оставалась лишь у 7 женщин (23,3%).
Всем пациенткам группы, имевшим анемию на фоне менометроррагий, в начале лечения параллельно с ДГ приходилось назначать препараты железа в связи с продолжавшимися в первые месяцы обильными кровяными выделениями. Уровень гемоглобина в группе составлял 92—108 г/л (в
среднем 100,1 ± 2,8 г/л). Продолжительность назначения препаратов железа не превышала 4 нед, и средний уровень гемоглобина через 3 мес от начала лечения составлял 122,8 ± 2,1 г/л.
При дальнейшем наблюдении пациенток, получавших ДГ для лечения гиперплазии эндометрия, получены следующие результаты: в течение ближайшего года у 5 из 30 больных (16,7%) вновь возникла гиперплазия эндометрия, что подтверждали данные УЗИ и аспирационной биопсии, проведенных через 12 мес после окончания лечения. Стойкая менопауза отмечалась лишь у 3 из 10 пациенток, возраст которых превышал 50 лет, у остальных больных имели место метроррагии различной степени интенсивности (от скудных до умеренных), что также свидетельствовало о возможности рецидива заболевания. По-видимому, некоторым больным необходим более длительный (9—12 мес) курс лечения ДГ под контролем УЗИ и цитологического исследования.
Выводы
У пациенток в пременопаузальном периоде, имеющих гиперплазию эндометрия в сочетании с миомой матки малых размеров, при выборе гормонального лечения предпочтение следует отдавать агонистам ГнРГ. Назначение ЛА в дозе 3,75 мг ежемесячно в течение 6 мес обеспечивает лечение гиперплазии эндометрия у данного контингента больных и значительное уменьшение размеров миомы матки (на 40—50%).
Назначение гестагенов пациенткам в пременопаузальном периоде, страдающим гиперплазией эндометрия и миомой матки, сопровождается меньшим количеством побочных эффектов, однако не гарантирует исключения рецидивов гиперплазии эндометрия в течение первого года после окончания лечения, а также не обеспечивает уменьшение размеров миомы матки.
При назначении ЛА не было выявлено местных аллергических реакций на введение препарата, а также таких нежелательных эффектов, как прибавка массы тела,
Лечение гиперплазии эндометрия
повышение артериального давления, признаки андрогенизации или задержки жидкости, что свидетельствует о преимуществе агонистов ГнРГ перед гестагенами при лечении пациенток, имеющих сочетанные пролиферативные заболевания.
Рекомендуемая литература
Вихляева Е.М., Василевская Л.Н. Миома матки. М.: Медицина, 1981. 159 с.
Вихляева Л.М., Паллади Г.А. Патогенез, клиника и лечение миомы матки. Кишинев: Штиин-ца, 1982. 300 с.
Краснопольский В.И., Буянова С.Н., Щукина Н.А. и др. Хирургическая коррекция репродук-
тивной функции при миоме матки : пособие для врачей. М., 2004. 12 с.
Мазитов И.М. Сравнительная характеристика уровней эстрогенных гормонов при миомах матки // Нейроэндокринные нарушения в акушерстве и гинекологии : тез. докл. Казань, 1981. С. 58-59.
Савицкий Г.А. Миома матки: патогенетические и терапевтические аспекты. СПб.: Путь, 1994. 178 с.
Schwartz S.M. Epidemiology of uterine leiomyoma // Clin. Obstet. Gynekol. 2001. V. 44. № 2. P. 316-326.
Эндометриоз – одно из самых многоликих и загадочных гинекологических заболеваний. По различным оценкам, эндометриоз поражает 3-15% женщин детородного возраста, при этом пик заболеваемости приходится на период 20-35 лет. Чтобы оценить медицинскую и социальную значимость заболевания достаточно сказать, что эндометриоз является второй по частоте причиной женского бесплодия. Здесь он уступает лишь воспалительным заболеваниям.
Содержание
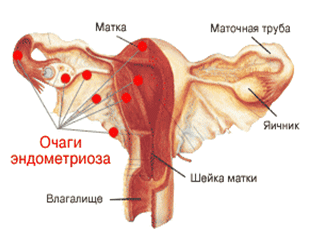
Гиперплазия эндометрия, аденомиоз и эндометриоз
Название «эндометриоз” происходит от термина «эндометрий”. Так называют слизистую оболочку матки, подвергающуюся циклическим изменениям во время менструального цикла и слущивающуюся во время менструации. При эндометриозе эндометрий выходит за пределы матки и распространяется на несвойственные ему участки.
Чаще всего это – влагалище, маточные трубы, яичники, брюшина. Иногда избыточное развитие (гиперплазия) эндометрия приводит к прорастанию его в глубокие слои стенки матки. Такой эндометриоз называется внутренним (врачи иногда называют его аденомиозом) и также является патологией.
Предполагают, что в основе развития заболевания лежит комплекс иммунных и гормональных нарушений, однако точные причины его до сих пор не установлены. К наиболее вероятным факторам риска гиперплазии эндометрия, аденомиоза и эндометриоза относятся неблагоприятная наследственность, ожирение, осложненные роды, аборты, использование внутриматочных спиралей и позднее наступление менопаузы.
Симптомы эндометриоза и возможности обследования
Наиболее частыми симптомами эндометриоза являются боли в нижних отделах живота и различные нарушения менструального цикла (обильные, болезненные менструации, нерегулярный цикл и др.).
В ряде случаев заподозрить заболевание позволяют влагалищные кровотечения, которые могут наблюдаться как во время, так и вне менструаций.
Диагностировать эндометриоз и аденомиоз, установить локализацию гиперплазии эндометрия и степень процесса можно при комплексном обследовании в учреждении, оказывающем квалифицированную гинекологическую помощь.
Использование таких инструментальных методов, как гистеро- и кольпоскопия, УЗИ органов малого таза, компьютерная (КТ) и магнитно-резонансная томография (МРТ) позволяет повысить информативность обследования. 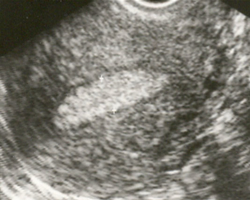 К наиболее доступным методам неинвазивного (не связанного с проникновением в организм пациента) исследования относится УЗИ.
К наиболее доступным методам неинвазивного (не связанного с проникновением в организм пациента) исследования относится УЗИ.
См. изображение, полученное с помощью трансвагинального датчика УЗИ. Эллипсоидный очаг гиперплазии более светлый.
КТ и МРТ отличаются несколько большей информативностью, но являются более дорогостоящими методами.
При гистероскопии врач с помощью специального прибора, вводимого в полость матки, может непосредственно изучить состояние эндометрия и увидеть гиперплазию.
Профессионализм врачей-гинекологов нашей клиники позволяет им не направлять своих пациенток к другим специалистам, а лично выполнять гинекологическое УЗИ и ставить диагноз сразу в большинстве случаев эндометриоза.
Лечение эндометриоза: старые подходы
Сегодня в распоряжении врачей имеется большой арсенал средств лечения эндометриоза. Долгое время популярными оставались лечение эндометриоза псевдобеременностью и псевдоменопаузой.
При этом врачи пытались с помощью назначения различных гормонов смоделировать гормональный фон, наблюдающийся в организме женщины при беременности или в период менопаузы. В настоящее время оба эти метода признаны устаревшими и малоэффективными.
Распространенное ранее убеждение, что настоящая беременность может полностью излечить женщину от эндометриоза, также не оправдалось. Показано, что хотя в большинстве случаев при беременности распространенность заболевания несколько снижается, часть очагов, сохраняющаяся и после беременности, дает начало для нового роста заболевания. Более того, эндометриоз ставит под сомнение возможность зачатия.
Новые методы лечения эндометриоза
Существующие современные методы лечения эндометриоза включают как лекарственные (врачи также называют их консервативными), так и хирургические.
При консервативном лечении чаще всего применяют препараты, усиливающие или ослабляющие действие половых гормонов, вырабатываемых в организме. К числу наиболее эффективных разработок относят, например, такие препараты как декапептил, бусерелин, золадекс. Также используют даназол, гестринон, норэтистерон, левоноргестрел и препараты из группы оральных контрацептивов. Все эти препараты назначает только врач, самолечение эндометриоза недопустимо и опасно.
В качестве вспомогательных средств применяют различные витамины, иммуностимуляторы, физиотерапию. Хирургическое лечение эндометриоза проводят в случае, если медикаментозная терапия недостаточно эффективна или к ней имеются противопоказания. При этом в зависимости от возраста женщины и ее желании сохранить детородную функцию удаляют либо отдельные очаги гиперплазии эндометрия, либо весь орган, пораженный заболеванием (матку, маточные трубы, яичники). Чтобы избежать хирургического вмешательства, необходимо по возможности раньше обращаться к врачу или регулярно проходить профилактические осмотры.
Своевременное выявление и качественное лечение эндометриоза позволяет избежать развития самого грозного из его осложнений – бесплодия и повысить качество жизни пациентов.
В заключение отметим, что по современным представлениям эндометриоз является общим заболеванием, поражающим весь организм в целом. Наблюдающиеся при эндометриозе иммунные, гормональные и обменные нарушения и его частое сочетание с различными «негинекологическими” заболеваниями вынуждают наряду с гинекологом привлекать к лечению гиперплазии эндометрия и других специалистов (эндокринолога, невролога, терапевта).
Все эти возможности есть у Вас в нашей клинике.
![]()