Миокард левого желудочка
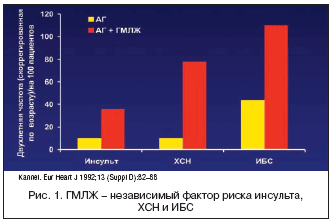
В настоящее время ГМЛЖ рассматривают как независимый предиктор ранней сердечно–сосудистой заболеваемости и смертности. У пациентов с АГ и имеющих ГМЛЖ риск развития сердечно–сосудистых событий достоверно выше по сравнению с больными АГ без ГМЛЖ (рис. 1). Так, в течение двухлетнего наблюдения установлено, что инсульт и ИБС при ГМЛЖ встречаются почти в 3 раза, а сердечная недостаточность – в 4 раза чаще, чем у пациентов с АГ, но без ГМЛЖ. По данным Casale и соавт. (1986), наличие ГМЛЖ обусловило развитие осложнений (смерть, инфаркт миокарда, инсульт) в 4,6% случаев (по сравнению с 1,2% в группе без ГМЛЖ); по данным Koren и соавт. (1991), сердечная смерть развивалась в 1,4% случаев с ГМЛЖ (для сравнения – 0,1% без ГМЛЖ), а сердечно–сосудистые осложнения – в 6,3% случаев с ГМЛЖ (для сравнения – . 2,2% без ГМЛЖ); по данным Silberberg и соавт. (1989), риск смерти при ГМЛЖ составил 15,2% (по сравнению с 9,6% без ГМЛЖ); в исследовании Parfrey и соавт. (1990) смерть при ГМЛЖ была зарегистрирована у 15,3% пациентов и у 4,8% без ГМЛЖ. При сравнении прогностического значения разных факторов риска было обнаружено, что наличие ГМЛЖ обусловливает значительно более высокий относительный риск кардиоваскулярных осложнений, чем наличие гиперхолестеринемии, сахарного диабета, а также курения. Это связано с тем, что ГМЛЖ миокарда усугубляет его ишемию, способствует нарушениям сократимости, наполнения левого желудочка, развитию желудочковых аритмий. Наличие ГМЛЖ ассоциируется с нарушением коронарной гемодинамики, систолической и диастолической дисфункцией сердца, с повышением риска развития сердечной недостаточности и жизнеугрожающих аритмий, ускорением прогрессирования коронарного атеросклероза, снижением коронарного резерва, возникновением стенокардии независимо от наличия атеросклеротических изменений коронарных артерий.
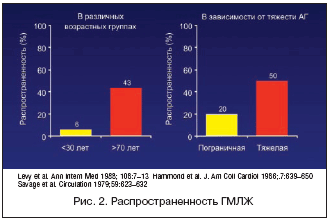
Развитие ГМЛЖ связано с различными генетическими, демографическими, клиническими и биохимическими факторами. Демографические факторы и образ жизни, ассоциированные с развитием ГМЛЖ, включают возраст, пол, физическую активность, расу, ожирение, чувствительность к соли, количество потребляемого алкоголя. Известно, что в возрасте до 55 лет ГМЛЖ несколько чаще наблюдается у мужчин, чем у женщин, однако в дальнейшем ее частота у лиц разного пола примерно одинакова. Число больных с ГМЛЖ увеличивается с возрастом (рис. 2). Важное значение для развития ГМЛЖ имеет тяжесть клинического течения АГ, среди пациентов с АГ 3 степени (АД 180/110 мм рт.ст. и выше) ГМЛЖ встречается в 2 раза чаще, чем при АГ 1 степени (АД 140–159/90–99 мм рт.ст.) (рис. 2). Кроме степени повышения АД, важную роль в развитии ГМЛЖ играет избыточный утренний подъем АД. Значительное повышение АД в утренние часы ассоциировано с развитием ГМЛЖ как у леченных, так и у нелеченных больных АГ. Развитию ГМЛЖ также способствуют гемодинамические факторы: нагрузка давлением и объемом, изменение структуры артерий, нарушения реологических свойств крови.
Для диагностики ГМЛЖ могут использоваться различные методы: рентгенография, электрокардиография (ЭКГ), эхокардиография (ЭхоКГ), радиоизотопная вентрикулография, компьютерная томография, магнитно–резонансная томография. Наибольшее клиническое значение в настоящее время имеют ЭКГ и ЭхоКГ; рентгенография сегодня уже не играет принципиальной роли, а более сложные визуализирующие исследования требуют дорогостоящей аппаратуры и далеко не везде могут быть доступны (кроме того, их преимущество перед ЭхоКГ невелико). Согласно 4–й редакции российских рекомендаций по диагностике и лечению АГ (2010 г.) к ЭКГ–признакам ГМЛЖ относят:
1. Признак Соколова–Лайона более 38 мм
2. Корнельское произведение более 2440 мм х мс.
При ЭхоКГ рассчитывают индекс массы миокарда левого желудочка (ИММЛЖ). Если его значение > 125 г/м2 у мужчин и > 110 г/м2 у женщин, диагностируют ГМЛЖ.
В плане обследования сердца, как органа–мишени АГ, в российских рекомендациях сказано, что для оценки состояния сердца выполняются ЭКГ и ЭхоКГ. ЭКГ по критериям индекса Соколова–Лайона (SV1+RV5–6 > 38 мм) и Корнельского произведения ((RAVL+SV5) мм х QRS мс >2440 мм х мс) позволяет выявить ГМЛЖ. Более чувствительным и специфичным методом оценки поражения сердца при АГ является расчет ИММЛЖ с помощью ЭхоКГ*. Верхнее значение нормы для этого показателя составляет 124 г/м2 для мужчин и 109 г/м2 для женщин. По соотношению толщины задней стенки левого желудочка (ТЗСЛЖ) и его радиуса (РЛЖ), а также с учетом величины ИММЛЖ можно определить тип ремоделирования левого желудочка. При ТЗСЛЖ/РЛЖ >0,42 и увеличении ИММЛЖ имеет место концентрическая ГМЛЖ, при ТЗСЛЖ/РЛЖ <0,42 и увеличении ИММЛЖ – эксцентрическая ГМЛЖ, в случае же ТЗСЛЖ/РЛЖ >0,42 и при нормальном ИММЛЖ – концентрическое ремоделирование. Прогностически наименее благоприятной является концентрическая ГМЛЖ. ЭхоКГ позволяет также оценить диастолическую и систолическую функции левого желудочка.
ГМЛЖ представляет собой физиологическую реакцию сердца на увеличение постнагрузки на левый желудочек, связанное с повышением общего периферического сосудистого сопротивления. Однако по мере ее прогрессирования возникает несоответствие между возрастающей потребностью гипертрофированного миокарда в кислороде и ограниченными возможностями доставки его с кровью по коронарным артериям. Патофизиологически ГМЛЖ – это реактивное увеличение массы миокарда левого желудочка в ответ на повышенную рабочую нагрузку, сопровождающееся гипертрофией миоцитов, а также повышением содержания коллагена и фиброзом. В основе развития ГМЛЖ лежат в первую очередь патологические эффекты ангиотензина II, которые обусловлены стимуляцией АТ1–рецепторов. Уровни концентрации ангиотензина II коррелируют с выраженностью ГМЛЖ, поскольку чем выше его концентрация, тем более активно проходят такие процессы, как вазоконстрикция, оксидативный стресс, усиленное высвобождение факторов роста, что стимулирует пролиферацию кардиомиоцитов, а в последующем – фиброз, ремоделирование миокарда, апоптоз его клеток. В то же время в связи с вазоконстрикцией и другими эффектами ангиотензина II подобные процессы происходят и в гладкомышечном слое артерий, вследствие чего возрастает общее периферическое сопротивление, еще больше увеличивается нагрузка на левый желудочек и ускоряется его гипертрофия. Таким образом происходит единый процесс сердечно–сосудистого ремоделирования, отражающий трансформацию функциональных изменений в структурные. В миокарде имеют место увеличение размеров миоцитов, изменение их изоэнзиматического профиля, повышение содержания субэндокардиального коллагена, что приводит к изменению растяжимости, сократимости, проводимости миокарда, гипертрофии левого желудочка, его ишемии и развитию сердечной недостаточности в конечном итоге. Согласно определению Ю.Н. Беленкова (2002) ремоделирование левого желудочка представляет собой его структурно–геометрические изменения, в том числе процессы гипертрофии левого желудочка и дилатации, которые приводят к изменениям геометрии, сферичности и нарушениям систолической и диастолической функции.
Следует отметить, что генетические и гуморальные факторы отвечают за степень гипертрофии миокарда, механический фактор – за ее направление (концентрическая, эксцентрическая), а на тип ремоделирования влияют как механический, так и экстракардиальные факторы. Это имеет значение в связи с тем, что не только выраженность ГМЛЖ, но и сама геометрия левого желудочка определяет риск сердечно–сосудистых осложнений. Если происходит концентрическое ремоделирование левого желудочка без гипертрофии стенок миокарда, вероятность сердечно–сосудистых осложнений в течение 10 лет составляет 15%; при эксцентрической ГМЛЖ она достигает 25%; при концентрической ГМЛЖ – 30%.
Наиболее существенную роль в развитии гипертрофии и ремоделирования левого желудочка играет собственная кардиальная ренин–ангиотензиновая система (РААС). Известно, что РААС в организме представлена как в плазме крови, так и в тканях. При этом плазменная часть РААС составляет всего 10% и вызывает немедленные эффекты (сердечные, почечные), в то время как большая часть (90%) РААС распределена в различных тканях и ответственна за длительные эффекты, в том числе за формирование необратимых изменений в органах и тканях. Ангиотензинпревращающий фермент (АПФ) в тканях сердца первично представлен в эндотелиальных клетках и фибробластах. АПФ больше в предсердиях, чем в желудочках, он присутствует во всех клапанах, сосудах сердца, аорте, легочных артериях, эндокарде и эпикарде. Собственно сократительная система сердца содержит мало АПФ: здесь превращение ангиотензина I в ангиотензин II происходит преимущественно альтернативным путем – с помощью фермента химазы. В связи с исключительной ролью РААС в развитии ГМЛЖ из всех ее этиопатогенетических факторов (возраст, пол, генетические особенности, раса, потребление соли, нейрогуморальные нарушения, ожирение, АГ и др.) наибольшее значение имеет АГ. Именно АГ является основной причиной развития гипертрофии миокарда. Следовательно, раннее и эффективное лечение АГ предотвращает развитие гипертрофии и ремоделирования левого желудочка, то есть улучшается прогноз для пациента в целом. Кроме того, при уже сформировавшейся ГМЛЖ на фоне эффективной антигипертензивной терапии может уменьшаться выраженность патологических изменений миокарда, что также улучшает прогноз .
Необходимо подробнее остановиться на роли различных антигипертензивных средств в регрессе ГМЛЖ. Оказалось, что основные классы антигипертензивных препаратов в разной степени влияют на ее течение (рис. 3). Показано, что наиболее сильно на регресс ГМЛЖ влияют блокаторы рецепторов ангиотензина II (БРА), ингибиторы АПФ (иАПФ) и блокаторы кальциевых каналов, а β–блокаторы и диуретики – в значительно меньшей степени. Правда, необходимо отметить, что у диуретиков и β–блокаторов нет класс–эффекта в отношении регресса ГМЛЖ. Среди диуретиков лишь индапамид ретард доказал свою способность вызывать регресс ГМЛЖ, а среди β–блокаторов таким эффектом обладают только липофильные представители, например, бисопролол, метопролола сукцинат.
Согласно российским рекомендациям по диагностике и лечению АГ (4 пересмотр, 2010 г.) при наличии ГМЛЖ у больных АГ предпочтение следует отдавать БРА, иАПФ и длительнодействующим дигидропиридиновым антагонистам кальция. Кроме того, в рекомендациях сказано, что для замедления темпов прогрессирования поражений органов–мишеней и возможности регресса их патологических изменений хорошо зарекомендовали себя иАПФ и БРА. Они доказали свою эффективность в плане уменьшения выраженности ГМЛЖ, включая ее фиброзный компонент.
В связи с этим хотелось бы акцентировать внимание на роли БРА в лечении ГМЛЖ. Ряд клинических исследований, в том числе такие крупные, как LIFE, убедительно доказали, что БРА индуцируют регресс гипертрофии миокарда. Этот эффект достигается не только благодаря собственно антигипертензивному действию БРА, но и за счет нейтрализации органоповреждающего действия ангиотензина II, то есть в связи с наличием дополнительных (АД–независимых) органопротективных влияний. Препараты этой группы селективно «выключают» все неблагоприятные эффекты ангиотензина II, реализуемые через АТ1–рецепторы. Этим БРА принципиально отличаются от другого класса ингибиторов РААС – иАПФ.
Исследование LIFE (Losartan Intervention For Endpoint reduction in hypertension) является краеугольным в формировании практических рекомендаций для лечения больных АГ и ГМЛЖ. Идея проведения исследования LIFE базировалась на гипотезе, согласно которой длительная блокада рецепторов ангиотензина II, с точки зрения предупреждения сердечно–сосудистой заболеваемости и смертности при АГ, сочетающейся с ГМЛЖ, будет эффективнее β–адреноблокады. Атенолол в качестве препарата сравнения был выбран в связи с тем, что на тот момент он являлся одним из наиболее широко применяемых β–адреноблокаторов. Он оказывает сходный с лозартаном антигипертензивный эффект и обладает подтвержденной в некоторых плацебо–контролируемых исследованиях способностью снижать риск сердечно–сосудистых осложнений. В случаях, когда необходимый контроль АД не достигался, к обоим препаратам добавлялся гидрохлоротиазид.
В исследовании LIFE (двойное слепое рандомизированное исследование в условиях амбулаторной практики) участвовали 9193 пациента (45,9% мужчин, 54,1% женщин) в возрасте от 55 до 88 лет (в среднем 66,9 лет) с ранее леченной или нелеченной АГ и признаками ГМЛЖ, выявленными на стандартной ЭКГ. Больные были рандомизированы в группу лозартана или в группу атенолола, если после 1–2–недельного назначения плацебо в положении сидя отмечалось систолическое АД (САД) 160–200 мм рт.ст. и/или диастолическое АД (ДАД) 95–115 мм рт.ст. (в среднем 174,4/97,8 мм рт.ст.). В исследование не включались пациенты с вторичной (симптоматической) АГ; инфарктом миокарда или инсультом в течение последних 6 месяцев; стенокардией, требующей назначения β–адреноблокаторов или антагонистов кальция; сердечной недостаточностью; другими состояниями, при которых, по мнению лечащего врача, необходимо назначение лозартана или иных антагонистов ангиотензиновых рецепторов, атенолола или иных β–адреноблокаторов, гидрохлоротиазида или ингибиторов АПФ.
Начальная доза лозартана составила 50 мг один раз в сутки, а атенолола – 50 мг один раз в сутки (рис. 4). Если в течение 2 месяцев не удавалось достигнуть целевого АД (140/90 мм рт. ст.), к лечению добавляли гидрохлоротиазид (12,5 мг/сут). Если и после этого целевое АД не было достигнуто, дозу лозартана и атенолола увеличивали до 100 мг. В случаях, когда максимальные дозы исследуемых препаратов в комбинации с диуретиком не обеспечивали адекватного контроля АД, разрешалось применение других антигипертензивных средств, за исключением антагонистов ангиотензина II, ингибиторов АПФ и β–адреноблокаторов).
Наблюдение за больными продолжалось не менее 4 лет (в среднем 4,8 года) и до момента развития осложнений, составляющих комбинированную первичную (главную) конечную точку (смертность от сердечно–сосудистых причин, нефатальные инфаркт миокарда или инсульт). Другими регистрируемыми конечными точками (исходами) являлись смертность от любых причин, стенокардия или сердечная недостаточность, требующие госпитализации, коронарные или периферические реваскуляризационные процедуры, регрессия ЭКГ–документированной ГМЛЖ (по двум методикам), новые случаи сахарного диабета.
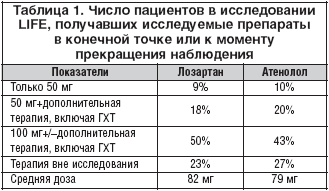
Результаты исследования LIFE подтвердили высокую антигипертензивную эффективность лозартана и атенолола. К концу наблюдения САД в положении сидя снизилось в группе лозартана в среднем на 30,2 мм рт.ст., а в группе атенолола – на 29,1 мм рт.ст. ДАД в группах лозартана и атенолола снизилось в среднем на 16,6 и 16,8 мм рт.ст. соответственно. Таким образом, лозартан и атенолол обладали практически одинаковым антигипертензивным действием (рис. 5). Средние дозы этих препаратов к моменту завершения исследования составляли 82 и 79 мг в сут. соответственно. Использование дополнительных разрешенных антигипертензивных средств в группах было сходным. Однако поскольку вопрос о дозах является едва ли ни самым главным для клинической практики, необходимо остановиться на этом подробнее (табл. 1).
Как видно из таблицы, лишь около 10% больных в каждой группе получали монотерапию исследуемыми препаратами в стартовой дозе, в том числе лозартаном в дозе 10 мг. Каждый пятый пациент (20%) получал комбинацию, в том числе лозартан 10 мг плюс гидрохлоротиазид (ГХТ) 12,5 мг. Большинство же больных получали 100 мг исследуемого препарата, в том числе с ГХТ.
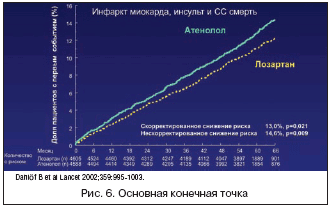
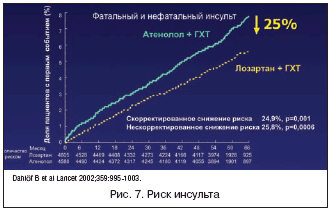
Результаты исследования LIFE оказались удивительными. Лозартан достоверно превосходил атенолол с точки зрения воздействия на комбинированный риск сердечно–сосудистых осложнений (на 13%) (рис. 6) и, главное, на риск фатального и нефатального инсульта (на 25%) (рис. 7). И это при одинаковом снижении АД! Не удивляет только факт, что лозартан достоверно превосходил атенолол по вероятности развития новых случаев сахарного диабета (на 25%), учитывая негативное влияние атенолола на углеводный обмен. В сравнении с атенололом лозартан снижал и общую смертность (на 10%), но этот эффект не являлся статистически значимым. Как следует из рисунков 6 и 7, различие в эффективности атенолола и лозартана (в пользу последнего) прогрессивно возрастает по мере увеличения продолжительности применения. Это справедливо как в отношении воздействия на комбинированный риск сердечно–сосудистых осложнений, так и на риск инсульта.
Почему же лозартан оказался эффективнее атенолола в плане профилактики инсульта и сердечно–сосудистых осложнений при равном гипотензивном эффекте? Здесь следует вспомнить, что в исследовании LIFE все пациенты имели ГМЛЖ, а как было сказано выше, она является самостоятельным независимым фактором риска развития осложнений. Лозартан, как и следовало ожидать, значительно более выраженно, чем атенолол, способствовал обратному развитию ГМЛЖ (Р<0,0001), но, как показал специально проведенный анализ, этот эффект частично коррелировал с воздействием на риск основных сердечно–сосудистых исходов, то есть должны существовать и другие механизмы.
Эти другие механизмы протекторного (защитного) действия лозартана на сердечно–сосудистую систему требуют тщательного изучения. Учитывая схожесть антигипертензивного действия атенолола и лозартана, эффекты последнего не могут быть объяснены исключительно снижением АД. В определенной степени преимущество лозартана перед атенололом может быть связано с более выраженным позитивным влиянием на ГМЛЖ, но и этот эффект, как свидетельствуют данные исследования LIFE, не вполне объясняет полученные результаты. Можно предполагать, что существенный вклад в протекторное действие лозартана вносит обеспечиваемая им селективная блокада неблагоприятных эффектов ангиотензина II. Кроме того, в экспериментальных и клинических работах выявлено, что лозартан, аналогично ингибиторам АПФ, способен оказывать антиатерогенное действие.
Существует и еще одно уникальное свойство лозартана, которое также объясняет его эффективность в исследовании LIFE. В нескольких больших эпидемиологических исследованиях была выявлена взаимосвязь повышенного уровня мочевой кислоты сыворотки крови и риска развития сердечно–сосудистых осложнений как в общей популяции, так и у больных АГ. Считают, что гиперурикемия связана с эндотелиальной дисфункцией, замедлением окислительного метаболизма, адгезией тромбоцитов, нарушением реологии крови и агрегации. Признаком, который отличает лозартан от других БРА, является способность молекулы лозартана (но не его активных метаболитов) снижать уровень мочевой кислоты путем влияния на реабсорбцию уратов в почечных проксимальных канальцах. В норме и у больных АГ введение лозартана вызывает устойчивое снижение уровней мочевой кислоты. Ингибиторы АПФ и антагонисты кальция оказывают слабый урикозурический эффект, но не снижают концентрацию мочевой кислоты, диуретики увеличивают ее уровень, в то время как β–блокаторы не влияют на концентрацию мочевой кислоты.
Специально проведенный анализ взаимосвязи уровня мочевой кислоты при терапии лозартаном и первичной комбинированной конечной точки (кардиоваскулярная смертность, фатальный и нефатальный инфаркт миокарда, фатальный и нефатальный инсульт) в исследовании LIFE показал, что замедление нарастания уровня мочевой кислоты под действием лозартана (в сравнении с атенололом) вносит значительный вклад (29%) в снижение частоты возникновения событий первичной конечной точки. Данная взаимосвязь была особенно выражена у женщин. Следовательно, 13%–е снижение риска сердечно–сосудистых осложнений при приеме лозартана в сравнении с атенололом почти на треть было обусловлено гипоурикемическим эффектом лозартана. Следовательно, данный эффект лозартана может быть одной из причин снижения риска сердечно–сосудистых осложнений в большей степени, чем просто эффект снижения АД (как у других антигипертензивных препаратов).
Таким образом, результаты исследования LIFE имеют важные последствия для практического здравоохранения. Представитель класса БРА лозартан продемонстрировал уникальные свойства и исключительно благоприятное соотношение эффективность/безопасность.
Однако в реальной практике важна доступность современной терапии АГ для широкого круга пациентов. В этой связи появление так называемых дженериковых препаратов, соответствующих международным стандартам качества, позволяет снизить затраты на лечение и сделать современную терапию доступной большему числу пациентов.
С позиций клинициста немаловажным условием позитивного отношения к дженерику является качество его производства и репутация производителя. Однако, основным отличием «хорошего дженерика» является наличие собственных клинических исследований. В этой связи большие перспективы имеет препарат Лориста компании КРКА, недавно появившийся на российском рынке, а также его фиксированные комбинации с ГХТ. Лориста имеет уникальный набор дозировок – 12,5 мг, 25 мг, 50 мг и 100 мг. Для лечения АГ применяют дозы 50 и 100 мг, для максимально эффективной церебропротекции необходима доза 100 мг (см. результаты исследования LIFE и табл.1). Дозы 12,5 и 25 мг применяют для лечения больных с хронической сердечной недостаточностью. Еще более важное значение имеет появление на российском рынке фиксированных комбинаций: Лориста Н (лозартан 50 мг/ГХТ 12,5 мг) и Лориста НД (лозартан 100 мг/ГХТ 25 мг). Лориста H является препратом первой линии для всех больных АГ 1–2 степени, имеющих высокий и очень высокий риск развития сердечно–сосудистых осложнений. В случае если необходимо усиление антигипертензивного эффекта, пациенту может быть назначен препарат Лориста HД. Лориста HД может быть назначена и сразу, в качестве стартовой терапии, больному с АГ 3 степени (АД 180 мм рт.ст. и выше/110 мм рт.ст. и выше).
Таким образом, появление этих препаратов позволит сделать лечение лозартаном более доступным широкому кругу пациентов, а наличие большого разнообразия доз будет способствовать максимальной индивидуализации терапии.



Литература
1. Диагностика и лечение артериальной гипертензии. Журнал «Системные гипертензии» 2010; 3: 5–26
2. Руководство по артериальной гипертонии. Под ред. Е.И. Чазова, И.Е. Чазовой. М.: Медиа Медика, 2005. – С.201–217, 596–616.
Гипертрофия сердца
Гипертрофия сердца – это увеличение сердечной мышцы, которое происходит в основном из-за увеличения количества кардиомиоцитов – специализированных мышечных клеток сердца. Такое состояние встречается у детей, подростков, молодых и пожилых людей.
Гипертрофия сердца – это проявление особого состояния организма: физиологического или патологического. То есть это не заболевание, а симптом.
Физиологическая
Физиологическая гипертрофия сердца наблюдается у спортсменов и у людей, которые ведут активный образ жизни. Для регулярных физических нагрузок организму требуется большое количество кислорода. Кислород доставляется с кровью. И чтобы обеспечить возросшие ив кислороде потребности, сердце увеличивает частоту и силу сокращений. А для этого что требуется больший метаболизм в самой сердечной мышце. Так постепенно увеличивается объем и масса клеток (кардиомиоцитов). Чаще у спортсменов гипертрофия сердца начинается с левого желудочка.Виды спорта, которые могут привести к гипертрофии сердца, – гребля, хоккей, футбол, лыжные гонки, велоспорт, бег на длинные дистанции и т.д. При прекращении тренировок такое состояние претерпевает обратное развитие. То есть гипертрофированное сердце становится снова обычных размеров с нормальной толщиной стенок.
Патологическая
Патологическая гипертрофия сердца возникает из-за различных заболеваний организма. Сердце человека состоит из четырех отделов: два предсердия и два желудочка. Предсердия – это резервуары, куда кровь поступает из кругов кровообращения организма (синие сосуды). Желудочки – выталкивающая сила, которая запускает кровь по сосудам (красные сосуды). Так каждый отдел имеет свои причины к увеличению.
Причины:
- Левый желудочек – увеличивается из-за артериальной гипертензии, стеноза аортального клапана, атеросклероза аорты, общего ожирения, сахарного диабета
- Правый желудочек – из-за застойной сердечной недостаточности, хронической легочной недостаточности
- Левое предсердие – при артериальной гипертензии, общем ожирении, пороках аортального и митрального клапанов
- Правое предсердие – из-за легочных заболеваний (когда есть застой в малом кругу кровообращения).
Развитие
Вышеперечисленные причины заставляют поддерживать нормальный кровоток путем увеличения массы сердца. Надо принимать во внимание, что увеличение одного отдела сердца приводит к гипертрофии другого. Помимо кардиомиоцитов, в сердце есть еще и соединительная ткань. При гипертрофии сердца она тоже разрастается, а это приводит к снижению эластичности стенок и нарушению деятельности сердца.
Если нагрузка на сердце не снижается, то миокард постепенно истощается, потому что кровоток не справляется с питанием увеличенного сердца. Это может привести к нарушению проведения нервных импульсов (аритмии), склерозу и атрофии сердечной мышцы.
Симптомы
- Возможно бессимптомное течение гипертрофии сердца.
- При поражении левой половины сердца: боль в области сердца (усиливается после физической нагрузки), аритмия, потеря сознания, одышка, головокружение.
- При поражении правой половины сердца: кашель, одышка, синюшность (цианоз) или бледность кожных покровов, отеки, аритмия.
Диагностика
- УЗИ (ультразвуковое исследование) сердца
- ЭКГ (электрокардиография)
- Рентгенография органов грудной клетки.
Лечение
Требуется устранить причину возникновения гипертрофии сердца. Если это артериальная гипертензия – необходим прием антигипертензивных и мочегонных препаратов. Выраженные пороки клапанов сердца требуют хирургического лечения и протезирования. Заболевания органов дыхания требуют противовоспалительной и бронхорасширяющей терапии. В любом случае, подход всегда индивидуальный.
Для контроля артериального давления и раннего выявления аритмии рекомендую использовать автоматические тонометры производителя Microlife, представленные в нашем интернет-магазине.
Автор статьи — практикующий врач невролог Старшинин Максим Николаевич.
Гипертрофия левого желудочка сердца: диагностика, последствия и прогноз
^ О.В. Ускова1, 2, К.О. Соболев1, Г.И. Сторожаков1
1 Кафедра госпитальной терапии № 2 Лечебного факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова 2 Кафедра питания Российской медицинской академии последипломного образования
В статье дано определение и описаны методы диагностики гипертрофии левого желудочка сердца как прогностического фактора развития сердечно-сосудистых осложнений и хронической сердечной недостаточности. Освещается патогенез диастолической дисфункции и прогноз заболеваемости и смертности пациентов с сохранной систолической функцией левого желудочка. Изложены сведения о причинах дисфункции ушка левого предсердия, ее связи с нарушением наполнения левого желудочка и роли в генезе тромбоэмболических осложнений. Уделено внимание возможностям и побочным эффектам лечения больных с гипертрофией и диастолической дисфункцией левого желудочка.
Ключевые слова: гипертрофия левого желудочка, диастолическая дисфункция, ушко левого предсердия, ингибиторы ангиотензинпревращающего фермента.
Гипертрофия левого желудочка (ГЛЖ) — это явное увеличение массы миокарда левого желудочка (ММЛЖ), развивающееся при артериальной гипертензии (АГ), аортальных пороках сердца, недостаточности митрального клапана и других заболеваниях, сопровождающихся длительной перегрузкой левого желудочка (ЛЖ). В настоящее время ГЛЖ рассматривается не только как специфическое поражение сердца при АГ, но и как фактор риска развития сердечной недостаточности (СН) и внезапной смерти. Обнаружены возрастные и половые различия в частоте развития ГЛЖ. По данным Фремингемского исследования, ГЛЖ встречается у 16% мужчин и 19% женщин в возрасте до 70 лет, а в возрасте старше 70 лет — у 33 и 49% соответственно .
Широкое использование эхокардиогра-фии (ЭхоКГ) позволило классифицировать
Контактная информация: Ускова Оксана Васильевна, uskovaova@mail.ru
архитектонику ЛЖ у пациентов с АГ на четыре геометрические модели на базе таких показателей, как ММЛЖ, определяемая по формуле Я. Беуегеих:
Этими моделями являются:
1) концентрическая ГЛЖ (увеличение ММЛЖ и ОТС >0,45); на этой стадии гипертрофия развивается по пути параллельного добавления саркомеров внутри кар-диомиоцита, при этом определяющим фактором выступают эффекторы ренин-ан-гиотензин-альдостероновой системы: ангиотензин II, в большей степени ответственный за рост мышечных волокон, и альдостерон, изменяющий межклеточный мат-
Гипертрофия левого желудочка
рикс с развитием фиброза и формированием диастолической дисфункции (ДД) ЛЖ;
2) эксцентрическая ГЛЖ, при которой увеличение массы ЛЖ обусловлено его ди-латацией с развитием миокардиальной недостаточности при нормальной ОТС (<0,45);
3) концентрическое ремоделирование (нормальная масса и увеличение ОТС ЛЖ);
4) нормальная геометрия ЛЖ (нормальные масса и ОТС ЛЖ).
С целью объективизации все структурные параметры представляют в виде величин, индексированных к площади поверхности тела. Согласно данным Фремингем-ского исследования, ГЛЖ наблюдается в тех случаях, когда индекс ММЛЖ (ИММЛЖ) превышает 134 г/м2 у мужчин и 110 г/м2 у женщин. В последующих исследованиях, в которых в дополнение к измерениям в М-режиме использовалась двухмерная ЭхоКГ и осуществлялся более строгий популяционный отбор, в качестве критерия ГЛЖ был установлен ИММЛЖ >116 и >104 г/м2 для мужчин и женщин соответственно .
Доказано, что увеличение ММЛЖ является более сильным предиктором сердечнососудистых осложнений (ССО) и смертности, чем уровень артериального давления (АД) и другие факторы риска, за исключением возраста, причем наихудший прогноз имеет место у пациентов с концентрической ГЛЖ . Кроме того, повышенный риск сердечно-сосудистых заболеваний может быть связан с полиморфизмом некоторых генов, представляющих собой генетическую изменчивость локуса в определенной популяции. Таким геном является ген ангиотензинпревращающего фермента (АПФ). Генотип этого гена ассоциируется с высокой активностью АПФ в плазме и связан с риском развития ГЛЖ, инфаркта миокарда и спазма коронарных сосудов. Напротив, генотип II связан с повышенной переносимостью физических нагрузок и
более низким уровнем АПФ в сыворотке крови .
ЭКГ-диагностика ГЛЖ базируется на выявлении признаков перегрузки ЛЖ (смещение сегмента ЯБ—Т ниже изолинии и формирование отрицательного или двухфазного (+—) зубца Т в отведениях I, aVL, У5, У6) и вольтажных критериев гипертрофии: КаУЬ >11 мм; Яг + 8Ш >25 мм; Бу
+
Я
>28 мм у мужчин и >20 мм у жен-
щин; увеличение амплитуды зубца Я в левых грудных отведениях (У5, У6) и амплитуды зубца Б в правых грудных отведениях
(у^ у2); Яуі < Яу5 или Яу4 < Яуб; Яу5,6
>25 мм или Яу5 6 + Бу1 >35 мм у лиц старше 40 лет и >45 мм у лиц молодого возраста; Бу1 2 >22,5 мм, Яу5 6 >25 мм .
За последнее десятилетие было сформировано понимание роли ДД ЛЖ в снижении насосной способности сердца. Согласно определению Рабочей группы Европейского общества кардиологов по изучению диастолической СН, ДД — это удлинение, замедление и неполноценность диастолы, которые возникают из-за уменьшения способности желудочков расслабляться и/или из-за увеличения их жесткости. У 30—40% госпитализированных больных с хронической СН (ХСН) заболевание является следствием ДД ЛЖ, а у <85% пациентов амбулаторного звена с СН отмечается фракция выброса ЛЖ >45% .
В настоящее время известно, что диастола — активный, энергозависимый процесс, протекающий с затратой кислорода и использованием макроэргических соединений фосфора . Нарушение диастолической функции является следствием повышенной жесткости камеры сердца и гипертрофии миокарда и обусловлено кол-лагенизацией стромы и увеличением числа и массы мышечных волокон, нарушением их пространственной ориентации, а также недостаточностью кровоснабжения гипертрофированного миокарда ЛЖ . При
Лекции
ДД наиболее высокую гемодинамическую перегрузку испытывает левое предсердие (ЛП). По мере прогрессирования диастолических расстройств усугубляется дилата-ция ЛП и митральная регургитация, что является поворотным событием в процессе ремоделирования — осуществляется переход от концентрической ГЛЖ к эксцентрической с расширением полости ЛЖ и последующим развитием систолической дисфункции, резко утяжеляющей прогноз таких больных. Наличие ГЛЖ у пациента с АГ повышает вероятность развития СН в 15 раз.
Согласно данным обширного метаанализа 17 исследований, опубликованных до 2007 г. и включавших 24501 больного, прогноз в отношении выживаемости у пациентов с СН, имеющих сохранную систолическую функцию, в 2 раза лучше, чем у пациентов с систолической ХСН . Тем не менее значительное преобладание пациентов с СН с сохранной систолической функцией в популяции, относительно высокий риск смерти и повторных госпитализаций у данного контингента диктуют необходимость дальнейшего изучения механизмов, приводящих к ДД ЛЖ и фатальным ССО .
По данным отечественных авторов, у мужчин наибольшее прогностическое значение при развитии ГЛЖ имеют абсолютные значения АД в течение суток, тогда как у женщин — показатель вариабельности АД . Наиболее высокие значения периферического сосудистого сопротивления и выраженные нарушения диастолической функции характерны для больных с концентрическим ремоделированием и концентрической ГЛЖ. Важным является то обстоятельство, что у больных АГ с концентрической ГЛЖ гиперфункция ЛЖ сопровождается изменением функции правого желудочка и его гипертрофией. Развитие эксцентрической ГЛЖ влечет за собой истощение компенсаторных реакций и ухудшение сократимости миокарда обоих желудочков сердца . Нарушение диастоли-
ческой функции ЛЖ развивается до появления ЭхоКГ-критериев ГЛЖ.
Рутинным методом оценки нарушений диастолической функции является допп-лер-ЭхоКГ. В ходе ее проведения изучают скоростные показатели трансмитрального диастолического потока (ТМДП) в фазу быстрого наполнения (Е) и систолу предсердий (А) и их отношение (Е/А), временные параметры — продолжительность периода изоволюмического расслабления, систолы предсердий, время спада пика Е, а также скорость антеградных систолического и диастолического и ретроградного потоков через устья легочных вен. Продолжительность последнего сравнивают с продолжительностью ТМДП во время систолы предсердий . В зависимости от значений перечисленных показателей выделяют три типа наполнения ЛЖ: с замедленной релаксацией, псевдонормальный и рестриктивный, соответствующие незначительной, умеренной и тяжелой ДД .
В настоящее время всё большее применение в исследовании сократимости сердца, а также асинхронизма движения, податливости миокарда и активного расслабления приобретает импульсно-волновая тканевая допплерография, показатели которой — пиковые скорости движения латеральной и медиальной частей фиброзного кольца митрального клапана в систолу и различные фазы диастолы — легко можно оценить при использовании апикального доступа в ходе проведения трансторакальной ЭхоКГ .
Увеличение интереса к факторам риска развития ССО, в том числе инсультов, сопровождается всё большим распространением методов инструментальной диагностики, которые позволяют с максимальной точностью и достоверностью определять варианты строения межпредсердной перегородки, наличие тромбов и феномена спонтанного эхоконтрастирования в полостях сердца, а также строение и функцию ушка ЛП, нарушение которой может предрасполагать к локальному тромбообразова-
Гипертрофия левого желудочка
нию и системным эмболиям. Дилатация ЛП, являющаяся следствием различных причин, в том числе ДД ЛЖ и увеличения давления наполнения камер сердца, сопровождается нарушением функции ушка и повышенным внутристеночным стрессом. В связи с изложенным в последние несколько лет особое внимание в неврологической практике уделяется применению чреспищеводной ЭхоКГ у пациентов с фибрилляцией предсердий (ФП) и синусовым ритмом сердца.
При оценке скоростей сокращения и наполнения ушка, а также показателя скорости раннего диастолического потока, приобретающего значение при дисфункции ушка, целесообразно установить контрольный объем импульсно-волнового допплера в месте наилучшей визуализации потока (при цветовом допплеровском картировании), которое соответствует проксимальной трети ушка. Проведенные исследования свидетельствуют о существовании отрицательной корреляционной связи между скоростью сокращения ушка и скоростью волны А (систола ЛП) ТМДП, увеличение которой при ДД пропорционально снижению сократимости ушка. Кроме того, имеется положительная корреляционная связь между скоростями раннего диастолического выброса ушка ЛП и волны Е ТМДП и скоростями потока из легочных вен, прогрессивно снижающимися с возрастом вследствие замедления расслабления ЛЖ . В исследовании Т. ТаЪа!а е! а1. выявлена обратная корреляция между скоростью сокращения ушка и средним давлением заклинивания легочной артерии. Лечение СН, сопровождающееся снижением давления наполнения ЛП, способствует улучшению функции ушка ЛП .
При наличии ФП эхосигналы потока в ушке имеют более высокие скорости во время диастолы сердца. У пациентов с ФП различной этиологии, в том числе страдающих АГ и имеющих ГЛЖ, ДД ЛЖ и высокая частота сердечных сокращений, умень-
шающая период наполнения, определяют снижение скорости потоков в ушке ЛП и склонность к тромбообразованию в нем, повышая риск осложнений .
На сегодняшний день главным направлением в лечении ДД является воздействие на основное сердечно-сосудистое заболевание, а также коррекция предрасполагающих факторов (профилактика тахиаритмий, ишемии миокарда, восстановление синусового ритма). Необходимость применения мочегонных препаратов обусловлена наличием симптомов легочного и периферического венозного застоя, которые во многом определяются высоким конечно-диастолическим давлением ЛЖ. В то же время осложнением избыточной диуретической терапии является чрезмерное снижение уровня преднагрузки, объема наполнения ЛЖ и уменьшение сердечного выброса.
Необходимость применения Р-блокато-ров в лечении ДД обусловлена их способностью снижать активность симпатоадре-наловой системы, следствием чего является уменьшение частоты сердечных сокращений, создание оптимальных условий заполнения ЛЖ путем удлинения диастолы и восстановления диастолического резерва — «предсердной подкачки”, улучшение систолической функции ушка ЛП, а также гипотензивный, антиишемический и антиаритмический эффекты. Следует учитывать, что удлинение периода диастолического наполнения у пациентов с далеко зашедшими нарушениями диастолической функции и ригидным ЛЖ может стать причиной возникновения диастолической митральной регургитации и еще большего повышения давления в ЛП, что сопровождается ухудшением клинического состояния и снижением переносимости нагрузок. В этой связи начальным этапом в лечении пациентов с псевдонормальным и рестриктивным типами ДД должна быть гемодина-мическая разгрузка ЛП (например, использование мочегонных препаратов).
Лекции
Поскольку практически все гипотензивные препараты способны уменьшать ГЛЖ, частичная нормализация диастолической функции ЛЖ может отмечаться в случае успешного контроля АД. Лидирующую позицию при этом занимают ингибиторы АПФ (ИАПФ) как нейрогуморальные модуляторы, активно влияющие на патогенетическое и гемодинамическое звено прогрессирования ДД. Они снижают миокардиальный стресс, наиболее эффективно уменьшают ГЛЖ, замедляют процессы патологического ремоделирования. При многих патологических состояниях в миокарде наблюдается увеличение относительной плотности АТ2-рецепторов, основным местом экспрессии которых являются фиб-робласты, ответственные за синтез коллагенового матрикса. При увеличении образования ангиотензина II (по механизму отрицательной обратной связи при блокаде АТ^рецепторов) загружаются свободные АТ2-рецепторы, что способствует усилению антиростового эффекта. Поэтому альтернативой ИАПФ при непереносимости последних являются антагонисты рецепторов ангиотензина II как препараты, способные активно воздействовать на процессы интерстициального ремоделирования (пролиферацию и фиброз) .
Кроме того, в ряде экспериментальных и небольших клинических исследований совместное использование антагонистов рецепторов ангиотензина II и ИАПФ превосходило эффект изолированного приема
каждой из этих групп препаратов по влиянию на выраженность ГЛЖ и содержание ангиотензина II и альдостерона — основных эффекторов фиброза миокарда . Эффективность терапии была обусловлена выраженностью гипертрофии ЛЖ: чем более выраженной была ГЛЖ, тем хуже она поддавалась лечению. Значимой зависимости между ИММЛЖ и показателями, отражающими тяжесть АГ (длительность АГ, уровни систолического и диастолического АД), не выявлено. В то же время более выраженное снижение ИММЛЖ за период лечения наблюдалось у пациентов с изначально более высокими уровнями АД .
Пациенты с сохранной систолической функцией имеют лучший прогноз выживаемости, но смертность в группе больных с ДД ЛЖ всё же высокая (5-летняя выживаемость — 70%). Частота повторных госпитализаций сопоставима с таковой в группе пациентов с систолической ХСН . Расстройства диастолы более тесно, чем расстройства систолы, ассоциируются с тяжестью клинического состояния пациентов, степенью снижения толерантности к нагрузкам и показателями качества жизни. Следует отметить, что динамика диастолических параметров может служить критерием эффективности лечения и маркером прогноза у пациентов с ХСН .
Со списком литературы вы можете ознакомиться на нашем сайте www.atmosphere-ph.ru
Left Ventricular Hypertrophy: Diagnosis, Consequences, and Prognosis O.V. Uskova, K.O. Sobolev, and G.I. Storozhakov
1. Kannel WB. In: Left ventricular hypertrophy and its regression. Eds. Craickshank JM, Messerli FH. London 1992; 1-11.
2. Kannel WB. Left ventricular hypertrophy as a risk factor in arterial hypertension. Eur Heart J 1996; 13(Suppl D): 82-8.
6. Сидоренко Б.А., Преображенский Д.В. Гипертрофия миокарда левого желудочка: патогенез, диагностика и возможность обратного развития под влиянием гипертензивной терапии. Кардиология 1998; 5: 80-5.
7. Беленков Ю.Н., Агеев Ф.Т., Мареев В.Ю. Знакомьтесь: Диастолическая сердечная недостаточность. Серд недостат 2000; 1(2): 40-4.
8. Арутюнов Г.П., Чернявская Т.К., Розанова А.В. и др. Мониторинг диастолической дисфункции левого желудочка и микроальбуминурии, как критерий эффективности коррекции «мягкой» гипертонии. Серд недостат 2000; 2: 56-60.
10. Мазур Н.А., Глотов В.В. Диастолическая функция левого желудочка при гипертонической болезни. Кардиология 1994; 1: 90-2.
12. Юренев А.П., Quatro VDe, Парфенова И.Е и др. Немая ишемия у больных гипертонической болезнью. Кардиология 1992; 2: 6-8.
14. Юренев А.П., Дубов П.Б., Чарыев Х.Э. Гипертоническое сердце. Ашгабат 1994; 282 с.
15. Обратное развитие гипертрофии левого желудочка на фоне антигипертензивной терапии ассоциируется со снижением сердечно-сосудистой заболеваемости и смертности/ HTML. Cardiosite.ru, по материалам JAMA 2004; 292: 2343-9, 2350-6.
28. Целуйко В.И. Гипертрофия миокарда левого желудочка при артериальной гипертензии. HTML. Solvay.farm/ru.
29. Моисеев В.С. Достижения и спорные вопросы в изучении кардиомиопатии и миокардитов. Практ врач: Прил к журн «Медикал маркет» 1996; 4: 4-10.
31. Simpson PC. Molecular mechanisms in myocardial hypertrophy. Heart Failure 1989; 5(3): 113-29.
36. Кисляк О.А. Оптимальная блокада ренин-ангиотензин- альдостероновой системы: современные принципы лечения артериальной гипертензии блокаторами ангиотензиновых рецепторов. Фарматека 2005; 20: 34-9.
38. Чихладзе Н.М., Чазова И.Е. Эффективность воздействия блокатора АТ1-ангиотензиновых рецепторов ирбесартана на органы-мишени у больных артериальной гипертонией. Сист гиперт 2004; 06(2).
46. Мареев В.Ю., Овчинников А.Г., Агеев Ф.Т., Беленков Ю.Н. Влияние ингибиторов АПФ и антагонистов рецепторов к ангиотензину-II на диастолическую функцию левого желудочка у пациентов с сердечной недостаточностью и относительно сохранной систолической функцией левого желудочка: результаты исследования «Периндоприл, ИРбесартан и АмлодипиН у болЬных с ХСН и сохраненной систолической функцией левого желудочка (ПИРАНЬЯ)». ЖСН 2005; 6(1).
52. Marian A, Roberts R. The molecular genetic basis for hypertrophic cardiomyopathy. J Mol Cell Cardiol 2001: 33: 655-70.
54. Гуревич М.А Является ли консервативная терапия гипертрофической кардиомиопатии альтернативой хирургическому лечению? РКЖ 2001; 3.
- Авторы
- Файлы
Осипова О.А. Афанасьев Ю.И. Вахрамеева А.Ю.  109 KB
109 KB
Одним из фундаментальных механизмов, составляющих основу для развития хронической сердечной недостаточности (ХСН) у больных с постинфарктным кардиосклерозом (ПИКС) определяющих в дальнейшем течение и исходы заболевания, является ремоделирование миокарда.
Ремоделирование сердца это довольно сложная проблема, которая является результатом взаимодействия механических факторов, которые приводят к адаптационным модификациям кардиоцитов.
В связи с этим целью нашего исследования было изучение структурно-функциональных показателей у больных с концентрической гипертрофией (КГ) левого желудочка (ЛЖ) на ранних этапах ПИКС при хронической сердечной недостаточности (ХСН).
Материалы и методы Критериями включения больных в исследование были: перенесенный инфаркт миокарда в анамнезе (3-4 неделя заболевания), отсутствие стабильных нарушений внутрижелудочковой проводимости. Группу контроля составили 25 практически здоровых лиц, сопоставимых по возрасту и полу с больными перенесшими инфаркт миокарда. Учитывая геометрическую модель левого желудочка концентрическая гипертрофия была выявлена у 61 больного.
Всем больным было выполнено ультразвуковое исследование сердца на эхокардиографе «SIM 5000 plus» Co.I (Япония) эхоимпульсным методом в одно- и двухмерном режиме исследования с частотой ультразвука 3,5 МГц по общепризнанной методике. Определяли следующие показатели: конечно-диастолический объем (КДО), конечно-систолический объем (КСО), ударный объем (УО), ударный индекс (УИ) левого желудочка, скорость циркулярного укорочения волокон миокарда (СЦУ), степень укорочения передне-заднего размера ЛЖ (СУРлж), минутный объем крови (МОК), сердечный индекс (СИ), фракция выброса ЛЖ (ФВ), масса миокарда ЛЖ (ММлж), толщина межжелудочковой перегородки в диастолу (ТМЖПд), толщина задней стенки ЛЖ в диастолу (ТЗСлжд), индекс массы миокарда ЛЖ (ИММлж), индекс относительной толщины миокарда ЛЖ (ИОТ), толщина задней стенки ЛЖ в диастолу ЗСлжд.
Для определения функционального класса (ФК) ХСН всем обследуемым проводили пробу с 6-минутной ходьбой в размеченном. Для статистической обработки данных использовался пакет программ «Statictica 6.0».
Результаты и обсуждение.
У больных с КГ ЛЖ наблюдалось увеличение КДО у 45,2%, КСО — у 29%, ИММлж — у 100% больных. ФВ была снижена у 38,7%. Изменение скорости циркулярного укорочения волокон миокарда распределилось таким образом: у 41,9% она была увеличена и у 9,7% — уменьшена, а степень укорочения размеров левого желудочка была увеличена у 16,1% и уменьшена у 9,7% больных. Увеличение ударного объема наблюдалось у 29%, сердечный индекс был увеличен у 18,5% и уменьшен у 7,5% больных.
При сравнении средних показателей больных с концентрической гипертрофией с показателями контрольной группы определяется достоверное увеличение КДО на 22,8%, КСО на 33,8% и ИММлж на 49,8%. Полученные данные указывают на увеличение объемных показателей камер сердца и на увеличение массы миокарда, причем увеличение массы миокарда превалирует над дилатацией полости левого желудочка.
Анализ показателей сократительной функции показал снижение фракции выброса на 10%, увеличение скорости циркулярного укорочения волокон миокарда на 13%, при практически неизмененных показателях степени укорочения размеров левого желудочка. Гемодинамические нарушения проявлялись увеличением ударного объема на 35,3%, сердечный индекс сохранился в пределах нормы (таблица 1)
При сравнительном анализе показателей систолической и насосной функции было обнаружено достоверное снижение ФВ на 11% (р=0,02), а так же некоторое увеличение УО на 35,3% (р=0,07) и СЦУ на 5,5% (р=0,1). Показатели СУР и СИ практически не изменялись. Полученные данные свидетельствуют о снижении систолической функции левого желудочка в этой подгруппе больных, что может объясняться наличием сопутствующей систолической дисфункции у 11% (4) обследованных, а увеличение УО и СЦУ наблюдается в результате наличия гипертрофии миокарда левого желудочка.
Библиографическая ссылка
Осипова О.А., Афанасьев Ю.И., Вахрамеева А.Ю. КОНЦЕНТРИЧЕСКАЯ ГИПЕРТРОФИЯ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА У БОЛЬНЫХ ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ // Успехи современного естествознания. – 2007. – № 2. – С. 39-40;
URL: http://www.natural-sciences.ru/ru/article/view?id=10911 (дата обращения: 29.10.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI