Ихг исследование
Содержание
- Опухоли молочной железы
- Опухоли предстательной железы
- Опухоли легкого
- Меланома
- Лимфопролиферативные заболевания
- Стромальные опухоли желудочно-кишечного тракта (СОЖКТ)
- Колоректальный рак
- Метастатическая карцинома
- Опухоли желудка.
- Определение экспрессии рецептора EGFR при опухолях эпителиальной природы
- Иммуногистохимическое исследование рецепторной чувствительности к эстрогенам и прогестерону в эндометрии
- Хронический эндометрит
- Иммуногистохимическое исследование рецептивности эндометрия (окно имплантации)
Опухоли молочной железы
Рак молочной железы является наиболее часто встречающимся видом рака у женщин и второй по частоте причиной смерти, связанной с раком. Ранняя диагностика, своевременно и правильно проведенное лечение могут значительно повысить шансы на выздоровление. Традиционные техники иммуногистохимии (ИГХ) позволяют работать с очень небольшими образцами ткани. Это обстоятельство в сочетании с применением антител, специфичных по отношению к антигенам опухолевых клеток, делает данный метод эффективным средством в руках патоморфолога, занимающегося диагностикой и прогнозированием течения онкологических заболеваний.
Основные диагностические маркеры:
- Estrogen Receptor
- Progesterone Receptor
- HER-2/neu
- Ki-67
- p120 Catenin
- CadherinE
- «Золотой стандарт» диагностики опухолей молочной железы — гормональный профиль PR, ER, HER-2/neu, Ki-67 — это диагностика всех доступных рецепторов, которые отвечают за активность раковой ткани. Включает в себя исследование нескольких показателей.
- PR, ER — это специфические белки-рецепторы, которые реагируют на выработку эстрогенов и прогестерона. Большинство раковых образований молочной железы (около 80 процентов) активно реагируют на изменения фона гормонов. Определение реактивности этих рецепторов играет важнейшую роль при оценке возможностей терапии гормонами.
- HER-2/neu — это генная белковая структура, которая расположена в раковой ткани. Представляет собой рецептор, который реагирует на выработку специфических антител. Исследовать данный параметр целесообразно с точки зрения определения прогноза лечения рака. При высокой активности HER-2/neu опухоль плохо поддается лечению, требуется сначала моноклональная терапия, направленная на подавление активности этой структуры.
- Ki-67 — это белковая структура, обладающая способностью активизироваться при активном росте опухоли. Исследование этого показателя дает возможность оценить прогноз для жизни больного. Чем выше экспрессивные характеристики Ki-67, тем меньше опухолевая дифференцировка, тем меньше шансов у больной женщины на выздоровление.
Опухоли предстательной железы
Рак предстательной железы – одно из самых распространенных онкологических заболеваний в мире. Большинство случаев (50 – 70%) диагностируется на 3-4 стадиях, в том числе 25% — с генерализацией опухолевого процесса. К сожалению, ранняя диагностика рака затруднена из-за частого отсутствия характерных симптомов. Наряду с клиническими методами, наиболее информативным является метод гистологического исследования биоптатов предстательной железы.
Основные диагностические маркеры:
Опухоли легкого
Рак легкого является одной из наиболее частых причин смерти. В мире ежегодно от данного заболевания умирает около 1 миллиона человек. У мужчин рак легкого в 85-90% случаев связан табакокурением. Прогноз при раке легкого остается неблагоприятным. При отсутствии лечения с момента установления диагноза в течение 2 лет погибает до 90 % больных. При хирургическом лечении 5-летняя выживаемость составляет около 30%. Хирургическое лечение в сочетании с лучевой и медикаментозной терапией увеличивает 5-летнюю выживаемость на 40 %. Наличие метастазов значительно ухудшает прогноз. Современная диагностика и лечение больных раком легкого не может обходиться без морфологической верификации опухоли с уточнением гистологической структуры и степени анаплазии (дифференцировки) опухолевых клеток. Иммуногистохимический метод остается одним из самых информативных методов на данном этапе диагностики
Основные диагностические маркеры:
- Thyroid Transcription Factor-1;
- Cytokeratin 7;
- НЕМЕЛКОКЛЕТОЧНЫЙ РАК ЛЕГКОГО
- ALK (DE5F3);
- ПЛОСКОКЛЕТОЧНЫЙ РАК ЛЕГКОГО
- Cytokeratin 14;
- Cytokeratin 5/6;
- CEA;
- EGFR;
- МЕЛКОКЛЕТОЧНАЯ КАРЦИНОМА ЛЕГКОГО
- ChromograninA;
- Synaptophysin;
- АДЕНОКАРЦИНОМА ЛЕГКОГО
- EMA;
- CytokeratinPan.
Меланома
Мелано́ма (лат. melanoma, melanoma malignum от др.-греч. μέλας — «черный») (уст. Меланобластома) — злокачественная опухоль, развивающаяся из меланоцитов — пигментных клеток, продуцирующих меланины. Одна из трёх разновидностей рака кожи, и самая опасная из них. Преимущественно локализуется в коже, реже — сетчатке глаза, слизистых оболочках (полость рта, влагалище, прямая кишка). Одна из наиболее опасных злокачественных опухолей человека, часто рецидивирующая и метастазирующая лимфогенным и гематогенным путем почти во все органы. Верификация меланомы кожи и ее метастазов остается одной из наиболее сложных задач для онкоморфолога. Среди беспигментных меланом встречаются узловые, поверхностно-распространяющиеся, типа лентиго, светлоклеточные, веретеноклеточные, плеоморфные, мелкоклеточные, миксоидые, «невоидные», перстевидноклеточные и другие формы.
Основные диагностические маркеры:
Стандартная панель содержит около пяти иммуногистохимических маркеров:
- р53 — степень активности митоза меланомы;
- Ki-67 — оценка интенсивности пролиферации, определяет прогноз болезни;
- bcl-2 — белок, который препятствует естественному апоптозу меланомы кожи, оценивается вероятность метастазирования;
- HMB-45 — оценка функции меланоцитов;
- S-100 — типичный антиген, встречающийся только при меланоме, позволяющий отличить от других опухолей или доброкачественных образований.
Лимфопролиферативные заболевания
Лимфома – злокачественное опухолевое заболевание лимфатической системы. Среди лимфом выделяют лимфогранулематоз (лимфому Ходжкина) и все остальные виды лимфом — неходжкинские лимфомы (НХЛ). По тому, из каких именно видов лимфоидных клеток возникает опухоль, выделяют В-, Т- и (редко) NK-клеточные лимфомы. Большинство лимфом – В-клеточные. Диагностика лимфопролиферативных заболеваний в настоящее время занимает передовые позиции в современной патологии и требует одну из самых обширных панелей маркеров. Суммарная заболеваемость всеми видами неходжкинских лимфом в европейских странах составляет 12-15 случаев на 100 тысяч населения в год. Риск их возникновения увеличивается с возрастом. Инфицирование вирусом Эпштейна-Барр связано с повышенным риском заболевания различными видами лимфом, включая лимфому Беркитта. У детей неходжкинские лимфомы сравнительно редки: к детскому и подростковому возрасту относится не более 5% всех случаев НХЛ. Однако все же лимфомы занимают в структуре злокачественных заболеваний детского возраста третье место по частоте – после лейкозов и опухолей центральной нервной системы.
Основные диагностические маркеры:
Стромальные опухоли желудочно-кишечного тракта (СОЖКТ)
СОЖКТ возникают преимущественно в желудке (60 %) и тонком кишечнике (25 %), но также наблюдаются в прямой кишке (5 %), пищеводе (5 %) и ряде других мест (5 %), в том числе аппендикс, желчный пузырь, мезентерий и сальнике. Возраст заболевших пациентов колеблется в диапазоне от подросткового возраста до 90-летних, но большинство больных старшего возраста с пиком около 60 лет. В большинстве исследований наблюдается незначительная предрасположенность мужчин. В 1998 было показано, что СОЖКТ экспрессирует тирозинкиназный рецептор KIT (CD117). Причиной возникновения этих опухолей оказались интерстициальные клетки Кахаля (ICC). Подобно СОЖКТ, клетки Кахаля экспрессируют KIT и большинство положительно на CD34. Последующие исследования с большим числом разных лабораторий подтвердили, что KIT – это единственный наиболее специфичный маркер СОЖКТ. Иммуноопределяемый KIT присутствует на клеточной поверхности и/или в цитоплазме опухолевых клеток СОЖКТ приблизительно в 90 % случаев. В подавляющем большинстве опухолей экспрессия KIT бывает сильной и однородной, но в некоторых случаях демонстрируется только фокальная положительная реактивность и KIT отсутствует в небольшой подгруппе (~5%) опухолей, которые по другим мофологическим и иммунофенотипическим признакам соответствуют СОЖКТ. Среди KIT-положительных СОЖТК экспрессия CD34 определяется в 60-70 % случаев, тогда как 30-40 % имеют положительную реакцию на гладкомышечный актин (SMA), а 5% — на белок S-100. Ни один из этих антигенов не является специфичным для СОЖКТ. Экспрессия десмина в истинных KIT-положительных СОЖКТ является крайне редкой (1-2 % случаев) и обычно фокальной. Данная форма онкологических заболеваний тяжело поддается морфологической диагностике. Используя современные панели маркеров возможно четко и обоснованно диагностировать разные формы описываемой патологии. Иммуногистохимическоее исследование является обязательным.
Основные диагностические маркеры:
- CD117 c-kit;
- CD34;
- Desmin;
- Beta-Catenin;
- S100;
- GFAP;
- CD99;
- ActinSmoothMuscle.
Колоректальный рак
Колоректальный рак является третьим по частоте диагностируемым раком в Соединенных Штатах (за исключением рака кожи) среди мужского и женского населения. Показатели заболеваемости колоректальным раком снижаются на протяжении последних двух десятилетий (с 66,3 случаев на 100000 человек в 1985 году до 45,5 случаев в 2006 году). Это связывают с увеличением использования колоректальных скрининг-тестов, которые позволяют обнаруживать и удалять полипы ЖКТ до их перерождения в рак. В отличие от общего сокращения, среди взрослого молодого населения в возрасте до 50 лет, для которого скрининг не рекомендуется из-за средней степени риска, заболеваемость раком ободочной и прямой кишки увеличивались с 1994 года примерно на 2% в год у мужчин и женщин. В 2016 году США смертность от колоректального рака составила 49500 случаев. Смертность от колоректального рака снизились в обоих группах мужчин и женщин за последние несколько десятилетий, с более крутым снижением в последний период времени. Это снижение отражает снижение показателей заболеваемости и улучшение ранней диагностики и лечения. Ранние стадии рака ободочной и прямой кишки обычно не имеют симптомов, поэтому, чтобы выявить заболевание на этой ранней стадии часто необходим скрининг. Прогрессирование болезни может вызвать кровотечение из прямой кишки, появление крови в кале, изменение в опорожнении кишечника, схваткообразные боли в нижней части живота. Применение ИГХ при раках толстого кишечника рассматривается на нескольких уровнях: для характеристики опухолей (эндокринный или эпителиальный тип), наследственной предрасположенности и для целей прогноза. Преобладающее использование ИГХ — это определение возможных или предполагаемых метастазов, в которых толстой кишки является возможным первичным. Типичной локализацией для метастазов толстой кишки являются печень и легкие, оба органа, которые могут производить морфологию рака идентичную метастазам из толстой кишки. ИГХ, (класс I правил регулирования FDA), используется после первичной диагностики опухоли путем гистопатологического исследования и не включается для клиницистов как независимое исследование.
Основные диагностические маркеры:
- Beta-Catenin;
- BRAF;
- CDX-2;
- COX-2;
- Cytokeratin 7;
- Cytokeratin 19;
- Cytokeratin 20;
- MLH1;
- MLH2;
- MLH6;
- MSLN;
- MUC1;
- MUC2.
Метастатическая карцинома
Наиболее часто применение иммуногистохимии в изучении опухолей печени – это определение источника метастаза, когда первичная локализация опухоли не известна. Развитие и применение панели для иммунных окрашиваний может помочь решить почти все диагностические проблемы. 2-6 Цитокератины (CK) 7 и CK 20 – первая ступень в идентификации многих опухолей и с дополнительными иммунными реакциями относительно специфичными для опухолей женского и мужского полового тракта, нередко дает возможность идентифицировать первичную локализацию метастатической опухоли.
Основные диагностические маркеры:
- Цитокератины различного молекулярного веса (CK 18, CK 19, CK 7, и CK 20 и др.).
Также в диагностическую панель рекомендуется включать ИГХ тесты, направленные на экспрессию НER2/neu и Ki-67.
- НER2/neu — представляет собой мембранный белок, который кодируется геном ERBB2. Повышение его экспрессии имеет важное значение в патогенезе и прогрессировании определенных злокачественных процессов. Тестирование данного рецептора является важным биологическим маркером рака желудка, молочной железы, матки и ее придатков.;
- Ki-67 — ядерный антиген, состоящий из двух полипептидных цепей и являющийся основной частью нуклеарного матрикса. Его экспрессия позволяет выделить пролиферирующие клетки опухолевидного образования, которые находятся в активной фазе жизненного цикла клетки. Данный маркер позволяет определить фенотип и скорость роста опухоли, риск ее метастазирования, потенциальную ответную реакцию на лечебные мероприятия и исход патологического процесса.
Опухоли желудка.
Иммуногистохимические исследования (ИГХ) , как правило, не требуются для оценки доброкачественных и злокачественных эпителиальных опухолей желудка, так как гистопатология, как правило, обеспечивает диагностику, но ИГХ нужна при изучении метастатического рака желудка, когда источник происхождения опухоли не ясен, или когда макроскопические / рентгенологическое проявления опухоли сбивают с толку (например, рак желудка напрямую и широко прорастает в печень и гистологически неотличим от холангиокарциномой). К тому же, ИГХ может быть полезна для идентификации некоторых вариантов желудочных карцином, включая гепатоидную аденокарциному, в которой печеночная дифференцировка может быть подтверждена позитивной реакцией на альфа-фетопротеин AFP. Аденокарциномы желудка будут реагировать со многими антителами против кератинов, включая, CK 18, CK 19, CK 7, и CK 20. Когда CK 7 и CK 20 используются вместе, многие аденокарциномы желудка будут окрашиваться как CK 7 так и CK 20. Примерно 25% случаев будет иметь фенотип CK 7 + / CK 20-, или CK 7- / CK 20+), и небольшое число случаев будет отрицательным для обоих маркеров. Первоначально считалось, что CDX-2 — специфический маркер для рака толстой кишки, будет реактивными в более чем 50% случаев и может быть свидетельством меньшей степени инвазивности. Аденокарцинома желудка, как кишечного типа, так и типа перстневидноклеточной карциномы, могут иметь нейроэндокринную дифференцировку и что может быть не очевидно по гистологической картине, но проявляться по окрашиванию хромогранином и /или синаптофизином
Определение экспрессии рецептора EGFR при опухолях эпителиальной природы
Иммуногистохимическое (ИГХ) определение экспрессии рецептора EGFR при колоректальном раке и опухолях легкого, а также при опухолях шеи и головы, проводят для адекватного выбора схем химиотерапевтического лечения.
EGFR (Epidermal Growth Factor Receptor) является одним из трансмембранных рецепторов, экспрессируется на поверхности эпителиальных клеток и принимает участие в регуляции роста клеток и дифференцировки. Деление клеток в его присутствии происходит намного быстрее. При активации рецептора EGFR после связывания с факторами роста (EGF и TGF-a), запускаются механизмы, которые приводят к росту опухоли и пролиферация раковых клеток повышается, также стимулируется процесс метастазирования.Экспрессия EGFR — это показатель, свидетельствующий о том, что рост опухоли стимулируется деятельностью рецептора эпидермального фактора роста. Так как активация рецептора происходит за счет веществ самого новообразования, то правильнее будет говорить о экспрессии EGFR опухолью.Экспрессия EGFR обнаружена при следующих формах рака: легких, шеи и головы, толстой и прямой кишки. Иммуногистохимическое определение экспрессии EGFR позволяет установить статус этих рецепторов и назначить лечение. Экспрессия EGFR напрямую связана со степенью злокачественности и стадией развития опухоли.Специалист в соответствии с полученными данными иммуногистохимического исследования классифицирует опухоль как EGFR-отрицательную или EGFR-положительную.
Гиперэкспрессия EGFR говорит о высокой злокачественности, поздних сроках развития опухоли и метастатических процессах. Этот фактор является неблагоприятным в отношении прогноза болезни и свидетельствует о высокой пролиферативной активности опухоли, агрессивности, устойчивости к проводимой терапии.
Низкая степень экспрессии EGFR свидетельствует о регрессе опухоли положительной динамике в лечении.
Иммуногистохимическое исследование рецепторной чувствительности к эстрогенам и прогестерону в эндометрии
Иммуногистохимическое исследование рецепторной чувствительности к эстрогенам и прогестерону в эндометрии проводится для выявления причин отсутствия фертильности, а также для оценки злокачественности процессов в тканях матки. Исследование сложное, проводится планово, необходима соответствующая квалификация патологоанатома.
Рецепторы к эстрогенам (ER) и прогестерону (PR) — это чувствительные маркеры, которые реагируют на колебания некоторых гормонов, влияющих на рост опухолей и развитие гиперпластических процессов в эндометрии. Расположены они как в тканях эпителия матки, так и в клетках молочной железы. Их определение дает возможность оценить влияние гормональных факторов на прогрессию злокачественного роста, а кроме того, выявить наличие других очагов активности, помимо маточного. Входят в программу обязательного скрининга у больных женщин с подозрением на инфильтративную активность рака.
Иммуногистохимическое исследование проводят при:
- бесплодии;
- опухолях эндометрия;
- дисфункции менструаций;
- гиперпластических процессов в эндометрии.
При бесплодии методика позволит выяснить, может ли плодное яйцо прикрепится к стенке матки. Для рака метод не является способом ранней диагностики. Оценка рецепторной активности позволяет выявить наличие метастазирования, и оценить эффективность лечения в полости матки. При нарушениях овуляции методика выясняет эффективность гормональной терапии. При изменениях в полости матки гиперпластического характера усиление активности рецепторов к эстрогенам и прогестеронусвидетельствует о развитии низкодифференцированных опухолей, потенциально опасных для жизни женщины.
Общий принцип результата — чем больше экспрессия рецепторной активности, тем выше вероятность прогрессирования опухоли. Чем ниже активность, тем меньше возможность естественного оплодотворения.
Хронический эндометрит
Хроническим эндометритом называют воспаление мукозного слоя матки, которое провоцируют различные вирусы или патогенные микроорганизмы. В патологическом очаге происходят морфологические и функциональные изменения эндометрия.Хронический эндометрит – клинико-морфологический синдром, при котором в результате повреждения эндометрия инфекционным агентом возникают множественные вторичные морфофункциональные изменения, нарушающие циклическую биотрансформацию слизистой оболочки матки, что приводит к стойкому нарушению менструальной и генеративной функций.Частота встречаемости хронического эндометрита в популяции составляет 2,6- 51%. Причём среди этих женщин бесплодны 60,4%, а неудачные попытки ЭКО и переноса эмбрионов отмечены у 37%. В 2006 г. Международная Федерация Гинекологии и Акушерства уравняла понятия «неразвивающаяся беременность» и «хронический эндометрит».
Причины хронического эндометрита:
- инфекции органов малого таза, влагалища и цервикального канала;
- внутриматочная спираль;
- ранние интимные контакты;
- радиотерапия тазовых органов;
- хирургическое вмешательство в полость матки;
- злоупотреблением алкоголем и курение.
Практикующие специалисты относят воспалительные процессы, происходящие в органах малого таза, к аутоиммунной патологии. Для определения характера нарушений и выявления пациенток с патологическим ответом иммунной системы, который провоцирует воспаление эндометрия, назначается иммуногистохимическое исследование, которое проводят с использованием стандартной панели моноклональных антител:CD16, CD20, CD138, CD56, HLA-DR.
Иммуногистохимическое исследование рецептивности эндометрия (окно имплантации)
Рецептивность эндометрия – комплекс структурно -функциональных характеристик эндометрия, определяющий способность его к имплантации. С начала 90-х годов прошлого столетия понятие «рецептивность эндометрия» начинает обретать своё современное значение как процесс сложной интеграции и многоуровневого «диалога» между эндометрием и эмбрионом в специфический период «окна имплантации».Продолжительность «окна имплантации» у человека составляет в среднем 4 дня: с 6-го по 8-10 — й день после пика секреции ЛГ, или 20-24 день менструального цикла (при 28 -дневном менструальном цикле).В настоящее время различают три уровня рецептивности: генетический, протеомный и гистологический. При открытии «окна имплантации» в эндометрии усиливается экспрессия 395 генов (АроЕ, PLA2) и снижается экспрессия 186 генов (ITF, различные протеазы, внеклеточные матриксные белки и др.). Среди протеомных маркёров, связанных с рецептивностью эндометрия, выделяют различные молекулы адгезии, факторы роста, цитокины и рецепторы: семейство IL-1, LIF и LIF-R, αVβ3, TNF-α, IFN-γ и др. Из них наиболее изученным является лейкемия-ингибирующий фактор (LIF) – член семейства IL-6. Максимальная его экспрессия в эндометрии наблюдается на 20-й день цикла.Третий уровень рецептивности – гистологический. «Окну имплантации» в эндометрии соответствует средняя стадия фазы секреции менструального цикла.Эндометрий может обладать рецептивными свойствами только в том случае, если молекулярные маркёры рецептивности выявляются точно в среднюю стадию фазы секреции менструального цикла.Одним из ключевых ультраструктурных образований, участвующих в формировании рецептивности, являются пиноподии. Это микроскопические выпячивания в апикальной части поверхностного эпителия эндометрия, образующиеся на месте микроворсинок в «окно имплантации» и выступающие в полость матки. Предполагают, что основные рецепторы для прикрепления бластоциты располагаются на поверхности пиноподий, где также концентрированно экспрессируется LIF.Любой дисбаланс в экспрессии стероидных рецепторов может привести к нарушению морфофункциональных свойств эндометрия, его рецептивности. Поэтому определение уровня ER и PR в среднюю стадию фазы секреции позволяет дополнить морфологическое исследование эндометрия, оценить его рецептивность. В норме показатель соотношения PR/ER в строме колеблется от 2 до 4.В среднюю стадию фазы секреции наблюдается физиологическое снижение уровня ERα в эндометрии. Это – критическое событие, освобождающее от подавляющего влияния определённые гены и обеспечивающее сигнал для начала внутриматочной рецептивности.
Гиперэкспрессия ER α в среднюю стадию фазы секреции вызывает нарушение экспрессии биологических маркёров имплантации, нарушает рецептивность эндометрия.
Программа комплесного исследования состоит из следующей панели антител: ER, PgR, CD56, CD138, LIF, а также подсчет количества пиноподий.
Иммуногистохимическое (ИГХ) исследование представляет собой метод идентификации специфичных антигенных свойств злокачественных опухолей. Иммуногистохимические методы используются для выявления локализации того или иного клеточного или тканевого компонента (антигена) in situ посредством связывания его с мечеными антителами и являются неотъемлемой частью современной диагностики рака, обеспечивая обнаружение локализации в тканях различных клеток, гормонов и их рецепторов, ферментов, иммуноглобулинов, компонентов клеток и отдельных генов.
Цели ИГХ исследования
ИГХ исследования позволяют:
1) осуществлять гистогенетическую диагностику опухолей;
2) определять нозологический вариант новообразования;
3) выявлять первичную опухоль по метастазу с неизвестным первичным очагом;
4) определять прогноз опухолевого заболевания;
5) определять злокачественную трансформацию клеток;
6) определять возможности таргетной терапии;
7) выявлять как резистентность, так и чувствительность опухолевых клеток к химиотерапевтическим препаратам;
8) определять чувствительность опухолевых клеток к лучевой терапии.
Как проводится ИГХ исследование?
ИГХ исследование начинается с забора материала. Для этого проводят трепан-биопсию, при которой производят забор столбика ткани из опухоли и близлежащих тканей, либо материал поступает с операции. Затем материал фиксируют. После фиксации материал отправляется в проводку, что позволяет подготовить его к работе (обезжирить и дополнительно фиксировать). После проводки все образцы заливают парафином, получая гистологические блоки. Парафиновые блоки хранятся вечно, поэтому провести исследование ИГХ можно при наличии парафиновых блоков, сделанных ранее.
Следующим этапом ИГХ исследования является микротомирование — лаборант делает срезы с парафиновых блоков толщиной до 1,0 мкм и помещает их на специальные гистологические стекла.
Затем производятся последовательно рутинная окраска и иммуногистохимическое исследование, позволяющие на каждом этапе все более и более дифференцировать фенотип и нозологию опухоли.
Как видно, ИГХ исследование представляет собой сложный многоступенчатый процесс, и поэтому для проведения ИГХ исследования следует выбирать самую современную лабораторию с высококвалифицированными специалистами и высокой долей автоматизации — так Вы сведете на нет риски получения некачественной диагностики. Такой лабораторией на сегодняшний день является ЮНИМ.
Отдельно следует сказать о сроках проведения данного исследования. В среднем по России, ИГХ исследование производится в сроки от 10 дней до нескольких недель. При обращении в ЮНИМ Вы можете сделать исследование ИГХ всего за 3 дня! Также преимуществом проведения ИГХ исследования в ЮНИМе является бесплатная курьерская доставка Ваших материалов на исследование из любого города России. При необходимости проведения исследования ИГХ стоимость уточняйте, подав заявку на исследование, либо звоните по горячей линии (бесплатно по России): 8 800 555 92 67.
Иммуногистохимия (ИГХ) – это метод локализации специфических антигенов в тканях, основанный на распознавании антигена соответствующим антителом и выявления результатов этого связывания на светооптическом уровне.
 История ИГХ началась в 1940-х годах, когда Coons с соавторами разработали технику иммунофлуоресценции для выявления антигенов в замороженных срезах. Позже были разработаны и внедрены антитела, меченые не флуоресцентными красителями, а ферментами. Нанесение ферментной метки (пероксидаза хрена) на антитело, открытое Avrameas и Nakane с последующим воздействием визуализирующей системы, позволило увидеть окрашенный продукт реакции отмеченного антитела в световой микроскоп. Таким образом стало возможным идентифицировать клетки различных типов по их уникальным признакам (маркерам). Кроме того, метод позволил выявлять гормоны и рецепторы к ним, а также изучать синтетические и секреторные процессы.
История ИГХ началась в 1940-х годах, когда Coons с соавторами разработали технику иммунофлуоресценции для выявления антигенов в замороженных срезах. Позже были разработаны и внедрены антитела, меченые не флуоресцентными красителями, а ферментами. Нанесение ферментной метки (пероксидаза хрена) на антитело, открытое Avrameas и Nakane с последующим воздействием визуализирующей системы, позволило увидеть окрашенный продукт реакции отмеченного антитела в световой микроскоп. Таким образом стало возможным идентифицировать клетки различных типов по их уникальным признакам (маркерам). Кроме того, метод позволил выявлять гормоны и рецепторы к ним, а также изучать синтетические и секреторные процессы.
Метод получил широкое распространение в диагностической патологии только в 1990-х. Taylor и Burns первыми успешно продемонстрировали метод на фиксированной в формалине заключенной в парафин ткани (т.е. на гистологических препаратах, приготовленных стандартным способом).
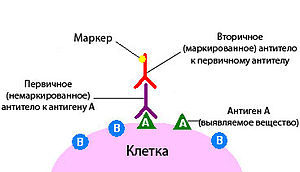 Существуют различные способы проведения реакции. Так, наиболее часто используют прямой метод, при котором маркированные антитела антитела связываются непосредственно с выявляемым веществом. Более чувствительным является непрямой метод, основанный на том, что немаркированные первичные антитела связываются с искомым антигеном, а затем обнаруживаются при помощи вторичных меченых антител.
Существуют различные способы проведения реакции. Так, наиболее часто используют прямой метод, при котором маркированные антитела антитела связываются непосредственно с выявляемым веществом. Более чувствительным является непрямой метод, основанный на том, что немаркированные первичные антитела связываются с искомым антигеном, а затем обнаруживаются при помощи вторичных меченых антител.
Для повышения чувствительности метода начали использовать многоступенчатую визуализацию (пероксидазно-антипероксидазный, авидин-биотиновый, биотин-стрептавидиновый метод) и в итоге были разработаны высокочувствительные «полимерные” методы амплификации.
С момента внедрения метода в диагностическую практику, его применение значительно расширилось, иммуногистохимическое исследование перестало быть предметом только научных исследований. ИГХ стало существенным компонентом процесса постановки диагноза и классификации опухоли. Кроме того, с помощью ИГХ стало возможным прогнозировать дальнейшее биологическое поведение заболевания, определять возможности таргетной терапии, резистентность и чувствительность опухолевых клеток к химиотерапии.
Иммуногистохимическое исследование является очень важной частью верификации диагноза. Особенно актуальным имуногистохимическое исследование является для диагностики лимфом (в подавляющем большинстве случаев диагноз без ИГХ поставить невозможно), рака молочной железы, простаты, опухолей мягких тканей, для определения гистологической принадлежности недифференцированных опухолей и метастазов из невыясненного первичного очага.
 ИГХ исследование выполняется после гистологического исследования окрашенных гематоксилином и эозином препаратов. После оценки изменений патолог интерпретирует полученную информацию и только на этом этапе назначает панель анител, применимую специально для опухолей данного гистологического типа. Обычно для постановки диагноза используется несколько антител, так как важными являются не только положительные, но и отрицательные окраски. Иногда проводится один или несколько дополнительных этапов исследования. В результате гистологическое строение опухоли сопоставляется с совокупностью полученных результатов и на основании этого выставляется окончательный диагноз.
ИГХ исследование выполняется после гистологического исследования окрашенных гематоксилином и эозином препаратов. После оценки изменений патолог интерпретирует полученную информацию и только на этом этапе назначает панель анител, применимую специально для опухолей данного гистологического типа. Обычно для постановки диагноза используется несколько антител, так как важными являются не только положительные, но и отрицательные окраски. Иногда проводится один или несколько дополнительных этапов исследования. В результате гистологическое строение опухоли сопоставляется с совокупностью полученных результатов и на основании этого выставляется окончательный диагноз.
Длительность проведения ИГХ исследования зависит от метода (вручную либо с помощью специальных аппаратов для автоматической окраски) и составляет от суток до нескольких дней, а иногда и недель. Кроме того, необходимо учитывать время, затрачиваемое патологом на интерпретацию полученных данных.
Еще одним очень важным нюансом является стандартизация и воспроизводимость результатов ИГХ исследований. Так как ИГХ – это сложный и многоступенчачтый процесс, то существует огромное количество факторов, влияющих на результат. Техническая ошибка, низкое качество реагентов, нарушение фиксации проводки и/или фиксации биологического материала, неправильно выбранная панель антител, неверная интерпретация материала — всё это может привести к неверным или неполным результатам исследования. Именно поэтому желательно проведение важных исследований в хорошо оснащённых (автоматизация снижает влияние «человеческого фактора”) лабораториях с опытным персоналом.
Исследование клеток ткани, которое проводится с помощью специальных реактивов.
Синонимы русские
ИГХ, иммуногистохимия, иммуногистохимический анализ.
Синонимы английские
Immunohistochemistry, IHС, immunohistochemical analysis.
Метод исследования
Иммуногистохимический метод.
Какой биоматериал можно использовать для исследования?
Образец ткани / образец ткани в парафиновом блоке.
Как правильно подготовиться к исследованию?
- Специальной подготовки не требуется.
Общая информация об исследовании
Иммуногистохимическое исследование клинического материала проводится в целях выявления в нем искомых веществ. Готовые гистологические препараты обрабатываются специальными реактивами, содержащими меченые специфические антитела к выявляемому веществу, которое в данной ситуации служит антигеном. Если искомое вещество находится в исследуемом материале, то антитело связывается с его определенными участками. В результате этого между ними образуется комплекс и происходит окрашивание ткани.
Данный метод используется в диагностике различных патологических состояний, особенно велика его роль в области онкологии. Иммуногистохимическое (ИГХ) исследование помогает не только диагностировать опухоль, определить ее нозологический вариант, выявить первичный опухолевый очаг и обнаружить раковое перерождение клеток, но также спрогнозировать варианты течения заболевания и успешность лечения. К факторам, влияющим на прогноз, относятся рецепторы к эстрогенам и к прогестерону, Ki-67 (маркер активности опухоли), her-2 neu (эпидермальный фактор роста, определяет чувствительность опухоли к химиопрепарату трастузумабу/герцептину), VEGF (сосудистый фактор роста), Bcl-2, р53 и др. В отличие от иммуногистохимического анализа, их невозможно определить при обычном гистологическом исследовании.
Также этот метод нашел применение в диагностике системных заболеваний соединительной ткани и болезней почек, позволяет выявлять бактерии и вирусы в изучаемых тканях, например вирус Эпштейна — Барр, папиллома-вирус, Helicobacter Pylori (у больных хроническим гастритом), микобактерии при диагностике туберкулеза и др.
На основе ИГХ-анализа врач получает заключение с положительными и отрицательными маркерами, и это помогает подтвердить или опровергнуть гипотезу других клинико-лабораторных исследований.
Рак шейки матки относится к наиболее распространенным видам рака у женщин. Эпидемиологические и лабораторные данные подтверждают роль человеческого папиллома-вируса (ВПЧ, HPV) в качестве запускающего агента для подавляющего большинства предраковых и злокачественных поражений эпителия слизистой оболочки шейки матки. При этом ДНК ВПЧ могут быть обнаружены в 95-100% всех случаев.
Вирус папилломы человека представляет собой небольшие циркулярные двухцепочечные вирусы дезоксирибонуклеиновой кислоты (ДНК), принадлежащие к семейству Papillomaviridae. Известно более 130 типов ВПЧ. Они классифицируются по степени риска, основанного на их связи с цервикальной карциномой. ВПЧ 16 и 18 являются наиболее часто встречающимися типами высокого риска. Внедряясь в эпителиальные клетки, вирус вызывает в них дефекты генов, тем самым способствуя развитию опухоли. При помощи ИХГ легко обнаружить в клетках, пораженных HPV, экспрессию белков p16 и p18, и их позитивность сильно коррелирует с позитивностью HPV. Это помогает различить неопухолевую дисплазию (как результат воспаления) и опухолевую (вызванную вирусом папилломы и способную переродиться в рак), а также позволяет провести дифференциальную диагностику дисплазии умеренной и высокой степени тяжести (CIN II/III) и начальных форм рака шейки матки, выявление поражений, склонных к прогрессированию и развитию инвазивной карциномы. В дисплазиях умеренной и высокой степени (в 80-100% случаев CIN II и практически во всех случаях CIN III) и инвазивном раке шейки матки определяется усиленная экспрессия белка p16, и она усиливается по мере нарастания тяжести поражения.
У женщин с плоскоклеточными интраэпителиальными поражениями низкой степени тяжести очаговая и диффузная экспрессия свидетельствует о прогрессировании заболевания. Отсутствие или очаговая экспрессия p16 в поражениях высокой степени может служить дополнительным признаком благоприятного течения патологического процесса.
Применяется иммуногистохимическое исследование и при дифференциальной диагностике целиакии.
Целиакия – это системное заболевание, обусловленное генетической непереносимостью глютена или соответствующих проламинов, которые содержатся в семенах злаков. Характеризуется данная патология повреждением слизистой оболочки тонкой кишки (развитием атрофической энтеропатии), появлением в сыворотке крови специфических антител и широким спектром глютензависимых клинических проявлений. Заболевание встречается в два раза чаще среди женщин, чем среди мужчин, может впервые проявиться как в детстве, так и у взрослых. Целиакия может протекать с ярко выраженной или со стертой клинической картиной, а также без гастроэнтерологической симптоматики. Чаще всего встречается стертый вариант течения заболевания, поэтому диагностика глютеновой энтеропатии (ГЭ) затруднена.
На первичном лабораторном этапе проводится серологическое исследование, определяющее в крови специфические биомаркеры. Лицам с положительными результатами показана эндоскопия тонкой кишки с биопсией и последующим гистологическим и ИГХ анализом взятого материала.
Известно, что целиакия сопровождается повышением числа лимфоцитов внутри эпителиальных клеток тонкой кишки. При этом отличительной особенностью является то, что большинство интраэпитиальных лимфоцитов (ИЭЛ) несут на своей поверхности специфический Т-клеточный рецептор (CD3 γ и CD3δ-положительные клетки). Чем активнее протекает заболевание, тем больше ИЭЛ. Эта особенность используется при проведении иммуногистохимического исследования, позволяющего определить преобладающий тип лимфоцитов. Особенно важен этот анализ, когда существует расхождение между данными серологического исследования и гистологической оценкой на стандартных участках.
Для чего используется исследование?
- Для определения вида и подвида опухоли, степени ее злокачественности и распространенности онкологического процесса;
- для дифференциальной диагностики пролиферативных заболеваний;
- для определения этиологического фактора, вызвавшего изменения в клетках;
- для подбора эффективной терапии;
- для оценки пролиферативной активности клеток опухоли;
- для оценки эффективности лечения;
- для диагностики рецепторного статуса при онкологическом заболевании (например, раке молочной железы, предстательной железы);
- для определения первичного очага опухоли;
- для выявления злокачественного потенциала пораженных клеток;
- для первичного отбора пациентов для диспансерного учета и дальнейшего обследования;
Когда назначается исследование?
- При дифференциальной диагностике дисплазии (высокой и умеренной степени) и начальной стадии рака шейки матки;
- при раке молочной железы, желудка, предстательной железы в целях определения чувствительности к различным видам терапии;
- при определении степени злокачественности и оценки прогноза заболевания;
- при оценке эффективности терапии;
- при поиске источника метастазов;
- при диагностике гастроинтестинальных стромальных опухолей (GIST) с помощью расширенной панели антител, включающей DOG1;
- при диагностике нейроэндокринных опухолей;
- при дифференциальной диагностике целиакии, сопровождающейся неясной гистологической картиной;
- при расхождении результатов серологического исследования и гистологической оценки.
Что означают результаты?
Референсные значения
Диапазон значений индивидуален для каждого заболевания, зависит от используемых антител.
Расшифровка результатов исследования содержит информацию для лечащего врача и не является диагнозом.
Проводится морфологическая оценка препарата (опухоли классифицируются согласно ВОЗ), дается описательный ответ с указанием оценки экспрессии антитела. ИХГ всегда следует использовать в качестве дополнения к морфологическому исследованию, результаты не следует интерпретировать изолированно.
Что может влиять на результат?
При некоторых заболеваниях есть факторы, которые могут влиять на результат. Так, при диагностике целиакии назначение безглютеновой диеты до исследования может приводить к получению ложноотрицательного результата.
Также рекомендуется
- Цитологическое исследование пунктатов, соскобов других органов и тканей
- Гистологическое исследование биоптатов органов и тканей (за исключением печени, почек, предстательной железы, лимфатических узлов)
- Консультация биопсийного (операционного) материала любой сложности (по готовому материалу)
- Дополнительное изготовление микропрепаратов
- Гистологическое исследование биопсийного материала
- Антитела к тканевой трансглутаминазе, IgG
- Антитела к тканевой трансглутаминазе, IgA
- Целиакия. Скрининг при селективном дефиците IgA
- Антитела к глиадину, IgA
- Антитела к глиадину, IgG
- Антитела к эндомизию, IgA
- Антиретикулиновые антитела (APA)
- Целиакия. Скрининг (взрослые и дети старше 2 лет)
- Диагностика целиакии (типирование HLA DQ2/DQ8)
- Цитологическое исследование мазков (соскобов) с поверхности шейки матки (наружного маточного зева) и цервикального канала на атипию
- Раковый эмбриональный антиген (РЭА)
- Иммуноцитохимическое исследование соскобов шейки матки с определением белка р16
- Скрининг рака шейки матки (цитологическое исследование клинического материала методом жидкостной цитологии c ВПЧ-тестом (Roche Cobas4800)
- Жидкостная цитология. Исследование соскоба шейки матки и цервикального канала (окрашивание по Папаниколау)
Кто назначает исследование?
Онколог, гинеколог, гастроэнтеролог, терапевт, педиатр.
Литература
- Далленбах-Хеллвег Г., Трунк М.Й., Кнебель Дебериц М. Традиционные и новые молекулярные методы для ранней детекции рака шейки матки//Архив патологии 2004 — №5 — с. 35-39.
- Brunner M, Koperek O, Wrba F, Erovic BM, Heiduschka G, Schoppper C, et al. HPV infection and p16 expression in carcinomas of the minor salivary glands. Eur Arch Otorhinolaryngol. 2012;269:2265–9.
- Galgano MT, Castle PE, Atkins KA, Brix WK, Nassau SR, Stoler MH. Using biomarkers as objective standards in the diagnosis of cervical biopsies. Am J Surg Pathol. 2010;34:1077–87.
- McCluggage WG. Immunohistochemistry as a diagnostic aid in cervical pathology. Pathology. 2007;39(1):97–111.


