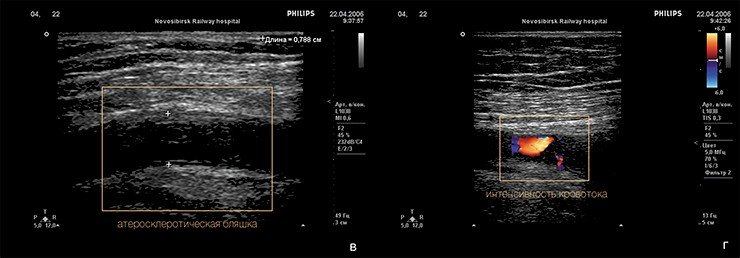
Атеросклеротические бляшки
Атеросклероз – заболевание, при котором на стенках артерий откладываются атеросклеротические бляшки (они состоят из холестерола и других соединений жиров, кальция, волокон соединительной ткани), что вызывает сужение просвета пораженных сосудов.
Атеросклероз распространен во всем мире и является ведущей причиной смертности во многих странах.
По артериальным сосудам кровь, обогащенная кислородом и необходимыми веществами, транспортируется к органам и тканям. В норме сосуды обладают эластичной и упругой стенкой, что необходимо для притока достаточного количества крови.
При сужении пораженных атеросклерозом сосудов приток крови к органам и тканям, получающим питание из данных артерий, снижается. Когда объем приносимой по артериям крови уменьшается до определенных критических значений, возникают проявления заболевания. Так, при поражении артерий сердца это могут быть боли в сердце, одышка, головокружение, учащенное сердцебиение. Кроме того, бляшки могут отрываться от стенки сосуда, вызывая его закупорку в более узком месте. Это может приводить к инфаркту, инсульту.
Причины появления атеросклеротических бляшек многообразны и не полностью изучены. К ним относится повреждение внутренней стенки артерий (может происходить при повышенном артериальном давлении, сахарном диабете), дислипидемия (нарушение соотношения различных видов жиров в организме), наследственная предрасположенность.
Лечение атеросклероза может быть хирургическим и консервативным. Хирургическое направлено на удаление атеросклеротических бляшек и восстановление просвета пораженного сосуда. Важную роль и в лечении, и в профилактике заболевания играет изменение образа жизни: соблюдение диеты, физические упражнения, отказ от вредных привычек (например, курения).
Синонимы русские
Артериосклероз.
Синонимы английские
Atherosclerosis, arteriosclerosis.
Симптомы
На ранних стадиях заболевания симптомы атеросклероза могут отсутствовать. Наиболее часто поражаются артерии сердца, головного мозга, нижних или верхних конечностей, почек. При этом возникают различные симптомы.
Поражение артерий сердца (коронарных артерий) может сопровождаться:
- болью сжимающего характера, дискомфортом за грудиной;
- болью в левой руке, плече, нижней челюсти или спине преимущественно слева;
- одышкой;
- тошнотой;
- учащенным сердцебиением;
- головокружением.
Симптомы поражения артерий головного мозга:
- внезапное онемение, слабость в руке, ноге, в мышцах лица преимущественно на одной стороне тела;
- внезапное нарушение речи (отсутствие способности к произнесению звуков, слов);
- нарушение понимания обращенной речи;
- резкое нарушение зрения на один или оба глаза;
- внезапное головокружение, нарушение походки, потеря координации;
- резкая головная боль.
Данные симптомы могут свидетельствовать о нарушении мозгового кровообращения (инсульте) или транзиторной ишемической атаке (при ней они проходят в течение 24 часов).
При поражении сосудов ног или рук:
- онемение рук или ног;
- чувство холода в руках или ногах;
- хромота, снижение силы мышц;
- боли в пораженных конечностях.
При поражении сосудов почек повышается артериальное давление. При этом могут возникать следующие симптомы:
- головная боль;
- тошнота;
- головокружение;
- потемнение в глазах.
Общая информация о заболевании
Атеросклероз – заболевание, при котором на стенках артерий откладываются атеросклеротические бляшки (они состоят из холестерола и других соединений жиров, кальция, волокон соединительной ткани), что вызывает сужение просвета пораженных сосудов.
Атеросклероз распространен во всем мире и является ведущей причиной смертности во многих странах.
Холестерол – жироподобное вещество, жизненно необходимое организму. Он входит в состав клеток, требуется для синтеза гормонов. Часть холестерола образуется самим организмом, часть поступает с пищей при употреблении животных жиров.
Холестерол переносится к тканям и клеткам с помощью специальных соединений с белком – липопротеинов низкой и очень низкой плотности. Их еще называют «вредным холестеролом», так как именно они обладают способностью образовывать атеросклеротические бляшки.
Липопротеины высокой плотности («полезный холестерол») – соединения, которые забирают избыток холестерола из клеток и переносят его в печень, где он перерабатывается.
При высоком уровне холестерола в крови липопротеины высокой плотности не успевают «убирать» избыток холестерола из клеток и тканей, что приводит к отложению холестерола на стенках артерий. Таким образом, увеличение количества липопротеинов низкой и очень низкой плотности, а также снижение количества липопротеинов высокой плотности способствует развитию атеросклероза.
Точные причины повышения уровня холестерола в крови неизвестны. По мнению исследователей, он в большей степени зависит от способности организма производить холестерол и перерабатывать его излишки, так как 80 % холестерола образуется в организме, а не поступает с пищей. Несмотря на это определенные факторы способствуют повышению уровня холестерола в крови:
- характер питания – употребление жирной пищи с большим содержанием холестерола, трансжирных кислот (содержатся в твердых жирах, полученных из жидких жиров растительного происхождения), увеличивает уровень холестерола и повышает риск сердечно-сосудистых заболеваний;
- масса тела – при лишнем весе уровень холестерола имеет тенденцию к повышению;
- низкая двигательная активность;
- наследственная предрасположенность – способность организма к синтезу и переработке холестерола может передаваться по наследству;
- возраст – с возрастом уровень холестерола повышается, причем у женщин до периода менопаузы он ниже, чем у мужчин того же возраста, а период менопаузы уровень холестерола у них возрастает.
Заболевание развивается медленно. Первые изменения на стенках артерий могут возникать даже в детстве.
Атеросклеротические бляшки формируются в местах повреждения внутренней стенки артерий. В норме внутренняя поверхность артерий покрыта тонкой оболочкой – эндотелием. Одной из функций эндотелия является предотвращение адгезии (прилипания) элементов крови к стенкам неповрежденных сосудов. По различным причинам эндотелий на определенном участке повреждается. Это может быть обусловлено:
- высоким артериальным давлением;
- высоким уровнем холестерола в крови;
- сахарным диабетом;
- курением (вещества, поступающие в кровь при курении, оказывают токсическое действие на эндотелий).
В области повреждения возникает очаг воспаления. Развивается специфическая реакция, направленная на восстановление целостности эндотелия, что вызывает присоединение тромбоцитов и других клеток к очагу повреждения эндотелия. Липопротеины низкой и очень низкой плотности также задерживаются в очаге поврежденного эндотелия. Так постепенно образуется атеросклеротическая бляшка. Со временем в состав данного участка включаются волокна соединительной ткани, кальций и другие компоненты.
Атеросклеротические бляшки бывают стабильные и нестабильные. Стабильные растут медленно и не разрушаются. Нестабильные могут распадаться. Фрагменты распавшейся бляшки, застревая в сосудах, способны вызывать нарушения кровообращения. Закупорка сосудов в головном мозге может приводить к инсульту (острому нарушению мозгового кровообращения), нарушение кровообращения в сердце – к инфаркту.
С течением времени заболевание медленно прогрессирует. Изменение образа жизни, своевременное лечение, контроль уровня холестерола, сахара в крови, артериального давления способны остановить его развитие.
Кто в группе риска?
- Лица старшего возраста;
- имеющие близких родственников с заболеваниями сердца;
- пациенты с повышенным артериальным давлением;
- больные сахарным диабетом;
- пациенты с повышенным уровнем холестерола в крови;
- лица с повышенной массой тела;
- курильщики;
- ведущие малоподвижный образ жизни.
Диагностика
Важную роль в диагностике атеросклероза играют лабораторные исследования. Назначается комплекс анализов, которые позволяют выявить отклонения в обмене жиров, риск развития атеросклероза по нескольким показателям (липидный профиль). При этом понятие нормы для уровня холестерола и его фракций не всегда применимо – необходимо учитывать особенности конкретного пациента (возраст, пол, наличие сопутствующих заболеваний и другие показатели). Также проводятся обследования, в ходе которых оценивается степень сужения артерий, выраженность нарушения кровотока.
Основные лабораторные анализы:
- Холестерол – липопротеины низкой плотности (ЛПНП). ЛПНП переносят холестерол к тканям. При определенных условиях они способствуют формированию атеросклеротических бляшек. Уровень ЛПНП при атеросклерозе повышен.
- Холестерол – липопротеины высокой плотности (ЛПВП). Липопротеины высокой плотности осуществляют доставку холестерола из клеток и тканей в печень. Являются «полезными» липопротеинами, которые снижают риск развития атеросклероза. Чем выше содержание ЛПВП, тем ниже опасность атеросклероза.
- Холестерол общий. Характеризует общее количество всех видов липопротеинов, которые циркулируют в крови. Большая его часть образуется в печени, и примерно 10-20 % поступает с пищей. Основные превращения холестерола проходят в печени, поэтому уровень холестерола также является одним из показателей ее функции. При атеросклерозе он повышен. Однако главное не общий уровень холестерола, а соотношение отдельных его фракций. Так, содержание ЛПНП может быть сильно повышено при нормальном или незначительно превышающем норму общем холестероле.
- Триглицериды – соединения, которые образуются в кишечнике из жиров. Они используются в качестве источника энергии, и их избыток откладывается в жировой ткани. Данный анализ используется для оценки обмена жиров: при атеросклерозе уровень триглицеридов повышен.
- Липопротеин (a). Липопротеин (а) представляет собой комплекс липопротеина низкой
плотности и белка аполипопротеина (а). Аполипопротеин (а) способствует образованию атеросклеротических бляшек, поэтому повышение его уровня свидетельствует о высоком риске развития раннего атеросклероза. - Аполипопротеин A1. Является компонентом системы липопротеинов высокой плотности и способствует выведению лишнего холестерола из тканей. Анализ проводится для оценки риска атеросклероза. При дефиците аполипопротеина А1 риск развития атеросклероза повышен.
- Аполипопротеин B. Основной компонент всех липопротеинов, кроме липопротеинов высокой плотности. Увеличение данного показателя свидетельствует о повышенном риске атеросклероза.
Дополнительные лабораторные анализы:
- Глюкоза в плазме. Повышенный уровень сахара в крови (при сахарном диабете) способствует развитию атеросклероза, так как при этом возникают изменения в стенках артерий и развиваются нарушения в обмене веществ.
- Тропонин I (количественно). Белок, участвующий в сокращении сердечной мышцы. При повреждении клеток сердца (например, при инфаркте миокарда) его уровень в крови возрастает. Используется при диагностике инфаркта миокарда.
Другие исследования:
- Ультразвуковая доплерография. Метод основан на действии ультразвука. Позволяет оценить степень сужения артерий, выраженность нарушения кровотока.
- Ангиография. В просвет сосудов исследуемого органа (например, сердца) вставляется катетер. По нему вводится рентген-контрастное вещество. Под воздействием рентгеновских лучей на экране получают изображение сосудов исследуемого органа. Во время ангиографии возможно расширение сосуда путем установки стента и проведение других манипуляций.
- Электрокардиограмма. Регистрирует биопотенциалы, которые образуются при работе сердца. Относится к высокоинформативным и доступным методам обследования.
- Тесты с нагрузкой (стресс-тесты). Основаны на изучении деятельности сердца в условиях физической нагрузки. При выполнении упражнений регистрируется частота сердечных сокращений, артериальное давление, частота дыхания и другие показатели.
Лечение
Лечение атеросклероза может быть консервативным и хирургическим. В некоторых случаях достаточно коррекции образа жизни: правильное питание, отказ от вредных привычек, регулярные физические нагрузки.
Также назначаются препараты с различным механизмом действия:
- снижающие уровень холестерола в крови, что препятствует росту атеросклеротических бляшек (некоторые из них способствуют уменьшению в размерах уже существующих бляшек);
- улучшающие реологические свойства (текучесть) крови, препятствующие образованию тромбов;
- для снижения артериального давления;
- другие лекарственные препараты (например, для снижения уровня сахара в крови при диабете).
В острых ситуациях (при инфаркте) может быть проведена тромболитическая терапия. Для этого вводятся сильнодействующие препараты, которые растворяют тромб, что позволяет снизить объем повреждения пораженного органа.
В отдельных случаях требуется оперативное лечение, которое направлено на восстановление ширины просвета сосуда, возобновление нормального кровотока. К таким методам относится:
- Ангиопластика. В просвет суженного сосуда под контролем рентгена вводится специальный катетер, на конце которого раздувается баллон, расширяющий данный сосуд. Для профилактики повторного сужения в просвет сосуда вводится стент (специальная сетчатая трубочка), поддерживающий необходимую ширину просвета.
- Эндартерэктомия. Удаление атеросклеротической бляшки через небольшой разрез из просвета сосуда.
- Формирование сосудистых анастомозов (сообщений-шунтов между сосудами в обход пораженного сосуда). Суть операции состоит в создании кровотока в обход пораженного атеросклерозом участка артерии.
Профилактика
- Правильное питание (снижение количества насыщенных жиров и, напротив, повышение доли ненасыщенных жиров – рыбы типа лосося, растительных масел, – достаточное употребление фруктов и овощей)
- отказ от курения, алкоголя;
- регулярные занятия спортом;
- поддержание нормальной массы тела;
- контроль уровня холестерола, сахара в крови;
- контроль артериального давления.
Рекомендуемые анализы
- Холестерол – липопротеины низкой плотности (ЛПНП)
- Холестерол – липопротеины высокой плотности (ЛПВП)
- Холестерол общий
- Триглицериды
- Липопротеин (a)
- Аполипопротеин A1
- Аполипопротеин B
- Глюкоза в плазме
- Тропонин I (количественно)
Литература
![]() : 17 Июн 2007 , Нефть: герои не нашего времени , том 15, №3
: 17 Июн 2007 , Нефть: герои не нашего времени , том 15, №3
Сердечно-сосудистые заболевания справедливо называют эпидемией XX века: за последние десятилетия именно они стали главной причиной повышения уровня смертности в индустриально развитых странах, в том числе и в России, где от них ежегодно умирало около 1 млн 200 тыс. человек. К сожалению, в начале нового века ситуация практически не изменилась: и в наши дни сердечно-сосудистая «эпидемия» продолжает собирать обильный урожай
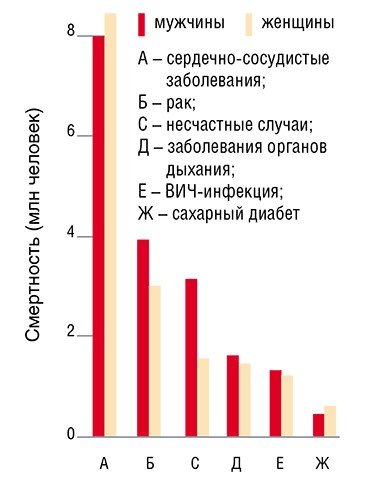 Сегодня в России смертность от сердечно-сосудистых заболеваний (ССЗ) в 2—4 раза выше, чем в западноевропейских странах, США, Канаде, Австралии, и пока, увы, наблюдается тенденция к ее дальнейшему росту. Во многих же экономически развитых странах в последние 30 лет, напротив, отмечается снижение смертности от ССЗ. Этот феномен, в первую очередь, связан с изменением образа жизни человека: отказом от курения, переходом к здоровому питанию и более высокой физической активности.
Сегодня в России смертность от сердечно-сосудистых заболеваний (ССЗ) в 2—4 раза выше, чем в западноевропейских странах, США, Канаде, Австралии, и пока, увы, наблюдается тенденция к ее дальнейшему росту. Во многих же экономически развитых странах в последние 30 лет, напротив, отмечается снижение смертности от ССЗ. Этот феномен, в первую очередь, связан с изменением образа жизни человека: отказом от курения, переходом к здоровому питанию и более высокой физической активности.
К группе ССЗ обычно относят ишемическую болезнь сердца, инсульт и поражение периферических артерий, поскольку у них общие факторы риска, хотя значимость последних может и различаться. Стоит отметить, что ведущая роль в развитии перечисленных заболеваний отводится атеросклерозу — хроническому заболеванию, при котором возникают изменения стенок кровеносных сосудов и нарушение их функций, в результате чего к тканям и органам поступает недостаточное количество кислорода (ишемия). В чем же причина этого грозного заболевания и можно ли бороться с беспощадным «тихим убийцей»?
Содержание
Желтые, белые и ранимые
Морфологическим «носителем» атеросклероза являются так называемые атеросклеротические бляшки: плотные образования круглой или овальной формы, белого или желтовато-белого цвета, которые, возвышаясь над поверхностью внутренней оболочки сосудов, суживают их просвет. Наиболее часто фиброзные бляшки обнаруживаются в брюшной аорте и в отходящих от нее ветвях, а также в артериях сердца, мозга, почек, нижних конечностей, сонных артериях и др.
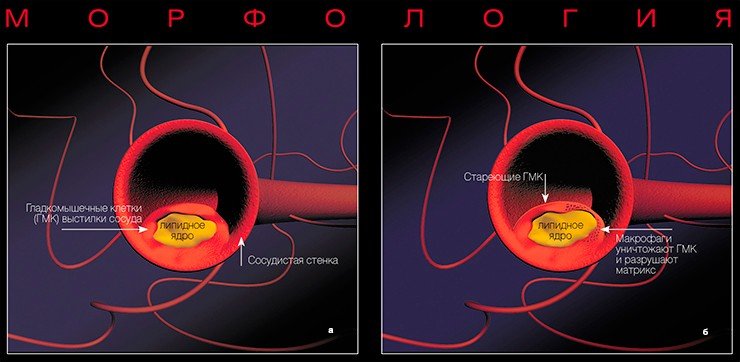
Термин «атеросклероз» был предложен немецким патологом Ф. Маршаном в 1904 г. для определения заболевания, при котором склероз артерий обусловлен нарушением обмена липидов (жиров) и белков. Слово АТЕРОСКЛЕРОЗ составлено из греческих корней «атер» (кашица) и «склерозис» (затвердение). Эти столь полярные по смыслу слова очень точно отражают характерные для этой болезни патологические процессы: накопление мягких отложений, разрастание соединительной ткани и кальциноз, в результате чего артерии становятся уплотненными и жесткими
На ранних этапах бляшка представляет собой тонкую соединительнотканную капсулу, в которой содержится много липидов. Это так называемые желтые, или ранимые, бляшки. Последнее название очень точно, поскольку тонкая оболочка этих бляшек может быть повреждена в результате действия как гемодинамических факторов (перепадов давления в сосуде), так и особых белков, вырабатывающихся клетками иммунной системы, которые находятся вблизи оболочки капсулы.
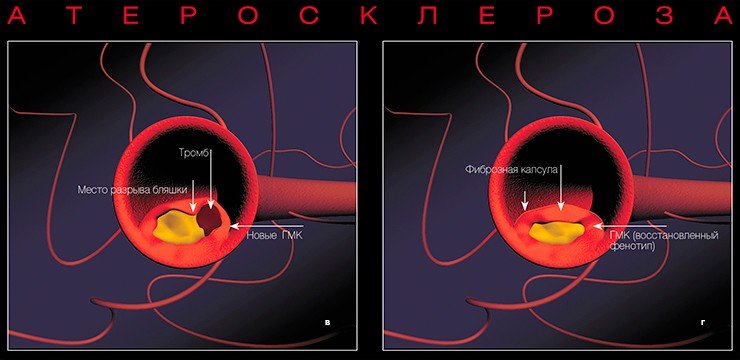
При разрыве капсулы освободившиеся жировые субстанции вступают в контакт с тромбоцитами, клетками крови, что приводит к немедленному формированию тромба. Кроме того, биологически активные субстанции, выделяемые тромбоцитами, могут вызвать спазм коронарной артерии. Вследствие чего развивается острый коронарный синдром — нестабильная стенокардия или инфаркт миокарда, в некоторых случаях вызывающий внезапную смерть.
В результате некроза (омертвения) глубоких слоев стенки сосуда может формироваться аневризма, т. е. выпячивание стенки. Нередко кровь отслаивает внутреннюю выстилку сосуда от среднего слоя, и тогда возникают так называемые расслаивающие аневризмы. Подобные осложнения чреваты риском разрыва или самой аневризмы, или стенки сосуда.
При разрыве атеросклеротической бляшки биологически активные субстанции, выделяемые тромбоцитами, могут привести к спазму коронарной артерии — и тогда развивается нестабильная стенокардия (мелкоочаговый инфаркт миокарда при пристеночном тромбозе коронарной артерии) или крупноочаговый инфаркт миокарда. Иногда вследствие омертвления глубоких слоев стенки сосуда формируется аневризма (выпячивание), что может приводить к разрыву стенки. Все эти процессы могут вызвать внезапную смерть
На поздних стадиях развития фиброзные бляшки представляют собой плотные образования с прочной соединительнотканной капсулой и относительно низким содержанием липидов — так называемые белые бляшки. Вызывая выраженное (на 75 % и более) сужение коронарной артерии, они, таким образом, являются морфологическим субстратом стабильной стенокардии напряжения. Разрыв плотной фиброзной капсулы белой бляшки также не исключен, однако в случае с желтой бляшкой такая возможность более очевидна.
Завершающей стадией атеросклероза является атерокальциноз, когда происходит обызвествление — отложение солей кальция в фиброзные бляшки.
Таким образом, осложнения атеросклероза могут быть как острыми, так и хроническими. Выпячиваясь в просвет кровеносного сосуда, атеросклеротическая бляшка способствует сужению (стенозу) просвета (стенозирующий атеросклероз). Поскольку формирование бляшки процесс достаточно медленный, в зоне кровоснабжения этого сосуда возникает хроническая ишемия. Хроническая сосудистая недостаточность сопровождается кислородным голоданием, дистрофическими и атрофическими изменениями в органе, а также разрастанием соединительной ткани.
Острые осложнения атеросклероза обусловлены спазмом сосудов, возникновением тромбов и других закупоривающих тел — эмболов. Закупорка сосудов, сопровождающаяся острой сосудистой недостаточностью (острая ишемия), ведет к развитию инфарктов органов, таких как инфаркт миокарда, гангрена конечности и др. Иногда может наблюдаться разрыв аневризмы сосуда со смертельным исходом.
Виноват холестерин?
В настоящее время популярна теория, в соответствии с которой атеросклероз рассматривается как реакция на повреждение сосудистой стенки, причем в качестве наиболее важного повреждающего фактора выступает холестерин — жирорастворимое вещество, относящееся к классу стероидов, которое присутствует во всех тканях животного организма.
Еще в конце прошлого столетия было обнаружено, что в зонах атеросклеротического поражения стенки сосуда концентрация холестерина возрастает вдвое по сравнению с нормой. Экспериментально удалось показать, что добавление этого вещества в кормовой рацион кроликов приводит к образованию повреждений аорты, напоминающих атеросклеротические повреждения сосудов человека.
Так была сформулирована инфильтрационная теория происхождения атеросклероза. Суть ее сводится к тому, что основным моментом в этом заболевании является первичная холестериновая инфильтрация внутренней оболочки артерий — липоидоз — с последующим развитием соединительной ткани (склероза).
Холестерин в крови циркулируют в виде белково-липидных комплексов, куда входят триглицериды, фосфолипиды и белки. Два основных холестерин-переносящих класса — так называемые липопротеиды низкой плотности (ЛПНП) и липопротеиды высокой плотности (ЛПВП) — выполняют различные функции. Первые взаимодействуют со специфическими рецепторами клеточных мембран, в результате чего происходит транспортировка холестерина в клетки периферических тканей. Вторые, напротив, при контакте с клеточными мембранами способны «забирать» у них избыточный холестерин и транспортировать его обратно в печень, где холестерин разрушается с образованием желчных кислот.
У больных атеросклерозом концентрация и время пребывания липопротеидов низкой плотности в плазме крови нарастают, при этом некоторые из этих липопротеидов подвергаются перекисному окислению, становясь особенно опасными. Последние обладают прямым повреждающим действием, вызывая разрушение эндотелия стенки сосудов, и взаимодействуют с факторами свертываемости крови, способствуя тромбообразованию.
Этим данным соответствуют результаты многочисленных эпидемиологических исследований, согласно которым уровень холестерина, содержащегося в липопротеидах высокой плотности, находится в обратной зависимости от наличия ишемической болезни сердца, что может быть использовано для выявления риска ее развития.
Благодаря тому значению, которое в наше время придается ранимым (желтым) бляшкам в развитии острого коронарного синдрома, предупреждение их образования может быть рассмотрено в качестве основной цели лечения при первичной, и особенно при вторичной профилактике ишемической болезни сердца. Терапия статинами — препаратами, снижающими уровень холестерина в крови, способна стабилизировать атеросклеротическую бляшку, то есть укрепить ее капсулу и уменьшить вероятность разрыва.
Опыт применения подобных препаратов показывает, что во многих случаях благоприятный эффект от лечения пациентов наблюдается уже в первые недели, когда еще не может быть и речи об обратном развитии атеросклеротических поражений. Это в первую очередь связано с тем, что снижение уровня холестерина в крови ведет к улучшению функции сосудов, нормализации свертывающей системы крови и восстановлению образования оксида азота (NO), подавленного при гиперхолестеринемии. Снижение уровня холестерина в крови позволяет восстановить способность артерий к расширению под воздействием биологически активных веществ.
Две гипотезы
Предположение о том, что в развитии атеросклероза принимают участие воспаление и инфекция, было высказано еще в 1990-х гг., а в последние годы число фактических данных в подтверждение этой гипотезы неуклонно растет. Доказано, что локальное воспаление в клетках средних и больших артерий представляет собой специфическую иммунную реакцию (активацию Т-лимфоцитов), сопровождаемую неспецифическим увеличением в артериальной стенке моноцитов — одного из видов лейкоцитов, клеток крови, способных к фагоцитозу, которые выделяются при воспалительных реакциях.
С помощью электронной микроскопии между сосудистыми клетками (в местах будущих склеротических бляшек) удалось обнаружить мигрирующие в просвет сосуда и выходящие из него макрофаги — относительно крупные кровяные клетки, способные к активному захвату и перевариванию чужеродных или токсичных объектов. Накопление макрофагов — один из ранних морфологических признаков болезни. Молекулярные механизмы прилипания макрофагов к внутренней поверхности сосудов подобны тем, что наблюдаются при остром воспалении. Возможно, это и есть один из ранних молекулярных механизмов формирования бляшки.
К большому числу развивающихся атеросклеротических бляшек принадлежат образования, состоящие из макрофагов, лимфоцитов и гладкомышечных клеток, окруженных обычно фиброзной тканью. Вокруг бляшки скапливаются тромбоциты, что сопровождается повреждением сосудистых клеток. Все подобные взаимоотношения между клетками крови и сосудистым эндотелием в настоящее время интенсивно изучаются.
Клетки печени, как при воспалении, так и при атеросклерозе, усиливают синтез и секрецию в кровь особых воспалительных белков (С-реактивного белка, липопротеина, фибриногена). Клинически же синдром воспаления и склеротический процесс могут продолжаться длительное время, при этом периоды обострения чередуются с периодами ремиссии, т. е. состоят из одних и тех же функциональных реакций. Вот почему считается, что увеличенный уровень фибриногена, С-реактивного белка и скорости оседания эритроцитов являются показателями риска сердечно-сосудистых заболеваний.
Подтверждением инфекционной теории атеросклероза может служить также факт обнаружения некоторых микроорганизмов, таких как Helicobacter pylori, Chlamydia pneumoniae и др., в атеросклеротической бляшке и в крови. Развивая гипотезу об инфекционной этиологии атеросклероза, итальянские ученые предположили, что между ишемической болезнью сердца и вирусом гепатита С может существовать связь.
Сегодня признано, что ведущее место в развитии эндотелиальной дисфункции и, возможно, атеросклероза, занимает нарушение синтеза оксида азота (NO). Считается, что именно благодаря действию NO происходит расслабление сосудов в ответ на внешний стимул. (По крайней мере, использование в терапии атеросклероза L-аргинина — субстрата, из которого образуется оксид азота — приводило к улучшению сосудистой функции.) Снижение уровня NO в области атеросклеротических бляшек способствует стойкому спазму сосудов в зоне атеросклеротического поражения.
Интересно, что нарушение расслабления сосудов регистрируется не только у пациентов, уже страдающих атеросклерозом, но даже у тех, кто к нему предрасположен, а также у курильщиков.
Атеросклероз в наследство
Значение наследственных факторов в возникновении атеросклероза анализировали многие исследователи. Есть немало свидетельств того, что члены семей, принадлежащих к одной фамилии, имеют сходные негативные сдвиги жирового обмена, благодаря чему вероятность заболеть атеросклерозом у них выше, чем у тех, кто не связан между собой кровными узами. К тому же, у близких родственников обнаруживается сходство в расположении атеросклеротических поражений в коронарных или мозговых сосудах. Установлено также, что при углубленном исследовании у молодых, клинически здоровых лиц, но имеющих отягощенную наследственность, выявляются выраженная тенденция к росту уровня холестерина и некоторые другие изменения обмена, которые свидетельствуют о наличии атеросклеротических процессов.
И все же: каков механизм реализации подобных семейно-наследственных предпосылок к развитию атеросклероза? Очевидно, что наследуется тип реагирования организма на действие факторов внешней среды. А причиной, надо полагать, являются необычайно быстрые изменения условий жизни современного человека, чрезмерные нагрузки на адаптивные, в частности нервные, эндокринные и сердечно-сосудистые, системы организма, которые и приводят к нарушениям в их работе, вызывая развитие атеросклероза.
Сегодня установлена связь между частотой некоторых мутаций генов, контролирующих выработку противосклеротических воспалительных липопротеинов, а также оксида азота, и вероятностью развития у пациента атеросклероза разной локализации. В частности, у людей с рядом генных мутаций фермента эндотелиальной NO-синтазы чаще встречаются стенокардия, инфаркт миокарда и артериальная гипертония, чем у здоровых людей.
У пациентов с мутациями генов системы гемостаза крови чаще встречаются тромбозы на фоне острых осложнений атеросклероза, что делает определение и изучение генных полиморфизмов у пациентов, болеющих атеросклерозом, чрезвычайно перспективным. В частности, в Отделе новых медицинских технологий Института химической биологии и фундаментальной медицины СО РАН (Новосибирск), где проводится изучение фундаментальных аспектов атеросклероза, накоплены данные по часто встречающимся мутациям в системе генов, контролирующих тромбообразование. Обнаружено также, что повышенный риск сердечно-сосудистых заболеваний имеют люди, несущие один из аллелей (Е4) гена APOE, кодирующего белковый компонент некоторых липопротеинов плазмы. У носителей этой изоформы гена наблюдаются повышенные уровни как общего, так и входящего в ЛПНП холестерина, что хорошо соответствует имеющимся в медицинской литературе данным.
С помощью многопрофильного, в том числе и генетического, обследования (выявление мутаций в системе аполипопротеидов, в системе регуляции выработки оксида азота) сегодня можно разрабатывать индивидуальные схемы лечения для пациентов с различными проявлениями атеросклероза, для того чтобы своевременно и дифференцированно корректировать это патологическое состояние уже на самых ранних стадиях развития процесса.
Те, кто рискует
Несмотря на то что термин «атеросклероз» был предложен более ста лет назад, а самому заболеванию было посвящено немало исследований, вопрос о причинах, его вызывающих, и факторах риска до сих пор нельзя считать окончательно решенным.
В настоящее время насчитывают более 30 факторов, действие которых увеличивает риск возникновения и развития атеросклероза и его осложнений. Все перечисленные факторы могут быть условно разделены на две группы: те, которые человек не в состоянии изменить (например, возраст); и модифицируемые факторы, такие как курение.
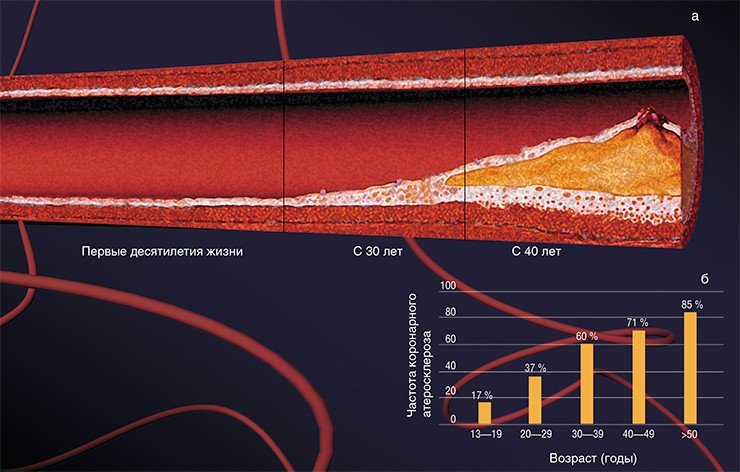
Число прожитых лет прямо отражается на частоте и тяжести заболевания атеросклерозом. И неудивительно: ведь с возрастом происходит изменение основных обменных процессов (липидного, углеводного, витаминного), иммунологической активности, работы печени и т.д., что может способствовать развитию болезни. Однако существует много данных, свидетельствующих о том, что эта болезнь может начать развиваться уже в раннем подростковом возрасте! При масштабном исследовании донорских сердец людей в возрасте 13—19 лет признаки атеросклероза были выявлены примерно у каждого шестого, а к 40 годам более чем у 70 % пациентов имелось, по крайней мере, одно атеросклеротическое поражение.
Однако очевидно, что возраст сам по себе нельзя рассматривать в качестве причины атеросклероза. Ведь, как известно, немалое число пожилых людей при тех же жизненных условиях, что и у страдающих этим недугом, не имеют каких-либо признаков заболевания. Есть также патологоанатомические данные, свидетельствующие об отсутствии атеросклеротических поражений сосудов у людей глубокого старческого возраста. Все эти исключения отрицают фатальность возрастного фактора в развитии атеросклероза.
На вероятность заболевания атеросклерозом влияет и пол человека: в возрасте до 50—60 лет уровень заболеваемости атеросклерозом у мужчин намного выше, чем у женщин. Этот факт способствовал тому, что внимание исследователей было обращено на роль половых гормонов в патогенезе атеросклеротического процесса. Удалось получить немало данных, свидетельствующих о том, что женские половые гормоны — эстрогены — задерживают развитие атеросклероза (это связано с увеличением содержания липопротеидов высокой плотности в плазме крови, которые, как говорилось выше, оказывают антисклеротическое действие). В менопаузе уровень эстрогенов у женщин снижается, что сопровождается ростом уровня холестерина, коэффициента холестерин/фосфолипиды и холестерина липопротеидов низкой плотности в сыворотке крови, а следовательно, увеличивается и риск развития атеросклероза.
Одним из самых значимых факторов риска развития атеросклероза считается ожирение. Однако здесь будет уместно привести наблюдение американских исследователей, сделанное на основании массового изучения страдающих инфарктом миокарда в США: половина больных имела избыточную массу тела, у четверти был зафиксирован пониженный вес, а ожирение — лишь у каждого четвертого. Следовательно, значение имеет не столько само ожирение, сколько нередко наблюдающееся при этом повышение уровня липидов в крови и артериального давления, а также другие неблагоприятные факторы, такие как отягощенная наследственность, переедание, малоподвижный образ жизни.
А вот артериальная гипертония однозначно влияет на развитие и прогрессирование атеросклероза, поскольку данная болезнь сопровождается многими неблагоприятными изменениями, в том числе повышением проницаемости сосудистой стенки, утолщением внутренней оболочки артерий, повышением жесткости артериальной стенки и наклонностью к спастическим сокращениям, а также тенденцией к развитию тромбозов.
Весьма существенным фактором риска атеросклероза является и сахарный диабет, поскольку обмены углеводов и липидов в определенной степени взаимосвязаны. Замечено, что и в случае атеросклероза, и в случае сахарного диабета наблюдается снижение чувствительности к инсулину периферических тканей, главным образом жировой.
И все-таки наиважнейшим фактором риска возникновения атеросклероза многие ученые считают психоэмоциональное напряжение, что было показано в экспериментах, проведенных на животных и на человеке. Сегодня можно говорить о так называемой незавершенной эмоциональной реакции, то есть о состоянии, когда психоэмоциональные конфликты не имеют финала (т. е. конкретного физического действия), что способствует накоплению выделяющихся при стрессе веществ (липопротеидов, катехоламинов и др.), которые запускают атеросклеротический процесс.
Вот поэтому люди, занимающиеся спортом или имеющие профессию, связанную с физической нагрузкой, значительно реже заболевают атеросклерозом или болезнями, связанными с его осложнениями (стенокардией, инфарктом миокарда, инсультом), даже при высоких эмоциональных нагрузках. В крови людей, ведущих активный образ жизни, повышается уровень липопротеидов высокой плотности, что является защитой от развития атеросклероза.
Таким образом, прогрессирующее распространение атеросклероза во всем мире является следствием искажения естественных потребностей человека как биологического существа, платой за неразумное пользование плодами цивилизации. Высокий темп деятельности, неправильный образ жизни, невротизация и перегрузки психики современного человека — вот факторы, способствующие эпидемиологическому росту атеросклероза и в новом веке.
Да, мы не можем, к сожалению, повернуть время вспять и вернуть молодость, также как и поменять свою наследственность. Но любой из нас в состоянии помочь себе сам, изменив свою жизнь, образ мышления; а благодаря поддержке специалиста-кардиолога — расстаться с теми медицинскими проблемами, которые уже сегодня поддаются коррекции.
: 17 Июн 2007 , Нефть: герои не нашего времени , том 15, №3
Структура атеросклеротических бляшек каротидного синуса и нарушения мозгового кровообращения
Т.С. Гулевская, В.А. Моргунов, П.Л. Ануфриев
Научный центр неврологии РАМН, Москва
При морфологическом исследовании 200 атеросклеротических бляшек каротидного синуса, полученных при каротидной эндартерэктомии, выявлены структурные компоненты и процессы, характерные для тяжелой формы атеросклероза: очаги атероматоза и отека, некроз коллаге-новых и эластических волокон, вновь образованные сосуды и кровоизлияния различной давности, липофаги и лимфоциты, участки фиброза и каль-циноза, а также истончение и изъязвление покрышки, тромбы и содержимое бляшек (атероматозные массы, кристаллы холестерина, липофаги, кальцификаты) на их поверхности. Клинико-морфологические сопоставления показали, что у больных с ишемическими нарушениями мозгового кровообращения в анамнезе имеются признаки более тяжелого атеросклероза каротидного синуса, чем у больных с асимптомным стенозом. У них чаще выявлялись «нестабильные» атеросклеротические бляшки, характеризующиеся резким преобладанием в них очагов атероматоза над участками фиброза и кальциноза, истончением и разрушением покрышки, формирование тромбов на ее поверхности. Установлено, что существенную роль в патогенезе кровоизлияний в атеросклеротическую бляшку каротидного синуса может играть сопутствующая артериальная гипертония.
Ключевые слова: атеросклероз, каротидный синус, каротидная эндартерэктомия, структура бляшек.
В последние десятилетия достигнут значительный прогресс в изучении различных форм ишемических нарушений мозгового кровообращения (ИНМК), одной из ведущих причин которых является атеросклероз магистральных артерий головы — внутренних сонных (ВСА) и позвоночных артерий, и в первую очередь атеростеноз (стенози-рующий атеросклероз) каротидного синуса (КС). Установлено, что наряду со степенью атеростеноза КС важную роль в патогенезе ИНМК в каротидной системе могут играть структурные особенности атеросклеротиче-ских бляшек, а также изменения, происходящие в них в процессе течения и прогрессирования атеросклероза и приводящие к трансформации «асимптомной» бляшки в «симптомную» или «стабильной» в «нестабильную» . При этом резко повышается риск возникновения тромбоза КС, артериоартериальной атеро- и тромболии дистальных отделов ВсА и ее ветвей, что приводит, как правило, к тяжелым ИНМК с развитием инфарктов мозга различной величины и локализации.
Одним из приоритетных направлений в изучении патогенеза ИНМК является морфологическое исследование структуры атеросклеротических бляшек КС и сопоставление ее с клиническими данными и результатами кли-нико-инструментальных исследований. Целью этих исследований и сопоставлений является выявление роли структурных компонентов бляшек в патогенезе ИНМК, а также оценка риска возникновения первичных или повторных ИНМК и решения вопроса о показаниях к каротидной эндартерэктомии (КЭ), проводимой с целью предотвращения ИНМК, операции, которая в последние годы получила широкое распространение в ряде стран, включая Российскую Федерацию . Абсолютными показаниями к КЭ являются преходящие ИНМК или перенесенный ишемический инсульт с негрубым остаточным неврологическим дефицитом при
атеростенозе КС на 70% и более . Однако необходимость проведения данной операции остается дискута-бельной при степени атеростеноза менее 70% у больных, перенесших ИНМК, а также при асимптомном стенозе КС . В связи с этим изучение структурных особенностей «симптомных» и «асимптомных» атеросклероти-ческих бляшек при разной степени стеноза КС имеет значение при уточнении показаний к КЭ.
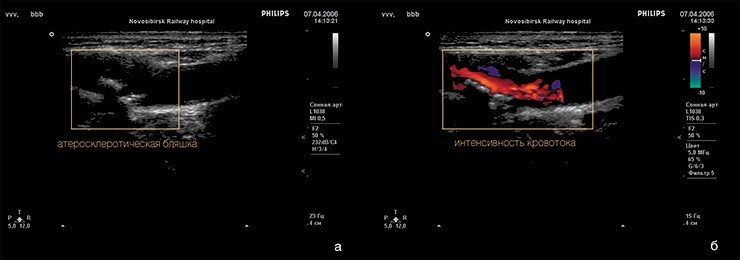
В настоящее время при решении вопроса о показаниях к КЭ широко практикуется предоперационное ультразвуковое дуплексное сканирование ВСА, с помощью которого определяются степень атеростеноза КС, эхострук-тура бляшек, а также состояние их покрышки. При этом соответствие структуры бляшек их эхохарактеристикам отмечается в 67-90% случаев . Довольно большое расхождение результатов исследований указывает на необходимость углубленного изучения структуры бляшек КС и сопоставления ее с данными дуплексного сканирования с целью выявления компонентов и процессов в бляшках, определяющих их ультразвуковые свойства, а также причин несоответствия ультразвуковых характеристик и структуры бляшек. Проведенное нами сопоставление результатов морфологического исследования бляшек, удаленных при КЭ, с данными предоперационного дуплексного сканирования ВСА показало высокую чувствительность (84%) этого метода в определении структуры бляшек .
Следует отметить, что при морфологическом исследовании атеросклеротических бляшек, удаленных при КЭ, авторы, как правило, ограничиваются изучением 3-4 компонентов и процессов в небольшом количестве бляшек . Это свидетельствует о необходимости проведения более детальных морфологических исследований атеросклеротических бляшек КС, полученных при КЭ, на материале, достаточном для достоверных выво-
дов о характере течения атеросклероза в этом отделе артериальной системы головного мозга, а также о роли тех или иных структурных компонентов и процессов бляшек в патогенезе ИНМК, что и явилось целью настоящей работы.
Материал и методы исследования_
Проведено макро- и микроскопическое исследование 200 атеросклеротических бляшек, удаленных при КЭ у 183 больных (у 17 — операция проведена на обеих ВСА), среди которых было 146 мужчин и 37 женщин в возрасте от 45 лет до 81 года; средний возраст больных — 61 год. КЭ выполнялась в отделении сосудистой хирургии НИИ хирургии им. А.В. Вишневского РАМН и в ангионейро-хирургическом отделении НЦ неврологии РАМН. Атеростеноз у всех больных был гемодинамически значимым, бляшки суживали просвет КС у большинства из них (84% больных) на 70% и более.
Из 200 бляшек КС 83 удалено у 79 больных с ИНМК в анамнезе, 50 (63%) из которых перенесли ишемический инсульт с негрубым остаточным неврологическим дефицитом, 29 (37%) — преходящие ИНМК в бассейне ветвей оперированной ВСА. У 4 больных выполнена двусторонняя КЭ по поводу преходящих ИНМК. 117 бляшек удалено у 104 больных с асимптомным стенозом КС, при этом 13 из них произведена двусторонняя КЭ. У 58 (73%) больных с ИНМК и у 69 (66%) больных с асимптомным атеростенозом КС диагностирована также артериальная гипертония.
Проведено сопоставление данных морфологического исследования атеросклеротических бляшек, удаленных у больных с ИНМК («симптомные» бляшки) и при асимп-томном стенозе КС («асимптомные» бляшки). Сопоставление структуры «симптомных» и «асимптом-ных» бляшек проводилось с учетом степени стеноза КС, которая определялась в предоперационном периоде с помощью ультразвукового дуплексного сканирования. В зависимости от степени выраженности атеростеноза КС выделены 3 группы атеросклеротических бляшек: стеноз на 50-69% (1-я группа), 70-89% (2-я группа) и 90-95% (3-я группа). 1-ю группу составили 16 «симптомных» бляшек (2 из них удалены у одного больного) и 15 «асимптомных»; 2-ю группу — 46 «симптомных» бляшек и 84 «асимптомных» (удалены у 43 и 71 больного соответственно); 3-ю группу -21 «симптомная» бляшка и 18 «асимптомных».
Биоптаты после фиксации в растворе формалина разрезали на несколько блоков, ориентируясь на такие видимые макроскопически изменения, как изъязвления поверхности бляшек, тромбы, кровоизлияния в бляшки, максимально выраженный стеноз КС и другие изменения. Блоки заливали в парафин, срезы толщиной 5-8 мкм окрашивали гематоксилином и эозином по ван Гизону; для выявления эластических волокон, соединений железа, извести и фибрина применялись соответственно методы Вейгерта, Перльса, Коссы и Шуенинова. При исследовании биоптатов учитывались их изменения, связанные с хирургическими манипуляциями: полное или частичное отсутствие эндотелия, проникновение (затеки) крови в стенку КС, разрывы и надрывы ее, частичная утрата атероматозного и петрифицированного содержимого бляшки.
Каждая бляшка изучалась с использованием карты морфологического исследования биоптата, которая была разработана в лаборатории патологической анатомии НЦ неврологии РАМН (патент на изобретение № 2319146 от 18.10. 2006 г. «Способ определения причины возникновения ишемического нарушения мозгового кровообращения при атеросклерозе синуса ВСА»). В соответствии с картой проводилась детальная оценка структуры каждой бляшки — учет 24 компонентов и процессов (очаги атероматоза, фиброза, кальциноза, некроза и отёка волокнистых структур, липофаги, вновь образованные сосуды, кровоизлияния в бляшку, истончение и изъязвление покрышки и др.), а также количества (малое, умеренное, большое) или степени выраженности (слабая, умеренная, резкая) их; в пределах каких оболочек КС локализуется бляшка; выходит ли бляшка за пределы биоптата, т.е. полностью ли она удалена; что находится в просвете КС — тромбы, части содержимого бляшки. По окончании исследования биоптата в карту заносилось заключение о структуре и особенностях атеросклеротической бляшки.
Статистическая достоверность полученных данных оценивалась с помощью ^критерия Стьюдента, показатели и их различия считали значимыми при р < 0,01.
Результаты исследования и их обсуждение_
Из 200 биоптатов 178 (89%) имели форму КС или форму бифуркации общей сонной артерии и начальных отделов внутренней и наружной сонных артерий с атеросклеро-тическими бляшками в их стенках (рис. 1, А); в остальных случаях биоптаты имели неправильную форму, их поверхности были бугристыми, изъязвленными и распадающимися (рис. 1, Б). В 14 (7%) бляшках обнаружены единичные и множественные кровоизлияния диаметром 0,1-0,3 см, в 10 (5%) биоптатах на поверхности бляшек были видны тромбы (рис. 1, В).
При микроскопическом исследовании в бляшках КС выявлялись структурные компоненты и процессы, характерные для тяжелой формы атеросклероза. В большинстве бляшек были обнаружены атероматозные массы с кристаллами холестерина среди них. В 50% биоптатов атероматозные массы в виде одного или нескольких очагов составляли основной объем бляшек (рис. 1, Г), при этом в части биоптатов поверхностные слои бляшек были истончены (рис. 1, Д) или разрушены. В 57 (29%) бляшках имелись небольшие или средней величины участки атероматоза, расположенные в их глубоких отделах.
В большинстве бляшек были обнаружены пылевидные, глыбчатые и пластинчатые кальцификаты, которые в основном имели небольшую величину и располагались в глубине бляшек. В 60 (30%) бляшках очаги кальциноза занимали не менее 1/4 их объема, при этом в 14 (7%) из них кальцификаты распространялись в поверхностные слои бляшек (рис. 1, Е).
Степень выраженности склеротических процессов в бляшках также была различной: в 18 (9%) бляшках участки фиброза занимали практически всю площадь срезов (рис. 1, Ж), в 132 (66%) — они не уступали по площади таким компонентам, как очаги атероматоза и кальцино-за; в 50 (25%) бляшках фиброз был выражен незначительно. Во всех бляшках выявлялись также очаги гиали-ноза, в глубоких отделах некоторых бляшек — очаги нек-
Структура атеросклеротических бляшек каротидного синуса
ш ‘ s
рис. 1: Атеросклеротические изменения каротидного синуса:
‘-К •
Ш
А ~
V’ I mis- » ;
Ш ‘ ‘
/■yml # : Jv,
4 i-‘Ä
V , Jf3*, V»
» V. • ‘ ■
• : : \
V’V-^/.
•* , ;, «I •
• а»»»м-
л ъ. LÜJ . «.
Ч-. ‘ i . — • *
V н- •
m, —
-••я
» / *
9 ‘f <
А — атеросклеротическая бляшка (обозначена стрелкой) в биоптате каротидного синуса; Б — атеросклеротическая бляшка с распадающейся поверхностью; В — атеросклеротическая бляшка (обозначена тонкой стрелкой) с пристеночным тромбом (обозначен толстой стрелкой);
Г — обширный очаг атероматоза (обозначен крестом) в стенозирующей атеросклеротиче-ской бляшке;
Д — стенозирующая атеросклеротическая бляшка с несколькими очагами атероматоза (обозначены крестами) и истончением покрышки бляшки над одним из них (обозначена стрелкой);
Е — очаги кальциноза (обозначены стрелками) в атеросклеротической бляшке; Ж — стенозирующая атеросклеротическая бляшка с преобладанием фиброза; А, Б, В — макрофото; Г, Е — окраска по методу ван Гизона; Д, Ж — окраска фукселином по методу Вейгерта; Г-Ж — х45.
роза (рис. 2, А) и отека (рис. 2, Б) волокнистых структур, которые располагались в глубоких участках бляшек. В отдельных бляшках очаги отека занимали значительную часть площади их поперечного среза, что, вероятно, могло привести к увеличению объема бляшек, а следовательно, и степени стеноза КС.
Клеточные элементы в бляшках были в основном представлены липофагами (рис. 2, В), а также сидерофагами, лимфоцитами и плазмоцитами, расположенными главным образом периваскулярно в виде небольших скоплений и инфильтратов. В 59 (30%) бляшках вблизи атероматозных масс были обнаружены гигантские многоядерные клетки типа гигантских клеток инородных тел, многие из которых содержали в цитоплазме кристаллы холестерина.
рис. 2: Структурные компоненты и процессы в атеросклеротических бляшках
каротидного синуса: А — очаговый некроз волокнистых структур (обозначен двумя крестами) бляшки; Б — отек волокнистых структур бляшки; В — скопление липофагов в бляшке; Г — тонкостенные сосуды (обозначены стрелками) в бляшке; Д — сосуд в бляшке, имеющий строение замыкающей артерии; Е — изменения стенок артерий в бляшке, характерные для артериальной гипертонии: плазматическое пропитывание (слева) и фибриноидный некроз (справа); Ж — сидерофаги (обозначены стрелками) вблизи тонкостенных сосудов бляшки;
Во многих бляшках обнаружены вновь образованные тонкостенные сосуды капиллярного и синусоидного типов, которые располагались диффузно или в виде групп по 3-6 сосудов (рис. 2, Г). Большинство этих сосудов было ориентировано по длиннику КС, некоторые из них сообщались с просветом его. В 47 (24%) бляшках среди тонкостенных сосудов выявлены сосуды диаметром 50—100 мкм, имеющие строение артерий с 1—3 рядами миоцитов и эластическими волокнами. Некоторые из них имели строение замыкающих артерий с толстыми относительно просветов стенками за счет нескольких рядов миоцитов и эластических волокон (рис. 2, Д). К отдельным замыкающим артериям непосредственно примыкали тонкостенные сосуды, что характерно для артериоловенулярных анастомозов. В 4 (2%) бляшках, удаленных у больных с артериальной гипертонией, выявлены характерные для нее изменения вновь образованных бляшек в виде плазморрагий и фибри-ноидного некроза их стенок (рис. 2, Е).
В 32% биоптатов вблизи или вокруг вновь образованных тонкостенных сосудов выявлялись признаки организованных кровоизлияний в бляшки в виде скоплений сидерофагов в различном количестве (рис. 2, Ж). В 11 (6%) бляшках организованные кровоизлияния обнаружены в поверхностных слоях в области истончения и изъязвления покрышки. К признакам кровоизлияний большой давности можно отнести феномен «ожелезне-ния» волокнистых структур (рис. 2, З), обнаруженный в 31 (16%) бляшке, при этом «ожелезненные» волокнистые структуры часто выявлялись среди сидерофагов.
Что касается патогенеза кровоизлияния в бляшку, то ранее нами было высказано предположение, что обнаруженные замыкающие артерии формируются в связи с тем, что кровь поступает в сосуды бляшки из просвета КС, т.е. области высокого давления, при этом предполагаемые артериоловенулярные анастомозы осуществляют шунтирующую функцию . При несостоятельности функции замыкающих артерий недемпфируемое высокое внутриартериальное давление в КС может передаваться непосредственно на тонкостенные сосуды бляшек — источник кровоизлияний. Основанием для такого суждения послужило обнаружение сидерофагов вблизи таких сосудов. Этот предполагаемый механизм внутри-бляшечного кровоизлияния может реализоваться при колебаниях системного артериального давления, особенно при его повышении. К признакам влияния артериальной гипертонии на внутрибляшечные сосуды следует отнести и вышеописанные изменения их стенок.
Особое внимание при исследовании биоптатов уделялось состоянию поверхностных слоев бляшек, отделяю-ших атероматозные массы от просвета КС, — так называемая покрышка бляшек. Покрышка бляшек имела различную толщину, в ее составе определялись коллагено-вые и эластические волокна, нередко с их гиалинозом, в отдельных бляшках — «ожелезненные» волокна. Среди волокон часто обнаруживались фибробласты, немногочисленные миоциты, липофаги, сидерофаги, лимфоциты в разных количествах и соотношениях, в единичных биоптатах — массы фибрина, а также полиморфно-ядерные лейкоциты и эозинофилы.
В 20 (10%) бляшках покрышка была истончена в области очагов атероматоза и в 14 (7%) — в области очагов каль-циноза, при этом в 5 бляшках очаги кальциноза проникали на их поверхность. В 31 (16%) бляшке в области очагов атероматоза обнаружены изъязвление и разрушение покрышки, большое количество липофагов, инфильтрирующих покрышку бляшки, среди которых нередко обнаруживались лимфоциты. При этом в 18 (9%) биоптатах в просвете КС определялись компоненты атеросклеротической бляшки — атероматозные массы, кристаллы холестерина, мелкие кальцификаты, липофа-ги. Все перечисленные компоненты могли служить материалом для атероэмболии дистальных отделов и ветвей ВСА, обусловливая риск возникновения ИНМК.
К такому же эмбологенному материалу следует отнести и тромбоцитарные агрегаты (рис. 2, И), и организующиеся и организованные пристеночные тромбы, обнаруженные на поверхности 17 (9%) бляшек в области истончения и изъязвления их покрышки; в 4 (2%) случаях они располагались на неизмененной поверхности бляшек. Следует отметить, что обнаруженный потенциально эмбологенный материал, по-видимому, не совсем соот-
таблица 1: Основные компоненты и процессы в атеросклеротических бляшках каротидного синуса.
Структурные компоненты и процессы Частота выявления, % (n = 200)
Участки фиброза 100
Липофаги 88
Вновь образованные сосуды 84
Очаги кальциноза 82
Очаги атероматоза 79
Лимфоциты и плазмоциты 68
Очаги некроза и отека 35
Организованное кровоизлияние 34
Истончение и изъязвление покрышки в области очагов атероматоза 26
Тромбы, тромбоцитарные агрегаты и содержимое бляшки на ее поверхности 20
Примечание: p < 0,01.
ветствует действительному положению вещей, так как часть этого материала могла быть утрачена при выполнении КЭ и при изготовлении препаратов для микроскопического исследования.
Основные структурные компоненты атеросклеротических бляшек КС и процессы в них представлены в табл. 1. Обращает на себя внимание большая частота обнаружения атероматоза, фиброза, кальциноза, липофагов, вновь образованных сосудов, лимфоцитов и плазмоцитов, которые являются, с одной стороны, основными компонентами бляшек, с другой — признаками их длительного существования. Остальные процессы, обнаруженные в бляшках намного реже — очаги некроза и отека волокнистых структур, организованные кровоизлияния, изменения покрышки, — отражают в определенной степени острые (подо-стрые) процессы, происходящие в бляшке, и дополняют вышеперечисленные структурные «стационарные» компоненты ее. Обнаружение тромбоцитарных агрегатов, тромбов и содержимого бляшки (липофаги, кристаллы холестерина, кальцификаты, гигантские многоядерные клетки) на ее поверхности характеризует бляшку как осложненную.
В результате сопоставления данных морфологического исследования 83 (42%) «симптомных» бляшек и 117 (58%) «асимптомных» бляшек обнаружены статистически досто-
%
04%
60%
Группы бляшек
О «симптомные» бляшки (16) □ «асимгттомные» бляшки (15)
Примечание: р < 0,01 при сравнении показателей.
рис. 3: Частота обнаружения липофагов в атеросклеротических бляшках при стенозе каротидного синуса на 50-69%.
Структура атеросклеротических бляшек каротидного синуса
таблица 2: Различия в структуре «симптомных» и «асимптомных» атеросклеротических бляшек при стенозе каротидного синуса на 70-89%.
верные различия в их структуре, которые можно расценить как морфологические признаки более тяжелого атеросклероза у больных с ИНМК, чем у больных с асимптомным атеростенозом КС. В «симптомных» бляшках по сравнению с «асимптомными» при стенозе КС на 50-69% в 1,6 раза чаще выявлялись липофаги (рис. 3); при стенозе на 70-89% в 1,3 раза чаще обнаруживались очаги атероматоза, в 2,6 раза чаще определялось изъязвление покрышки, в 3,4 раза чаще обнаруживались ее истончение, тромбоцитар-ные агрегаты и тромбы на поверхности бляшек, в 2,8 раза чаще определялось большое количество липофагов в покрышке (табл. 2); при стенозе на 90-95% в 2,4 раза чаще выявлялись организованные кровоизлияния в бляшки (рис. 4). Что касается кровоизлияний, то они в 2,4 раза чаще обнаруживались как в «симптомных», так и в «асимп-томных» бляшках у больных с артериальной гипертонией, чем при ее отсутствии, — 24 и 10 бляшек соответственно.
Таким образом, полученные данные убедительно свидетельствуют о том, что ИНМК в бассейне артерий каро-тидной системы могут быть связаны не только с атеро-стенозом КС как таковым, но и с особенностями структуры бляшек, что полностью согласуется с данными литературы. Так, на основании сопоставления клинических данных с результатами морфологического исследования бляшек, удаленных при КЭ, разными авторами установлено, что в патогенезе ИНМК в бассейне артерий каротидной системы ведущую роль играют, наряду с величиной бляшки и степенью обусловленного ею стеноза, такие процессы в бляшках, как резкое преоблада-
22%
Группы бляшек
□ «симгтгомные» бляшки (21)
□ «асимгтгомные» бляшки (18)
Примечание: р < 0,01 при сравнении показателей.
рис. 4: Частота обнаружения кровоизлияний в атеросклеротических бляшках при стенозе каротидного синуса на 90-95%.
ние очагов атероматоза над участками фиброза и каль-циноза, истончение покрышки и выраженная инфильтрация ее липофагами, изъязвление и разрушение покрышки с проникновением в просвет КС содержимого бляшек (атероматозных масс, кристаллов холестерина, липофагов, кальцификатов) — потенциально эмбо-логенного материала, формирование на их поверхности тромбов . Эти процессы трансформируют «стабильную» бляшку КС в «нестабильную», повышая риск возникновения ИНМК в результате тромбоза КС, атеро- и тромбоэмболии ВСА. На нашем материале подобная структура бляшек была выявлена в 37% случаев «симптомного» и только в 14% случаев «асимптомно-го» течения атеростеноза КС. При этом следует подчеркнуть, что, несмотря на отсутствие указаний на перенесенные ИНМК в анамнезе, у таких больных с асимптом-ным стенозом КС нельзя исключить наличие «немых» (бессимптомных) инфарктов мозга, частота которых, по данным литературы, может достигать 28% .
Значительное преобладание в «симптомных» бляшках по сравнению с «асимптомными» частоты кровоизлияний указывает на возможную роль этого компонента в возникновении ИНМК в результате резкого увеличения объема бляшки, а следовательно, и степени стеноза КС. Как уже подчеркивалось, один из предполагаемых механизмов кровоизлияния в бляшки может быть связан с несостоятельностью функции обнаруженных нами замыкающих артерий, при этом основным источником кровоизлияний являются вновь образованные тонкостенные капиллярные и синусоидные сосуды бляшек, что согласуется с данными других авторов .
Однако этот механизм кровоизлияния в бляшку не исключает и других возможных путей проникновения крови в бляшку, в частности, из просвета КС через разрушенную покрышку бляшки, при повышении проницаемости стенок артерий в момент сосудистого криза у больных с артериальной гипертонией. В качестве причин кровоизлияний в бляшки указывают на такие факторы, как снижение в бляшке тканевого давления по отношению к внутрикапиллярному, что связано с атероматозом и некрозом в ней, нарушения в фибринолити-ческой системе, интенсивная антикоагулянтная терапия .
Как уже указывалось, многие вновь образованные сосуды в бляшках были ориентированы по длиннику КС. Это позволяет предположить их функционирование в качестве путей параллельного кровотока, компенсирующего в определенной степени сниженный кровоток в ВСА при резко выраженном атеростенозе КС. Этим, по-видимому, можно объяснить, наряду с другими факторами, отсутствие клинических проявлений у ряда больных с асимптомным атеростенозом КС. Возможный параллельный кровоток внутри бляшек, стенозирующих КС, т.е. своеобразная реканализация бляшек, становится вполне реальным, если учесть тот факт, что ВСА до входа в череп не имеет ветвей, по которым мог бы осуществляться коллатеральный кровоток.
Наше исследование показало, что значительное влияние на структуру атеросклеротических бляшек КС может оказывать артериальная гипертония, приводящая к резкому нарушению проницаемости сосудистой стенки. В случаях сочетания атеростеноза КС с артериальной
Структурные компоненты и процессы Частота выявления, %
«симптомные» бляшки (П = 46) «асимптомные» бляшки (П = 84)
Очаги атероматоза 93 74
Истончение покрышки в области очагов атероматоза 17 5
Большое количество липо-фагов в покрышке 28 10
Изъязвление покрышки 26 10
Тромбы и тромбоцитарные агрегаты на поверхности бляшки 17 5
Примечание: р < 0,01 при сравнении показателей для «симптомных» и «асимптомных» бляшек.
гипертонией обнаружены характерные для нее плазмор-рагии в стенки сосудов атеросклеротических бляшек и фибриноидный их некроз, а также более высокая частота (в 2,6 раза) кровоизлияний в бляшку у больных с артериальной гипертонией, чем при ее отсутствии. Это свидетельствует о существенной роли артериальной гипертонии в патогенезе кровоизлияний в атеросклеротиче-скую бляшку и необходимости эффективной коррекции ее у больных с атеросклерозом КС.
Заключение
Морфологическая структура большинства атеросклеро-тических бляшек КС свидетельствует о тяжелом прогрессирующем характере течения атеросклероза на этом важнейшем структурно-функциональном уровне артериальной системы головного мозга. На это указывает выявление в бляшках таких структурных компонентов и процессов, как очаги атероматоза и отека, некроз колла-геновых и эластических волокон, вновь образованные сосуды и кровоизлияния различной давности, липофаги и лимфоциты, участки фиброза и кальциноза, а также истончение и изъязвление покрышки, тромбы и содержимое бляшек (атероматозные массы, кристаллы холестерина, липофаги, кальцификаты) на их поверхности.
Сопоставительный анализ структуры «симптомных» и «асимптомных» атеросклеротических бляшек показал, что при одинаковой степени атеростеноза КС в «симп-томных» бляшках значительно чаще, чем в «асимптом-ных» выявляются изменения, характерные для «нестабильных» бляшек. Это резкое преобладание очагов ате-
роматоза над участками фиброза и кальциноза, истончение покрышки и выраженная инфильтрация ее липофа-гами, изъязвление покрышки, формирование тромбов и другого потенциально эмбологенного материала на разрушенной поверхности бляшек. Эти структурные компоненты и процессы имеют патогенетическое значение в возможности возникновения ИНМК не только по механизму сосудистой мозговой недостаточности, но и в результате атеро- и тромбоэмболии церебральных артерий.
Разумеется, развитие клинической симптоматики при стенозах ВСА обусловливается в конечном счете совокупностью многих факторов, прежде всего таких, как состояние регионарной и системной гемодинамики, коллатерального кровообращения, реологических свойств крови и др. Однако при несомненной значимости перечисленных выше факторов предиктором ИНМК в системе ВСА при атеросклерозе остается бляшка в ней со всеми свойственными ей структурными компонентами и процессами, определяющими ее тромбо- и эмболо-генный потенциал и патогенез ИНМК в этой системе в целом.
Таким образом, наше исследование подтверждает, что ИНМК могут быть связаны не только с атеростенозом КС как таковым, но и в неменьшей степени с характером течения атеросклероза, что находит отражение в морфологической структуре бляшки и необходимо учитывать при определении показаний к проведению операции КЭ как у больных с ИНМК в анамнезе, так и при асимптом-ном стенозе КС.
Список литературы
2. Гаериленко А.В., Скрылее С.И., Вороное Д.А. Показания к каро-тидной эндартерэктомии и ее результаты. Вестник РАМН 2002; 5: 7-12.
3. Гулееская Т.С., Моргунов В.А. Очерки ангионеврологии / Под ред. З.А. Суслиной. М.: Атмосфера. 2005: 49-65.
4. Гулееская Т.С., Моргуное В.А., Ануфриее П.Л. Морфологические особенности сосудов атеросклеротических бляшек синуса внутренней сонной артерии (на материале биоптатов, полученных при каротидной эндартерэктомии). Архив патологии 2002; 6: 47-50.
5. Гулееская Т.С., Моргуное В.А., Ануфриее П.Л. и др. Морфологическая структура атеросклеротических бляшек синуса внутренней сонной артерии и их ультразвуковая характеристика. Ультразвуковая и функциональная диагностика 2004; 4: 68-77.
6. Покроеский А.В. Первичная профилактика ишемического инсульта и возможности сосудистой хирургии. Журн. неврол. и психиатр. Прил. Инсульт 2003; 9: 96-99.
7. Суслина З.А., Варакин Ю.Я., Верещагин Н.В. Сосудистые заболевания головного мозга. М.: МЕДпресс-информ, 2006.
12. Golledge J., Greenhalgh R., Davies A. The symptomatic carotid plaque. Stroke 2000; 31: 774-781.
14. Hatsukami T., Ferguson M., Beach K. et al. Carotid plaque morphology and clinical events. Stroke 1997; 28: 95-100.
_ОРИГИНАЛЬНЫЕ СТАТЬИ. Клиническая неврология
Структура атеросклеротических бляшек каротидного синуса
Structure of carotid sinus atherosclerotic plaques and disturbances of cerebral blood circulation
T.S. Gulevskaja, V.A. Morgunov, P.L. Anufriev
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Юсупов Р.Ю. 1 Иваненко А.А. 1 Михайличенко В.Ю. 2 Самарин С.А. 2 Древетняк А.А. 2 1 Институт неотложной и восстановительной хирургии им. В.К. Гусака 2 Медицинская академия им. С.И. Георгиевского ФГАОУ ВО «КФУ им. В.И. Вернадского» В настоящее время сахарный диабет занимает лидирующее место среди всех заболеваний. Изменения в концентрации и составе липопротеинов, гиперинсулинемия и гипергликемия сами по себе способствуют развитию атеросклероза. Цель исследования: обосновать роль сахарного диабета как лидирующего фактора в развитии атеросклероза брахиоцефальных сосудов по сравнению с недиабетическим контролем. Нами были ретроспективно проанализированы истории болезни 51 пациента с сахарным диабетом, которым с 2010 по 2013 гг. в сосудистом отделении ИНВХ им. В.К. Гусака были выполнены операции на сонных артериях по поводу их атеросклеротического поражения. Контролем послужили 98 пациентов без сахарного диабета, прооперированных по поводу атеросклероза брахиоцефальных сосудов. Среди пациентов с сахарным диабетом у 76,5% (39 пациентов) были пролонгированные бляшки, у 23,5 % (12 пациентов) – локальные. Среди пациентов контрольной группы число пролонгированных и локальных бляшек составило 77,5% (76) и 22,5% (22) соответственно. Средняя протяженность бляшки в основной группе составила 25,6±2,33 мм, в контрольной – 22,9±1,39 мм. В группе пациентов с сахарным диабетом обращает на себя внимание высокий процент гетерогенных бляшек: 46% бляшек II типа и 37% бляшек III типа. Полностью гиперэхогенные бляшки были обнаружены в 5% случаев, полностью гипоэхогенные – также в 5% случаев, в 7% случаев не удалось установить структуру бляшки из-за кальциноза. Результаты ультразвуковой доплерографии не выявили статистически значимых отличий в протяженности и частоте встречаемости деструкции бляшки у пациентов с сахарным диабетом и без него. Однако согласно результатам патогистологического исследования наличие у пациента сахарного диабета 2-го типа относит его в группу риска образования нестабильной атеросклеротической бляшки, что значительно повышает риск возникновения тромбоза и соответственно ишемического инсульта. 661 KB сахарный диабет атеросклеротическая бляшка внутренняя сонная артерия 1. Eilenberg W., Stojkovic S., Piechota-Polanczyk A., Kaider A., Kozakowski N., Weninger, J. Nanobachvili W. J., Wojta J., Huk I., Demyanets S., Neumayer C. Neutrophil gelatinase associated lipocalin (NGAL) is elevated in type 2 diabetics with carotid artery stenosis and reduced under metformin treatment. Cardiovascular Diabetology. 2017. № 16. P. 98. 2. Zimmet P., Alberti K.G., Magliano D.J., Bennett P.H. Diabetes mellitus statistics on prevalence and mortality: facts and fallacies. Nat. Rev. Endocrinol. 2016. Vol. 12. №. 10. Р. 616–622. 3. Коротких А.В., Некрасов Д.А. Результаты выполнения каротидной эндартерэктомии у пациентов с сахарным диабетом // Бюллетень НЦССХ им. А.Н. Бакулева РАМН. Сердечно-сосудистые заболевания. 2017. Т. 18. № S6. С.100. 4. Ménégaut L., Masson D., Abello N., Denimal D., Truntzer C., Ducoroy P., Lagrost L., Pais de Barros J.P., Athias A., Petit J.M., Martin L., Steinmetz E., Kretz B. Specific enrichment of 2-arachidonoyl-lysophosphatidylcholine in carotid atheroma plaque from type 2 diabetic patients. Atherosclerosis. 2016. № 251. P. 339-347. 5. Кузнецов И.В. Диагностика атеросклеротического поражения сонных артерий в практике кардиолога // Диабет и сердце. 2011. Т. 6. №. 152. С.72-80. 6. Оскола Е.В., Шубина А.Т., Заирова А.Р., Андреевская М.В., Богиева Р.М., Болотина М.Г., Рогоза А.Н., Карпов Ю.А. Оценка влияния ситаглиптина на жесткость артерий, показатели функции почек и почечного кровотока у больных сердечно-сосудистыми заболеваниями с декомпенсированным сахарным диабетом 2 типа // Российский кардиологический журнал. 2015. Т. 20. № 3. С. 64-71. 7. Михайличенко В.Ю., Пилипчук А.А., Самарин С.А. Сравнительная оценка различных методов хирургической коррекции аллоксанового сахарного диабета // Крымский журнал экспериментальной и клинической медицины. 2018. Т. 8. № 3. С. 52-57. 8. Scholtes V.P., Peeters W., van Lammeren G.W., Howard D.P., de Vries J.P., de Borst G.J., Redgrave J.N., Kemperman H., Schalkwijk C.G., den Ruijter H.M., de Kleijn D.P., Moll F.L., Rothwell P.M., Pasterkamp G. Type 2 diabetes is not associated with an altered plaque phenotype among patients undergoing carotid revascularization. A histological analysis of 1455 carotid plaques. Atherosclerosis. 2014 Vol. 235. №. 2. P. 418-423. 9. Рзаева Р.А. Наличие метаболического синдрома не влияет на толщину комплекса «интима-медиа» и интерадвентициальный диаметр магистральных сосудов у пациентов с сахарным диабетом 2-го типа // Казанский медицинский журнал. 2018. Т. 99. № 2. С. 235-239. 10. Воробьева Ю.В., Сливкина В.С. Ультразвуковая диагностика особенностей поражения сосудистой стенки сонных артерий при сахарном диабете 2 типа // Ультразвуковая и функциональная диагностика. 2015. № 4S. С. 40a. 11. Гринцов А.Г., Михайличенко В.Ю., Алексеенко А.А., Нестеров Н.А., Шестопалова А.Д., Самарин С.А. Результаты трансплантации и ретрансплантации культур клеток поджелудочной железы у больных молодого возраста, страдающих сахарным диабетом 1 типа // Таврический медико-биологический вестник. 2017. Т. 20. № 3-2. С. 86-91. 12. Сафронов М.А., Трифонова К.С., Криштоп В.В., Демидов В.И. Структурные особенности поражения общих сонных артерий у больных сахарным диабетом 2 типа // Медико-биологические, клинические и социальные вопросы здоровья и патологии человека: материалы всероссийской научной конференции студентов и молодых ученых с международным участием, XIV областной фестиваль «Молодые ученые — развитию ивановской области». 2018. С. 25-27. 13. Михайличенко В.Ю., Пилипчук А.А., Самарин С.А. Патофизиологические аспекты липидного и фосфолипидного обмена у крыс при инфаркте миокарда и сахарном диабете // Современные проблемы науки и образования. 2018. № 1. URL: http://science-education.ru/ru/article/view?id=27395 (дата обращения: 04.02.2020). 14. Казаков Ю.И., Касьяненко А.П., Соколова Н.Ю., Бакулина А.В., Яковлев А.О. Отдаленные результаты каротидной эндартерэктомии у больных с сахарным диабетом II типа // Ангиология и сосудистая хирургия. 2017. Т. 23. № 2. С. 98-106. 15. Михайличенко В.Ю., Самарин С.А., Пилипчук А.А. Возможность использования трансплантации культур клеток поджелудочной железы при экспериментальном сахарном диабете у крыс // Актуальные проблемы эндокринной хирургии: материалы XXVIII Российского симпозиума по эндокринной хирургии / Ответственный за выпуск и составитель В.И. Давыдкин. 2018. С. 296-303.
Сахарный диабет (СД) 2-го типа является одной из крупнейших мировых эпидемий. В 2015 г. во всем мире около 420 млн человек страдали СД 2-го типа. Согласно прогнозам к 2040 г. их число увеличится до 640 млн .
Хорошо известно, что повышенный риск сердечно-сосудистых заболеваний имеют пациенты с СД 2-го типа. Их пораженность ишемическими инсультами в 2,5–3,5 раза выше по сравнению с пациентами, не страдающими сахарным диабетом . При изучении популяции больных с каротидных стенозом пациенты с СД 2-го типа встречаются в 45% случаев. За развитие атеросклероза ответственны множественные патофизиологические механизмы, способствующие воспалению сосудов и тромбозу. Вопрос, с чем связаны стремительный атерогенез и более тяжелое течение заболевания при сахарном диабете, широко обсуждается в научных кругах . Риск развития атеросклероза у больных СД соотносят с нарушением липидного обмена, с прямым действием инсулина на стенку артерий, с изменениями в системе гемостаза и гемореологии. Пациенты с СД 2-го типа особенно подвержены воспалительным процессам, которые играют решающую роль в нестабильности бляшки . Развитие нестабильных «взрывающихся» атеросклеротических бляшек указывают как одну из особенностей атеросклероза при сахарном диабете . Интересен факт, что ремоделирование сонных артерий у пациентов с СД 2-го типа и у пациентов с СД 2-го типа и метаболическим синдромом происходит одинаково и не имеет морфологических отличий .
Установлено, что повышение жесткости стенки сонной артерии у больных СД 2-го типа связано с утолщением комплекса интима-медиа, что ускоряет процесс возникновения нестабильной атеросклеротической бляшки . Помимо прочего, немаловажную роль играет наличие у пациентов с СД 2-го типа артериальной гипертензии , которая приводит к нарушению реологии крови и гемодинамики кровоснабжения головного мозга. Известен факт, что у больных СД 2-го типа на фоне артериальной гипертензии отмечаются повышение скорости кровотока в диастолу и снижение индекса пульсации, индекса цереброваскулярной реактивности, что связано с морфологическими изменениями в стенке сонной артерии и приводит к значительному снижению адаптационно-компенсаторных возможностей артерий головного мозга. Помимо утолщения комплекса интима-медиа, наблюдаются атрофия эластическо-мышечного каркаса среднего слоя сонной артерии и замещение специализированных элементов коллагеновыми волокнами, что влияет на демпфирующую функцию артерий и повышает количество осложнений . Ключевыми факторами в ускоренном развитии атеросклероза внутренних сонных артерий считают употребление никотина, неконтролируемую гипергликемию, что приводит к повышению показателей маркеров воспаления, таких как С-реактивный белок и металлопротеиназа-9 . Исходя из этого понятной становится неэффективность только коррекции гликемического профиля на жесткость артерии и скорость образования атеросклеротической бляшки , поэтому терапия данной категории пациентов должна включать не только гипотензивные, антиангинальные и липидоснижающие препараты, но и обязательно ингибиторы дипептидилпептидазы-4 .
Цель исследования: обосновать роль сахарного диабета как лидирующего фактора в развитии атеросклероза брахиоцефальных сосудов у больных сахарным диабетом 2-го типа по сравнению с пациентами, не страдающими диабетом.
Материал и методы исследования. В основу работы положен анализ результатов обследования и лечения 149 больных, которые находились на лечении в отделении сосудистой хирургии отдела неотложной и восстановительной сосудистой хирургии ИНВХ им. В.К. Гусака в период с 2008 по 2013 гг. У всех пациентов имелось мультифокальное поражение сосудов атеросклерозом, т.е., помимо поражения брахиоцефальных сосудов, были клинические признаки, подтвержденные инструментально, патологии сосудов нижних конечностей и сердца. Всем пациентам были выполнены операции на сонных артериях по поводу их атеросклеротического поражения. Пациенты были разделены на две группы. В группу сравнения вошел 51 пациент с сахарным диабетом. В качестве контроля была сформирована группа из 98 пациентов без сахарного диабета.
Обследование больных включало физикальное, общеклиническое исследования, ультразвуковое триплексное сканирование для определения морфологии бляшек и степени стеноза, СКТ головного мозга или магнитно-резонансную томографию мозга.
В ходе триплексного сканирования проводилась оценка:
· спектральных и линейных характеристик кровотока в зоне стеноза и в постстенотических отделах;
· свойств атеросклеротической бляшки, ее эмболоопасности (определялись форма бляшки, ее структура, характер поверхности);
· протяженности поражения (и выявление тандемных стенозов в сонной артерии);
· наличия у больного извитости, ее гемодинамической значимости.
В работе нами использовалась классификация, разработанная C.M. Stefen и соавторами (1989) и дополненная G. Geroulakos и соавторами (1993) , для характеристики состояния атеросклеротических бляшек:
· I тип (гомогенные) – полностью гипоэхогенная бляшка с тонкой эхогенной покрышкой;
· II тип (гетерогенная) – преимущественно гипоэхогенная бляшка с наличием гиперэхогенных зон;
· III тип (гетерогенная) – преимущественно гиперэхогенная бляшка с наличием гипоэхогенных зон;
· IV тип (гомогенная) – полностью гиперэхогенная бляшка;
· V тип – бляшка, не поддающаяся идентификации из-за выраженного кальциноза, вызывающего акустическую тень.
По распространенности бляшки подразделялись на локальные (протяженностью 1–1,5 см) и пролонгированные (более 1,5 см); по локализации – локальные (занимают одну стенку сосуда), эксцентрические и концентрические; по форме поверхности – гладкие и с неровной поверхностью (рис. 1).
Рис. 1. Атеросклеротическая бляшка с изъязвлением у пациента с сахарным диабетом
Кроме этого, было выполнено патогистологическое исследование атеросклеротических бляшек с частью стенки артерии, удаленной во время операции. Нами проведены параллели между гистологическим строением атеросклеротической бляшки и ультразвуковой картиной.
Статистический анализ полученных результатов проводили с помощью набора лицензированных статистических программ Microsoft Office 2010 и STATISTICA 10.0.
Результаты исследования и их обсуждение. Мы не выявили значимых различий в распространенности бляшек между пациентами основной и контрольной групп. Среди пациентов с сахарным диабетом у 76,5% (39 пациентов) были пролонгированные бляшки, у 23,5% (12 пациентов) – локальные. Среди пациентов контрольной группы процент пролонгированных и локальных бляшек составил 77,5% (76) и 22,5% (22) соответственно. Средняя протяженность бляшки в основной группе составила 25,6±2,33 мм, в контрольной – 22,9±1,39 мм.
В литературе нет единого мнения по поводу влияния гипергликемии на процесс атеросклероза и нестабильности атеросклеротической бляшки, а также на кальциноз атеросклеротических бляшек. В ряде работ кальциноз, фиброз, некротический сердечник, внеклеточные липиды указываются как характерные особенности атеросклеротических бляшек у пациентов с сахарным диабетом .
На основании анализа данных триплексного сканирования нами не было установлено четких различий в частоте деструкции между сравниваемыми группами: в группе больных с сахарным диабетом деструкция бляшки встречалась в 51% случаев (26 пациентов), в группе контроля – в 43,9% случаев (43 пациента). Кальциноз бляшки был более распространен у пациентов без сахарного диабета – в 40,8% случаев (40 пациентов), чем у пациентов с сахарным диабетом – 23,5% случаев (12 пациентов) (р<0,001).
Сравнительная характеристика состояния атеросклеротических бляшек показала следующие результаты (рис. 2). В группе контроля суммарное количество пациентов с гетерогенными бляшками (II и III тип) составило 47%, чаще всего встречались полностью гиперэхогенные бляшки (35%). В 8% случаев выявляли полностью гомогенные бляшки, в 10% случаев структура бляшки не поддавалась идентификации из-за кальциноза.
В группе пациентов с сахарным диабетом обращает на себя внимание высокий процент гетерогенных бляшек: 46% бляшек II типа и 37% бляшек III типа. Полностью гиперэхогенные бляшки были обнаружены в 5% случаев, полностью гипоэхогенные – также в 5% случаев, в 7% случаев не удалось установить структуру бляшки из-за кальциноза.
А
Б
Рис. 2. Распределение бляшек по типам согласно классификации C.M. Stefen и G. Geroulakos (А – пациенты без сахарного диабета; Б – с сахарным диабетом)
Несколько иную картину показало патогистологическое исследование. Наличие нестабильной бляшки было выявлено у 68% больных с сахарным диабетом и у 54% больных контрольной группы. В 26% случаев были определены очаги кровоизлияния в бляшку. Было установлено, что при наличии нестабильной атеросклеротической бляшки отмечаются преобладание атероматозных масс, истончение, изъязвление и разрушение покрышки, а также ее инфильтрация липофагами и лимфоцитами, нахождение на ее поверхности потенциально эмбоологенного материала (рис. 3).
Рис. 3. Микропрепарат. Больной Р., 51 год. Атеросклеротическая бляшка из ВСА.
Окраска гематоксилином и эозином, х30
Исходя из вышеизложенного мы видим, что верный на 100% диагноз можно установить только по данным гистологического исследования.
В Донецкой области зарегистрированы 15213 больных с инфарктом головного мозга, из них 4107 (27%) страдают сахарным диабетом. Летальность в течение первого года после инсульта составляет 35–38%, а в целом нарушения мозгового кровообращения являются причиной четверти всех смертельных исходов у больных сахарным диабетом. На Украине зарегистрированы 1 млн больных диабетом, среди них 11–14% инсулинозависимых. В возрасте старше 40 лет острые нарушения мозгового кровообращения возникают у больных сахарным диабетом в 1,5–2 раза чаще, чем без диабета, а в возрасте до 40 лет – в 3–4 раза чаще, причем со значительным преобладанием женщин.
Таким образом, несмотря на то, что существуют достоверные факторы влияния гипергликемии на развитие инсультов головного мозга, ее роль как фактора риска интра- и послеоперационных осложнений при выполнении каротидной эндартерэктомии остается спорной. Нами установлено, что больные сахарным диабетом с изъязвленными бляшками имели повышенные уровни D-димера и матриксной металлопротеиназы-8, чем те же больные с фиброзными бляшками (р=0,02, р=0,01 соответственно).
У больных сахарным диабетом уровень плазменного фибриногена был выше у пациентов с гипоэхогенными бляшками (р=0,007). Таким образом, была выявлена значительная корреляционная связь между уровнем внутритканевого фактора и D-димера у больных сахарным диабетом с симптомным заболеванием.
В соответствии с результатами нашего исследования установлено, что диабет является основным независимым фактором увеличения длины бляшки у пациентов, подвергающихся каротидной эндартерэктомии. Вследствие этого артериотомический разрез был более длинным, увеличивалось время пережатия внутренней сонной артерии. Диабет по сравнению с другими факторами риска оказывает значительно большее влияние на гистологическую структуру и число осложнений со стороны атеросклеротической бляшки. Следовательно, для этих пациентов целесообразно максимально раннее оперативное пособие.
При сахарном диабете наиболее выражено поражение внутренней сонной артерии, что проявляется в увеличении длины бляшки и выраженном кальцинозе. Сахарный диабет является зависимым фактором риска для развития сердечных и неврологических осложнений после каротидной эндартерэктомии.
Выводы
1. Результаты УЗДГ не выявили статистически значимых различий в протяженности и частоте встречаемости деструкции бляшки у пациентов с сахарным диабетом и без него.
2. Наличие у пациента сахарного диабета 2-го типа относит его в группу риска образования нестабильной атеросклеротической бляшки, что значительно повышает риск возникновения тромбоза и соответственно ишемического инсульта.
3. Нами подтвержден факт особенности морфологического строения атеросклеротической бляшки, что необходимо учитывать при выполнении каротидной эндартерэктомии.
Юсупов Р.Ю., Иваненко А.А., Михайличенко В.Ю., Самарин С.А., Древетняк А.А. ОСОБЕННОСТИ МОРФОЛОГИИ АТЕРОСКЛЕРОТИЧЕСКИХ БЛЯШЕК ВНУТРЕННЕЙ СОННОЙ АРТЕРИИ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ ПО ДАННЫМ УЛЬТРАЗВУКОВОЙ ДОПЛЕРОГРАФИИ И ПАТОГИСТОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ // Современные проблемы науки и образования. – 2020. – № 2.;
URL: http://science-education.ru/ru/article/view?id=29602 (дата обращения: 29.10.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI


