По типу тригеминии
Желудочковая экстрасистолия
Желудочковая экстрасистолия (ЖЭ) является распространённым нарушением ритма и может отмечаться как у больных с органической патологией сердца, так и без неё. Частота ЖЭ у асимптомных лиц колеблется в пределах от 3 до 60%. По данным Фремингемского исследования, при 1-часовом мониторировании ЭКГ ЖЭ была зарегистрирована у 33% мужчин и 32% женщин без ИБС, а при наличии ИБС – у 58% мужчин и 49% женщин. К числу факторов риска развития ЖЭ относятся: мужской пол, возраст, артериальная гипертензия, ИБС, кардиомиопатии, внутрижелудочковые блокады, пролапс митрального клапана, гипокалиемия, гипомагниемия.
Клиническое значение ЖЭ зависит от конкретной ситуации:
- ЖЭ у молодых здоровых лиц без органических заболеваний сердца обычно не связана с увеличением смертности.
- Больные старшего возраста, особенно с ЖЭ на фоне структурных заболеваний сердца, имеют повышенный риск развития устойчивых желудочковых тахиаритмий и внезапной смерти.
- У больных, перенесших инфаркт миокарда, риск злокачественных желудочковых аритмий и внезапной смерти связан со сложностью (градацией) и частотой ЖЭ.
Патофизиология
Установлено 3 механизма развития ЖЭ: повторный вход волны возбуждения
(re-entry), триггерная активность, автоматизм.
1. ЖЭ по механизму ри-энтри возникает при электрофизиологической неоднородности миокарда, характерной для больных со структурной патологией сердца. У больных ИБС в зоне ишемии/рубца имеются участки с разной скоростью проведения и восстановления, что служит основой как для одиночных ЖЭ, так и пароксизмов тахикардии.
2. Триггерная активность: преждевременный импульс возникает в результате посттдеполяризации, «наведенной» предшествующим потенциалом действия. Постдеполяризации могут возникать во время (ранние) или после окончания реполяризации (поздние). Этот механизм отвечает за появление ЖЭ при брадикардии, ишемии, электролитных нарушениях, интоксикации дигиталисом и после реперфузии при остром инфаркте миокарда.
3. Повышенный автоматизм связан с наличием в желудочках эктопического очага с подпороговым потенциалом, который под влиянием основного ритма может достигать порогового уровня, вызывающего преждевременный импульс. Этот механизм связан с развитием аритмий в условиях избытка катехоламинов, электролитных нарушений и ишемии.
Этиология
- Кардиальные:
- Некардиальные:
— Электролитные нарушения (гипокалиемия, гипомагниемия, гиперкальциемия).
— Приём медикаментов некоторых медикаментов (дигоксин, трициклические антидепрессанты, амитриптилин, эуфиллин, псевдоэфедрин, флюоксетин).
— Проаритмическое действие антиаритмических препаратов.
— Употребление наркотиков и других соединений (кокаин, амфетамин, кофеин, алкоголь, табак).
— Анестезия.
— Гипоксия и/или гиперкапния.
— Хирургическое вмешательство, инфекция, стресс.
Клиническая картина
Анамнез. Больного с ЖЭ необходимо расспросить о наличии структурных заболеваний сердца, приёме медикаментов, способных индуцировать ЖЭ или нарушать электролитный обмен, употреблении запрещённых препаратов (наркотиков, симпатомиметиков).
Симптомы. При ЖЭ симптомы могут отсутствовать. Встречаются жалобы на неравномерное сердцебиение, ощущение пульсации, головокружение, синкопальные состояния, атипичную боль в грудной клетке, слабость. Ощущение пульсации связано с увеличением силы постэкстрасистолического сокращения, и может восприниматься скорее как пауза, «ощущение замирания сердца», чем как преждевременное сокращение. Другие симптомы могут быть проявлением патологии, послужившей причиной ЖЭ (например, приступ стенокардии при ИБС).
Физикальные данные. ЖЭ проявляется уменьшением звучности тонов сердца или их вариабельностью. Часто определяется усиленный удар после слабого удара (постэкстрасистолическая потенциация). Возможна пульсация шейных вен (сокращение правого предсердия при закрытом атриовентрикулярном клапане, в связи с потерей атриовентрикулярной синхронности).
Лабораторные исследования необходимы для выявления корригируемых причин ЖЭ – электролитных нарушений (определение уровня калия, магния), признаков повреждения кардиомиоцитов (повреждение, инфаркт миокарда).
Инструментальные исследования
ЭКГ позволяет не только выявить ЖЭ, но часто также и определить её вероятную причину (гипертрофия, ишемия, электролитные нарушения, действие препаратов). Для более точной характеристики ЖЭ желательно записывать, наряду со стандартной 12-канальной ЭКГ, непрерывную 2-минутную ритмограмму со скоростью лентопротяжки 25 мм/сек.
ЖЭ на ЭКГ регистрируется в виде преждевременного широкого (> 0,12) и деформированного комплекса QRS без предшествующего зубца Р; сегмент ST и зубец T ориентированы в сторону, противоположную основному отклонению комплекса QRS (рис. 1). Предсердная активность (зубец Р) может не зависеть от ЖЭ (атриовентрикулярная диссоциация) или следовать за экстрасистолическим комплексом QRS (ретроградное проведение). После ЖЭ обычно отмечается полная компенсаторная пауза (сумма интервалов от ЭС до предшествующего и последующего комплексов QRS равна удвоенному циклу основного ритма).
ЖЭ могут быть одинаковыми (мономорфными) (1А) и разными (полиморфными) (1Б) по форме, регистрироваться по одной (одиночные) или 2 подряд (парные – «куплет»), чередоваться в правильной последовательности с комплексами основного ритма (аллоритмия) – например, каждый 2-й или 3-й комплекс экстрасистолический (би- или тригеминия), располагаться по-разному относительно предшествующего комплекса, вплоть до наслоения на зубец Т (ранние ЖЭ, феномен «R-на-Т») (1В). Три и более ЖЭ подряд рассматриваются как начало желудочковой тахикардии.
По классификации B. Lown и соавт. (1971) принято выделять несколько градаций ЖЭ в порядке увеличения сложности и серьёзности аритмии: 0 – ЖЭ нет; I – редкие мономорфные ЖЭ (< 30/час); II – частые мономорфные ЖЭ (≥ 30/час); III – полиморфные ЖЭ; IVa – парные ЖЭ; IVb – пробежки желудочковой тахикардии; V – ранние (R-на-Т) ЖЭ.
Холтеровское мониторирование ЭКГ используется для оценки степени электрической нестабильности у больных высокого риска (пациенты с ЖЭ на фоне тяжёлой дисфункции ЛЖ).
· Частота и градация ЖЭ, в сочетании с тяжестью дисфункции ЛЖ, определяют агрессивность вмешательства.
· Главная цель лечения состоит не в подавлении ЖЭ как таковой (кроме случаев, когда желательно уменьшение симптомов). Скорее, назначение терапии основывается на данных о принадлежности пациента к группе высокого риска внезапной смерти.
· Уменьшение количества ЖЭ при мониторировании ЭКГ не всегда связано с улучшением прогноза.
Экстрасистолы при мониторировании классифицируют как частые, если их более 10 в час (или 1 и более в минуту), и редкие – при частоте менее 10/мин.
Электрофизиологическое исследование (ЭФИ). ЭФИ показано двум категориям пациентов: 1) больным со структурно нормальным сердцем, когда выраженность симптомов ЖЭ требует проведения медикаментозной терапии или радиочастотной абляции; 2) пациентам с ЖЭ на фоне структурной патологии сердца – с целью стратификации риска внезапной смерти.
Сигнал-усреднённая ЭКГ – перспективный метод выявления больных с высоким риском развития сложных форм ЖЭ и неустойчивой желудочковой тахикардии (ЖТ), которым может быть показано проведение ЭФИ.
Эхокардиография позволяет определить фракцию выброса ЛЖ (важно для оценки прогноза), выявить патологию клапанного аппарата, гипертрофию и другие структурные особенности сердца.
Нагрузочное тестирование у больных с ЖЭ показано для диагностики ИБС и выявления аритмий, ассоциированных с физической нагрузкой.
Прогностическое значение ЭС определяется не симптомами аритмии как таковой, а состоянием сердца. Так, би- или тригеминия может протекать вполне доброкачественно у здоровых людей, но представлять серьёзную проблему для больных со структурным заболеванием сердца.
У лиц без кардиальной патологии любая форма ЖЭ, и даже короткие эпизоды ЖТ без нарушения гемодинамики, расцениваются как прогностически доброкачественные, безопасные нарушения ритма, и не являются показанием к антиаритмической терапии.
У больных с выраженным структурным поражением сердца (ИБС, застойная сердечная недостаточность, кардиомиопатии, пороки сердца) ЖЭ представляют один из компонентов широкого спектра желудочковых нарушений ритма. В этом контексте ЖЭ высоких градаций, короткие эпизоды ЖТ являются потенциально опасными (потенциально злокачественными), даже если не сопровождаются нарушением гемодинамики. В этой группе пациентов маркером большей вероятности развития опасных аритмий является систолическая дисфункция левого желудочка со снижением фракции выброса < 45%.
Лечение
Общие подходы к ведению пациентов с ЖЭ
В отсутствие органического поражения сердца, подавление ЖЭ не влияет на продолжительность жизни, бессимптомным больным лечение не требуется. Таким пациентам необходимо динамическое наблюдение, так как, по данным Фремингемского исследования, ЖЭ может быть дебютом органического заболевания сердца. При плохой субъективной переносимости аритмии может быть полезной психотерапия, седативные средства, коррекция вегетативного дисбаланса (бета-адреноблокаторы или холинолитики); необходимо лечение заболеваний внутренних органов и устранение провоцирующих факторов (кофеин, никотин, психоэмоциональный стресс). В острой ситуации важное значение имеет поиск и коррекция обратимых причин ЖЭ – гипоксии, гипокалиемии, гипомагнезиемии.
«Простые» (одиночные, мономорфные) формы ЖЭ, на фоне сердечно-сосудистой патологии без нарушения гемодинамики и коронарного кровообращения, также не требуют назначения антиаритмических препаратов. Риск побочных эффектов антиаритмических препаратов в этом случае выше потенциальной пользы лечения. В ведении таких больных основная роль принадлежит лечению основного заболевания, а также выяснению и устранению корригируемых причин ЖЭ (электролитных нарушений, применения симпатомиметиков, передозировки сердечных гликозидов).
Потенциально опасными (потенциально злокачественными) являются ЖЭ высоких градаций на фоне структурных заболеваний сердца (частые, политопные, парные ЖЭ, пробежки неустойчивой ЖТ); в этом случае существует реальный риск развития пароксизмов устойчивой ЖТ, трепетания и фибриляции желудочков. Такие пациенты нуждаются, прежде всего, в полноценном лечении основного заболевания с применением подходов и медикаментозных препаратов, улучшающих прогноз (например, у больных ИБС – коррекция факторов риска, применение аспирина, бета-адреноблокаторов, статинов). Необходима также коррекция электролитных нарушений и артериальной гипертензии, так как гипертрофия левого желудочка повышает частоту ЖЭ. При подборе антиаритмической терапии предпочтение отдаётся блокаторам бета-адренорецепторов, в связи с особенностями их механизма действия и доказанной способностью улучшать прогноз больных со структурной патологией миокарда.
При недостаточной эффективности бета-адреноблокаторов показан амиодарон – препарат с наиболее надёжной антиаритмической активностью, антиишемическими свойствами и минимальным аритмогенным действием. Амиодарон является препаратом выбора для лечения больных с клинически значимыми опасными аритмиями на фоне тяжёлого структурного поражения миокарда, в частности, при сердечной недостаточности со снижением фракции выброса левого желудочка. Использование невысокой поддерживающей дозы амиодарона (200 мг/сут) уменьшает риск нежелательных системных побочных эффектов. У больных ИБС вместо амиодарона может применяться соталол. В то же время, оба препарата обладают аритмогенным действием, способны удлинять интервал QT и индуцировать потенциально опасную полиморфную тахикардию (аритмогенный эффект чаще проявляется на фоне терапии соталолом, особенно в первые несколько дней лечения).
У больных сердечной недостаточностью с низкой фракцией выброса левого желудочка показано назначение амиодарона в комбинации с небольшими дозами бета-адреноблокаторов и ингибиторов АПФ.
При неэффективности амедикаментозной терапии больным с прогностически неблагоприятными аритмиями, сочетающимися с пароксизмами ЖТ и фибриляцией желудочков, показано хирургическое лечение (катетерная деструкция аритмического очага, имплантация антитахикардического устройства или кардиовертера-дефибриллятора).
Краткая характеристика антиаритмических препаратов
Класс Iа (новокаинамид, хинидин, дизопирамид) – умеренно эффективен в подавлении ЖЭ, сочетается с проаритмическим эффектом. Новокаинамид часто вызывает аллергические реакции, хинидин плохо переносится, в связи с побочными эффектами.
Класс Ib (мексилетин) – проаритмогенный эффект выражен меньше, чем у препаратов Iа класса (хотя в одном из исследований у больных после инфаркта миокарда смертность при использовании мексилетина была выше, чем на фоне плацебо). Имеет более высокую частоту некардиальных побочных эффектов. У некоторых пациентов может быть высокоэффективным.
Класс Iс (флекаинид, пропафенон, этацизин) – препараты эффективно подавляют ЖЭ и относительно хорошо переносятся пациентами без ИБС с нормальной или минимально сниженной функцией ЛЖ. Их не рекомендуют больным c ИБС, в связи с результатами исследования CAST. По данным исследования CAST, профилактическое назначение антиаритмических препаратов I класса флекаинида и энкаинида для подавления асимптомных ЖЭ высоких градаций у больных, перенесших инфаркт миокарда, сопровождалось достоверным увеличением риска внезапной смерти, по сравнению с плацебо, что объясняют проаритмогенным эффектом препаратов этой группы и их отрицательным инотропным действием.
Класс II (бета-адреноблокаторы) – препараты выбора у симптомных пациентов без структурных заболеваний сердца. Они также показаны больным с кардиальной патологией, в том числе со сниженной фракцией выброса левого желудочка.
Класс III (амиодарон, соталол) – рекомендуются для лечения жизнеопасных аритмий. Амиодарон безопасен у больных с ЖЭ, перенесших инфаркт миокарда, хотя и не снижает у них риск смерти.
Класс IV (блокаторы кальциевых каналов) – обычно не используются для лечения ЖЭ, однако иногда могут подавлять ЖЭ по механизму триггерной активности или идиопатические ЖЭ.
Планируя лечение больного с ЖЭ, нужно тщательно взвесить:
1) симптомы, вызванные ЖЭ;
2) факторы, влияющие на прогноз больного с ЖЭ – наличие структурной патологии сердца, её характер, наличие ИБС, дисфункции левого желудочка;
3) возможные нежелательные явления (особенно проаритмические эффекты антиаритмических препаратов).
Пациент К., 16лет предъявлял жалобы на приступы учащенного сердцебиения, возникающие при умеренной физической нагрузке, сопровождающиеся одышкой, головокружением, потливостью и однократной – потерей сознания; в покое отмечал нерегулярный ритм.
Из анамнеза известно, что впервые вышеописанные жалобы стали беспокоить 4-5 лет назад (т.е. с 11-12-летнего возраста). Около года пациент стал отмечать ухудшение состояния, прогрессирование одышки, приступы учащенного сердцебиения возникали 1 раз в 2 дня, а при выраженной физической нагрузки развился длительный приступ тахикардии с последующей потерей сознания. Госпитализирован, где зарегистрирован пароксизм устойчивой желудочковой тахикардии с частотой 200 уд/мин, который был купирован в/в введением кордарона. В качестве постоянной антиаритмической терапии назначен кордарон в дозе 200 мг/сут в течение 3 месяцев. На фоне проводимой терапии сохранялась частая желудочковая экстрасистолия высоких градаций, однако приступы устойчивой ЖТ не рецидивировали.Из анамнеза жизни известно, что острыми респираторными заболеваниями болеет не чаще 1 раза в год. Наследственность со стороны сердечно-сосудистой патологии не отягощена, случаи внезапной смерти у ближайших родственников также отсутствовали.
Объективный статус при поступлении с НЦССХ им. А.Н. Бакулева РАМН. Состояние удовлетворительное. Рост – 171см, вес – 57кг. Дыхание везикулярное, проводится во все отделы, хрипов нет. ЧДД 15 в мин. Тоны сердца приглушены, аритмичные, ЧСС 57 уд/мин, АД 110/60 мм рт.ст. Печень не увеличена.
Данные инструментальных методов обследования.
ЭКГ: Ритм синусовый, правильный. ЧСС – 58 уд/мин. Положение ЭОС – нормальное. PQ – 160 мс, QRS – 90 мс, QT – 400 мс. Нарушение внутрижелудочкового проведения, инверсия Т волны в отведениях V2-V4, желудочковая экстрасистолия по типу бигеминии с морфологией блокады левой ножки пучка Гиса (рис.1). 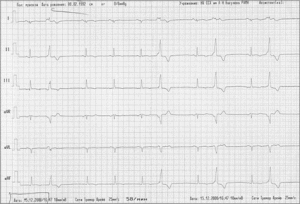
Рис. 1. ЭКГ больного К. с АДПЖ: частая желудочковая экстрасистолия по типу бигеминии, инверсия Т в отведениях V2-V4
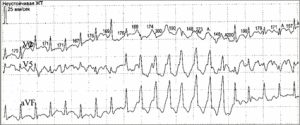
Холтеровское мониторирование: исследование проводилось в течение 23 часа без антиаритмической терапии. За сутки зафиксирован синусовый ритм. Средняя ЧСС 67 уд/мин. Мин. ЧСС 37 уд/мин во время сна. Макс. ЧСС 179 уд/мин при подъеме по лестнице. Наджелудочковая эктопическая активность представлена 54 экстрасистолами. Желудочковая эктопическая активность представлена 6812 ЖЭ 3-х морфологий преимущественно в дневное время. Одиночных – 3644, по типу бигеминии – 1403, по типу тригеминии – 1671, парных – 37. Зарегистрировано 2 эпизода неустойчивой ЖТ по 8 и 9 комплексов (рис. 2). Пауз, изменений ST-T, интервала QT не выявлено.
Рис. 2. Холтеровское мониторирование больного К.: пароксизм неустойчивой ЖТ с частотой 200 уд/мин
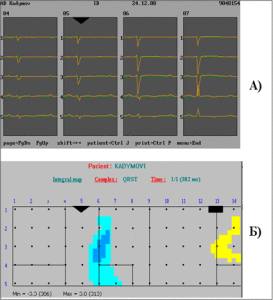
Поверхностное многоканальное ЭКГ-картирование на специализированной компьютерной электрокардиологической системе «Кардиаг” (Чехия): регистрация ЭКГ одномоментно с 80 электродов, расположенных регулярно на всей грудной клетке, 12 общепринятых отведений и 3 ортогональных отведений по Франку с последующей обработкой в персональном компьютере. Исследование проводилось в покое. На ЭКГ на фоне синусового ритма с ЧСС=87 в мин регистрировались единичные ЖЭ двух морфологий. При анализе данных 80 синхронных отведений ЭКГ последовательность возбуждения различных зон миокарда желудочков, «нормальное» или аномальное начало возбуждения миокарда желудочков можно оценить по изопотенциальным картам (рис.3), которые соответствуют началу возбуждения из заднебазальной части межжелудочковой перегородки (МЖП). справа (рис. 3-Б – экстрасистола 1) и из среднебазальной части передней стенки правого желудочка (рис.3-В –экстрасистола 2). Отметим выявленные особенности процесса реполяризации при синусовом сокращении (рис.4.). На ЭКГ QTкорр.= 460 мсек. Было сделано заключение о нарушениях реполяризации в проекции верхушки, передней стенки ПЖ и передней части МЖП, а также о признаках изменений миокарда в средней/3 передней части МЖП.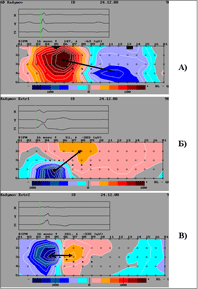 Рис 3. Поверхностное ЭКГ картирование больного К. Изопотенциальные карты, построенные для начальных моментов возбуждения миокарда желудочков .
Рис 3. Поверхностное ЭКГ картирование больного К. Изопотенциальные карты, построенные для начальных моментов возбуждения миокарда желудочков .
А) 16-я мсек от начала комплекса QRS при синусовом сокращении;
Б) Экстрасистолический комплекс 1-й морфологии соответствуют началу возбуждения из заднебазальной части межжелудочковой перегородки;
В) Экстрасистолический комплекс 1-й морфологии соответствуют началу возбуждения из среднебазальной части передней стенки правого желудочка.
Изопотенциальная карта построена на прямоугольной схеме развертки поверхности грудной клетки, разрезанной по правой задне-подмышечной линии. Над картой – момент кардиоцикла, которому она соответствует; ° – точки наложения электродов; √ – положение стернальной линии, · – положение вертебральной линии. Значения потенциала отображаются на карте в виде цвета, характеризующего знак и амплитуду: синяя гамма соответствует отрицательным значениям, красная – положительным; более интенсивный цвет отражает большее значение потенциала. Максимальное и минимальное значения потенциала (в мев) указаны= в цифровой форме. Стрелки направлены от начального минимума поверхностного потенциала в зоне негативности к начальному максимуму в зоне позитивности на изопотенциальных картах.
Рис 4. Поверхностное ЭКГ картирование больного К.
А) ЭКГ. Отрицательные зубцы Т в проекции передней части межжелудочковой перегородки ;
Б) Разностная карта. Отклонения поверхностных проявлений процессов реполяризации от нормального, отрицательные значения обозначены синей гаммой.
ЭхоКГ: Исследование проводилось на фоне частой желудочковой экстрасистолии. ЛП – 3.0 см. ЛЖ: КСР – 2.9 см, КДР – 4.5см, КСО – 32 мл, КДС – 60 мл, ФВ – 65%. Митральный клапан: створки тонике, подвижные, движение разнонаправленное, пролабирование передней митральной створки, ФК 28 мм, регургитации нет. Восходящая аорта – 2.5 см, Аортальный клапан: интактен, ФК 21 мм, регургитации нет.
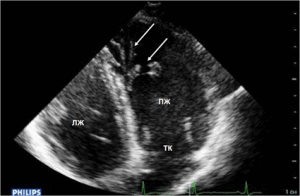
Рис. 5а. ЭхоКГ больного К. Дилатация полости правого желудочка. Стрелками указаны выраженная трабекулярност, правого желудочка, утолщение модераторного тяжа.
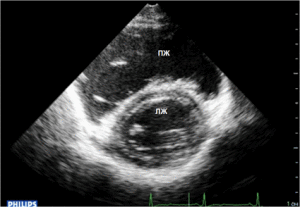
Рис. 5б. ЭхоКГ больного К. Дилатация полости правого желудочка (парастернальная позиция короткой оси левого желудочка на уровне митрального клапана).
Рис. 5в. ЭхоКГ больного К. Расширение выводного отдела правого желудочка.
Расчетное давление в ПЖ – 30 мм. рт.ст. Визуализируется выраженная трабекулярность ПЖ и повышенная эхогенность модераторного тяжа. Снижение скоростных показателей свободной стенки ПЖ и фиброзного кольца ТК в режиме Strain Rate Imaging (рис 5г).
Рис. 5г. ЭхоКГ больного К. Оценка систолической скорости движения свободной стенки ПЖ и МЖП на базальном и среднем уровнях в режиме Strain Rate Imaging. Снижение скоростных показателей свободной стенки ПЖ и фиброзного кольца ТК.
Правое предсердие: 4.5 х 4.2 см. Трикуспидальный клапан: створки тонкие, подвижные. ФК – 36 мм, регургитация 2,5 (+). Легочный клапан: ФК – 25 мм, регургитация 2 ст. МЖП движение правильное. Данных за ВПС не получено. Заключение: Дилатация правых отделов желудочка, снижение сократительной способность ПЖ, ФВ 30%. Недостаточность трикуспидального клапана 2.5 (+). Недостаточность легочного клапана 2 ст.
Рентгенография органов грудной клетки: воспалительных и очаговых изменений не выявлено. Плевральные синусы свободны. Легочный рисунок усилен. Корни легких не изменены. Сердце расположено нормально, размеры не увеличены, КТИ 49%. Сосудистый пучок не изменен. Дуга ЛА умеренно выбухает. Аорта без особенностей. Верхняя полая вена не расширена. Диафрагма без особенностей.
По данным проведенных лабораторных исследований в клинических анализах крови, мочи и биохимическом анализе патологических изменений не выявлено.
На основании клинической картины, лабораторных и инструментальных методов исследования поставлен диагноз: Аритмогенная дисплазия правого желудочка (?). Дилатация полостей правых отделов сердца. Недостаточность трикуспидального клапана 2 ст., недостаточность легочного клапана 2 ст. Нарушения ритма: желудочковая экстрасистолия 5 градации по Лауну. Пароксизмальная желудочковая тахикардия. Синкопальное состояние от марта 2008. НК II по NYHA.
Магнитно-резонансная томография: исследование проводилось на фоне частой ЖЭ. На серии томограмм сердца расположено типично, увеличено в размерах (КТИ = 58%). МР сигнал от миокарда обычный. Диаметр сосудов: ВПВ 12х17 мм, НПВ 15х35 мм, Ао восходящая на уровне бифуркации ствола легочной артерии не расширена до 19 мм, Ао нисх – 15 мм, дуга аорты 19 мм. Ствол ЛА – 14 мм, ПЛА – 11 мм, ЛЛа – 11 мм. Камеры сердца: ПП расширено, 60х36 мм, ЛП 20х30 мм. КДР ЛЖ 45мм, КСР ЛЖ 34мм, КДОЛЖ 155 мл, КСО ЛЖ 68 мл, УОЛЖ 87 мл, ФВ 56%, минутный объем 6.1 л/мин, КИ 3.1 л/мин/м2. КДР ПЖ 42 мм, КСР ПЖ 40 мм, КДО ПЖ 278 мл, КСО ПЖ 231 мл, УОПЖ 47 мл, ФВ ПЖ 17%. Толщина передней стенки ПЖ 2-3 мм, с неравномерным систолическим приращением до 2 мм, отмечается гипокинез стенок ПЖ с наличием мелких участком источения и дискинеза до 2-4 мм (по типу микроаневризм) (рис. 6а,б).
Рис.6а. МРТ сердца пациента К. Дискинез передней стенки ПЖ (отмечены указкой) (фаза диастолы)
Рис.6б. МРТ сердца пациента К. Микроаневризмы передней стенки ПЖ (отмечены указкой) (фаза систолы)
Определяется выраженная трабекулярность ПЖ, утолщение и уплотнение модераторного тяжа. ВОПЖ расширен до 42 мм (рис. 6в,г).
Рис.6в. МРТ сердца пациента К. Расширение выводного отдела ПЖ (продольный срез)
Рис.6г. МРТ сердца пациента К. Расширение выводного отдела ПЖ (поперечный срез)
Жировая инфильтрация миокарда ПЖ (рис. 6д). Толщина МЖП около 7 мм, задней стенки ЛЖ 8 мм, боковой стенки 6 мм, передней стенки 5 мм. В перикарде определяется жидкость с максимальной сепарацией листков перикарда до 4-5 мм. Заключение: Мр- признаки кардиомегалии, дилатации полостей правых отделов сердца, снижение сократительной способности ПЖ (ФВ – 17%); гипокинез с участками неравномерного истончения стенок ПЖ; жировая инфильтрация миокарда ПЖ .
Рис.6д. МРТ сердца пациента К. Участок жира (отмечены стрелками)
Рис. 7а. Ангиокоронарография больного К. Дилатация ПЖ
Рис. 7б. Ангиокоронарография больного К. Расширение выводного отдела.
Электрофизиологическое исследование: исходно регистрируется синусовый ритм. Антеградная точка Венкебаха = 600 мс. АЭРП АВУ = 470 мс, ЭРП ЛП = 210 мс, ЭРП ПП = 260 мс, Ретроградно V-A диссоциация. ЭРП ПЖ = 280 мс. При программированной стимуляции ПЖ S1=300, S2=280, S3=340 индуцируется пароксизмальная форма ЖТ из передней стенки выводного отдела ПЖ с ДЦ = 300 мс, самостоятельно купирующаяся через 3 сек.
В результате детального обследования больного были выявлены следующие диагностические критерии АДПЖ: выраженная дилатация и снижение систолической функции ПЖ при отсутствии изменений ЛЖ; локализованные аневризмы ПЖ; инверсия Т волны в соответствующих отведениях; неустойчивая ЖТ с морфологией блокады левой ножки пучка Гиса (документированная при Холтеровском мониторировании)
Так как данная патология характеризуется прогрессирующим замещением (вначале очаговым, затем диффузным) миокарда правого желудочка жировой и соединительной тканью и проявляется угрожающими желудочковыми аритмиями, больному была выполнена операция радиочастотной аблации очагов эктопических желудочковых аритмий из правого желудочка и подобрана антиаритмическая терапия (кордарон 200 мг/сут), однако при суточном холтеровском мониторировании ЭКГ продолжали регистрироваться эпизоды желудочковой тахикардии.
С целью вторичной профилактики ВСС больному был имплантирован автоматический кардиовертер дефибриллятор Medtronic GEM III VR 7231 Сх с первичной эндокардиальной системой.
Послеоперационный период протекал без осложнений. Пациент отмечал улучшение самочувствие и отсутствие приступов устойчивой желудочковой тахикардии. Положительная динамика так же была подтверждена по данным ЭКГ и холтеровского мониторирования (желудочковая эктопическая активность представлена ЖЭ 2-х морфологий, из них: одиночных – 1227, по типу би- и тригеминии – 95, парных – 46, триплетов -6). За время пребывания в стационаре разряды дефибриллятора не зарегистрированы.
Насколько приведенное нами наблюдение является типичным для АДПЖ? Каковы современные тенденции в лечении данного заболевания? И наконец, претерпели ли эволюцию наши взгляды на его патогенез, принципы диагностики, лечения и возможные предикторы внезапной сердечной смерти?
Читайте на страницах журнала «Креативная кардиология».