Одди сфинктер
Сфинктер Oдди (СО) выполняет координирующую функцию, регулируя ток желчи от печени по желчному тракту в двенадцатиперстную кишку. СО играет также важную роль в регуляции деятельности желчного пузыря и поступлении в кишку панкреатического секрета. На эвакуацию содержимого (через большой дуоденальный сосочек в двенадцатиперстную кишку) существенное влияние оказывает двигательная активность желудочно–кишечного тракта. Расстройство функции СО может привести к различным нарушениям этой системы. Клинически это проявляется приступами боли верхних отделах живота, кратковременным подъемом печеночных ферментов, расширением общего желчного протока, повышением панкреатических ферментов или эпизодами панкреатита.
Причины этих нарушений могут быть как структурными (например, стеноз СО), так и функциональными. В настоящее время, в соответствии с Римским консенсусом 1999 г. (Рим II), среди функциональных расстройств билиарного тракта рекомендовано выделять дисфункцию сфинктеpa Одди .
Сфинктер Одди – это фиброзно–мышечный футляр, окружающий конечные участки общего желчного и панкреатического протоков и общий канал в месте их прохождения через стенку двенадцатиперстной кишки (рис. 1).
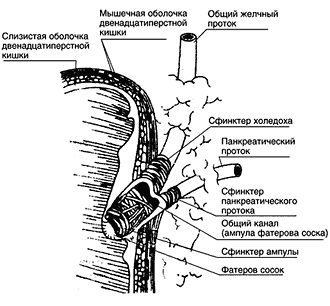
Рис. 1. Схема анатомического строения сфинктера Одди (по M.T. Smith, 1999)
Соответственно выделяют три сегмента:
- сфинктерный сегмент общего желчного протока, окружающий его дистальную часть;
- сфинктерный сегмент протока поджелудочной железы (ПЖ), окружающий проток ПЖ;
- сфинктер ампулы, окружающий общий канал, который образуется при слиянии общего желчного протока и протока ПЖ.
Гладкомышечные волокна сфинктера располагаются как продольно, так и циркулярно и регулируют давление в протоковой системе. Базальное тоническое напряжение в покое поддерживается на уровне 10–15 мм рт.ст. Манометрические исследования показывают, что длина физиологической части сфинктера составляет примерно 8–10 мм и может быть меньше, чем его истинная анатомическая длина .
Сфинктер Одди выполняет 3 основные функции:
- регулирует ток желчи и панкреатического сока в двенадцатиперстную кишку;
- предотвращает рефлюкс содержимого двенадцатиперстной кишки в общий желчный и панкреатический протоки;
- обеспечивает накопление в желчном пузыре печеночной желчи.
Эти функции связаны со способностью сфинктера регулировать градиент давления между системой протоков и двенадцатиперстной кишкой. Координированная сократительная активность желчного пузыря и сфинктера Одди обеспечивает наполнение желчного пузыря в период между приемами пищи.
Дисфункция сфинктера Одди (ДСО) – термин, используемый для определения нарушения функции СО. ДСО характеризуется частичным нарушением проходимости протоков на уровне сфинктера и может иметь как органическую (структурную), так и функциональную (нарушение двигательной активности) природу и клинически проявляться нарушением оттока желчи и панкреатического сока.
Больных с ДСО можно разделить на 2 группы: 1) пациенты с ДСО на фоне стеноза сфинктера; 2) пациенты с первично–функциональной природой дискинезии сфинктера. Истинный анатомический стеноз сфинктера Одди и большого дуоденального соска возникает вследствие воспаления и фиброза, а также возможной гиперплазии слизистой оболочки. Развитию воспалительных и фиброзных изменений способствуют прохождение мелких камней по общему желчному протоку или (предположительно) рецидивы панкреатита. Как правило, отграничить функциональный стеноз сфинктера Одди от органического достаточно сложно, поскольку оба состояния могут быть обусловлены одними и теми же факторами.
ДСО весьма часто проявляется у лиц, перенесших холецистэктомию. Большинство случаев так называемого постхолецистэктомического синдрома обусловлено именно развитием ДСО. По данным У. Лейшнера (2001), у 40% больных, которым проводится стандартная холецистэктомия по поводу камней желчного пузыря, после операции сохраняются клинические симптомы. У 40–45% больных причиной жалоб служат органические нарушения (стриктуры желчных путей, нераспознанные камни общего желчного протока, предшествующие заболевания желудочно–кишечного тракта и др.), у 55–60% – функциональные.
Для большинства больных, перенесших холецистэктомию, характерна недостаточность сфинктера Одди с непрерывным истечением желчи в просвет двенадцатиперстной кишки. Однако может отмечаться и его спазм. После удаления желчного пузыря даже умеренное сокращение сфинктера Одди может привести к существенному повышению давления во всем желчном тракте. В результате может появиться боль, что подтверждается в экспериментах с введением морфина, повышающего давление в желчных путях.
В Римском консенсусе II (1999) приводятся следующие критерии диагностики ДСО.
Эпизоды выраженной, устойчивой боли, локализованные в эпигастрии и правом верхнем квадранте живота, и все следующие признаки:
1) болевые эпизоды длятся 30 мин или больше, чередуясь с безболевыми интервалами;
2) развитие одного или более приступов в течение предшествующих 12 месяцев;
3) боль устойчива и нарушает трудовую деятельность или требует консультации с врачом;
4) отсутствуют данные за структурные изменения, которые могли бы объяснить эти признаки.
Кроме того, боль может быть связана с одним или более признаками: повышение сывороточных трансаминаз, щелочной фосфатазы, g–глутамилтранспептидазы, прямого билирубина и/или панкреатическими ферментами (амилазы/липазы).
С учетом различий в клинической картине больных с ДСО выделяют 2 большие категории: 1) пациенты с дисфункцией желчного сегмента сфинктера Одди (большинство); 2) пациенты с преимущественной дисфункцией панкреатического сегмента сфинктера Одди (меньшая часть).
Изучение клинической картины, данных лабораторных исследований и результатов, получаемых при проведении ЭРПХГ и сфинктерной манометрии, позволило подразделить пациентов ДСО на следующие группы:
1. Билиарный тип I – включает:
– наличие типичных приступов желчной колики;
– расширение общего желчного протока (> 12 мм);
– замедленное выведение контрастного вещества при ЭРПХГ (> 45 мин);
– изменение уровня печеночных ферментов (2–кратное превышение нормального уровня трансаминаз и/или щелочной фосфатазы, по крайней мере, при 2–кратных исследованиях).
Причиной дисфункции сфинктера Одди этой группы чаще всего является стеноз сфинктера. Манометрическое доказательство ДСО обнаруживается у 65–95% пациентов и подтверждает предположение о структурных изменениях сфинктера (стенозе).
2. Билиарный тип II – типичный приступ желчных болей в сочетании с одним или двумя другими критериями I типа. У пациентов II билиарного типа нарушения могут быть как структурными, так и функциональными. Манометрическое доказательство – наличие ДСО у 50–63% пациентов.
3. Билиарный тип III – только типичный приступ желчных болей без каких–либо объективных нарушений, характерных для I типа. В III группе ДСО обычно носит функциональный характер. Только 12–28% пациентов этой группы имеют манометрическое подтвеждение дисфункции сфинктера Одди .
4. Панкреатический тип ДСО клинически проявляется характерной для панкреатита эпигастральной болью, которая часто иррадиирует в спину, и сопровождается значительным повышением сывороточной амилазы и липазы. Поскольку отсутствуют традиционные причины панкреатита (холелитиаз, злоупотребление алкоголем и другие известные причины панкреатита), в этих случаях обычно устанавливается неопределенный диагноз идиопатического рецидивирующего панкреатита. В общей группе пациентов с идиопатическим рецидивирующим панкреатитом манометрическое исследование выявляет ДСО в 39–90% случаях .
Поводом для углубленного обследования с целью выявления ДСО является: наличие у пациентов эпизодических болей, похожих на боли, возникающие при заболеваниях желчного пузыря, но отрицательных по результатам диагностических тестов (включая УЗИ и исследование пузырной желчи на микрокристаллы); наличие у пациентов постхолецистэктомических болей в животе; больные с идиопатическим рецидивирующим панкреатитом.
Первоначально диагноз ДСО основывался только на клинических проявлениях. Позднее было описано несколько диагностических тестов, помогающих выявить ДСО, однако ни один из ныне применяемых тестов не идеален, а диагностическая ценность их остается спорной.
Лабораторные исследования могут иметь значение только в том случае, если они проводятся во время или сразу после болевого приступа. При остром приступе болей у некоторых пациентов определяется транзиторное повышение уровня печеночных ферментов (ACT, ЩФ, ГГТП) и/или ферментов поджелудочной железы (амилазы, липазы). Транзиторное повышение уровня печеночных или панкреатических ферментов (в 2 раза и более) во время болевого приступа указывает на наличие препятствия в протоках, что, однако, не является строго специфичным для дисфункции сфинктера Одди. Необходимо исключить другие причины нарушения проходимости желчных протоков (в частности, холедохолитиаз).
К неинвазивным тестам принадлежит применение ультразвукового сканирования для определения диаметра общего желчного и/или панкреатического протоков до и после введения провокационных агентов. Ультразвуковое сканирование с жирной пищей включает прием жиров для стимуляции выработки эндогенного холецистокинина и усиления желчеотделения. Диаметр желчных протоков измеряют с интервалом в 15 мин в течение 1 ч. В норме диаметр желчных протоков не изменяется или несколько уменьшается. Увеличение диаметра на 2 мм и более по сравнению с исходным позволяет предположить наличие неполной закупорки желчных путей, но не предоставляет возможности дифференцировать ДСО от других причин нарушения проходимости желчных протоков (например, от закупорки их конкрементами, стриктурами, опухолями). Чувствительность и специфичность данного теста пока точно не определены.
В настоящее время наиболее приемлемой для практического использования, особенно при недоступности эндоскопической манометрии или в качестве скринингового обследования, перед проведением манометрии, является проведение гепатобилиарной сцинтиграфии. Холесцинтиграфия позволяет определить время транзита изотопа с желчью от печени до двенадцатиперстной кишки. Задержка транзита может свидетельствовать в пользу ДСО.
Показано, что существует тесная корреляция между результатами холесцинтиграфии и результатами манометрического исследования сфинктера Одди .
К инвазивным методам изучения функции СО относятся: эндоскопическая ретроградная холангиопанкреатография (ЭРХПГ) и эндоскопическая манометрия сфинктера Одди.
ЭРПХГ – помогает исключить другие заболевания поджелудочной железы и желчных путей, вызывающие сходный болевой синдром (например, закупорку протока конкрементом, стриктуры протоков, опухоли фатерова соска и хронический панкреатит). Посредством этого метода также определяют диаметр протоков и время их опорожнения.
Эндоскопическая манометрия СО – в настоящее время рассматривается, как наиболее достоверный метод изучения функции сфинктера. Данный метод включает прямое измерение давления сфинктера с помощью специального трехпросветного катетера, вводимого через дуоденоскоп в общий желчный или панкреатический протоки. Проксимальный конец катетера соединен с наружным преобразователем и пишущим устройством. Давление сфинктера измеряется во время медленного низведения катетера из протока и установления его в зоне сфинктера. При помощи эндоскопической манометрии исследуют некоторые показатели, отражающие двигательную активность сфинктера. Сначала определяется базальное давление сфинктера, после чего регистрируются накладывающиеся фазово–волновые изменения давления, а также амплитуда, частота и направление распространения фазовых волн. Нормальным показателем давления в общем желчном протоке служит давление, превышающее таковое в двенадцатиперстной кишке на 10 мм рт.ст. Давление в СО, составляющее в обычных условиях 18±4 мм рт.ст., повышается при его спастических сокращениях до 110±25 мм рт.ст. .
Признаками ДСО при манометрическом исследовании являются; а) повышение базального давления в просвете сфинктеров; б) увеличение амплитуды и частоты фазовых скращений (тахиоддия); в) увеличение частоты ретроградных сокращений; г) парадоксальный ответ на введение аналогов холецистокинина.
Однако проведение этого непростого исследования даже опытным специалистом, бывает успешным лишь в 80–90% случаев. У 2–10% пациентов после этого исследования развивается панкреатит, частота которого превышает таковую после ЭРХПГ.
Манометрия до начала лечения необходима отнюдь не у всех пациентов с предполагаемой дисфункцией сфинктера Одди. Назначение манометрии СО обычно основывается на тяжести клинических проявлений, выраженности ответной реакции организма на консервативную терапию. Манометрия позволяет точно установить диагноз до начала применения более радикальных методов лечения.
В манометрии не нуждаются пациенты с дисфункцией сфинктера Одди билиарного типа I, изменения у которых выявляют примерно в 80–90% случаев. Эндоскопическая сфинктеротомия у них оказывается эффективной более чем в 90% случаев (даже если результаты манометрии сфинктера Одди имеют вариант нормы). Обычно нет необходимости проводить исследование при билиарном типе III ДСО, поскольку патологические изменения функции СО у них выявляются редко, а опасность осложнений в результате исследования достаточно велика. Напротив, у пациентов с билиарным типом II заболевания проведение манометрического исследования считают обязательным, т.к. только у 50% этих пациентов повышен уровень базального давления сфинктера. Труднее принять решение о проведении ЭРХПГ и манометрического исследования СО у пациентов с панкреатическим типом заболевания. У этих пациентов велик риск развития панкреатита, связанного с проведением исследования .
Лечение
Методы лечения дисфункции сфинктера Одди можно разделить на неинвазивные и инвазивные.
Консервативное (неинвазивное) лечение
Лечение всегда следует начинать с назначения диеты и курса медикаментозной терапии.
Диета должна иметь низкое содержание жира. В пищевой рацион следует добавлять пищевые волокна в виде продуктов растительного происхождения или пищевых добавок (отруби и др.). При этом овощи, фрукты, травы – лучше использовать термически обработанными (отварные, запеченные).
Фармакотерапия в первую очередь должна быть направлена на снятие спазма гладкой мускулатуры. С этой целью используют ряд препаратов, обладающих спазмолитическим эффектом.
Нитраты: нитроглицерин используют для быстрого купирования болей, нитросорбид – для курсового лечения. Однако выраженные кардиоваскулярные эффекты и развитие толерантности делают их малоприемлемыми для длительной терапии билиарной дискинезии.
Антихолинергические средства, блокирующие мускариновые рецепторы на постсинаптических мембранах органов–мишеней, и как следствие – снятие мышечного спазма. В качестве спазмолитиков используют препараты красавки, метацин, платифиллин, бускопан и др. Однако при приеме препаратов данной группы может наблюдаться ряд общеизвестных побочных эффектов. Сочетание довольно низкой эффективности с широким спектром побочных эффектов ограничивает их применение при ДСО.
Блокаторы медленных кальциевых каналов – веропамил, нифедипин, дилтиазем и др. вызывают релаксацию гладкой мускулатуры. Препараты обладают многочисленными кардиоваскулярными эффектами, в первую очередь, вазодилатирующими, в связи с чем они не нашли широкого распространения при лечении ДСО.
Основными недостатками препаратов всех вышеуказанных групп являются: а) отсутствие селективного эффекта на СО; б) существенные различия индивидуальной эффективности при лечении ДСО; в) наличие нежелательных эффектов, обусловленных воздействием на гладкую мускулатуру сосудов, мочевыделительной системы и всех отделов пищеварительного тракта.
Миотропные сназмолитики снижают тонус и двигательную активность гладкой мускулатуры. Основными представителями данной группы препаратов являются папаверин, дротаверин, бенциклан.
Наиболее эффективным миотропным спазмолитиком является мебеверин – мышечнотропный, антиспастический препарат, обладающий прямым действием на гладкую мускулатуру. Мебеверин обладает избирательным действием в отношении СО, он в 20–40 раз эффективнее папаверина по способности релаксировать СО. Кроме того, мебеверин обладает нормализующим действием на кишечник – препарат устраняет гиперперисталътику и спазм двенадцатиперстной кишки, не вызывая гипотонии. Норморелаксирующий эффект мебеверина обусловлен двойным механизмом его действия. Во–первых, препарат оказывает антиспастический эффект, блокируя приток ионов натрия и нарушая вход в клетку ионов кальция, что препятствует возникновению деполяризации мембран мышечных клеток и сокращению мышечных волокон. Во–вторых, снижая наполнение в клеточных депо ионов кальция, мебеверин непрямым образом уменьшает отток ионов калия и, соответственно, не вызывает гипотонию .
Другим миотропным спазмолитиком, обладающим селективным действием, является препарат гимекромон (Одестон). Гимекромон – фенольное производное кумарина, не имеет свойств антикоагулянтов, обладает выраженным спазмолитическим и желчегонным действием. Гимекромон является синтетическим аналогом умбеллиферона, обнаруженного в плодах аниса и фенхеля, которые применялись в фармации как спазмолитические средства.
Механизм действия препарата основан на особенностях его взаимоотношений с холецистокинином (ХК) на различных уровнях билиарного тракта. На уровне сфинктера Одди действует синергетично с ХК, снижает базальное давление и пролонгирует время открытия сфинктера Одди, тем самым увеличивая пассаж желчи по желчным путям. Будучи высокоселективным спазмолитиком, Одестон обладает также желчегонными свойствами. Холеретический эффект обусловлен ускорением и увеличением поступления желчи в тонкую кишку. Увеличение поступления желчи в просвет двенадцатиперстной кишки способствует улучшению процессов пищеварения, активизации кишечной перистальтики и нормализации стула .
Одестон назначают по 400 мг (2 таблетки) 3 раза в день за 30 мин до приема пищи, что обеспечивают относительно постоянную концентрацию препарата в сыворотке, превышающую 1,0 мкг/мл. Продолжительность лечения индивидуальная (от 1 до 3 нед).
В наших наблюдениях при назначении Одестона в виде монотерапии в дозировке 400 мг (2 таб.) 3 раза в день в течение 3 нед. больным с дискинезией сфинктера Одди III билиарного типа (19 больных) и ДСО как проявление постхолецисэктомического синдрома (32 больных) положительный эффект был получен во всех случаях. Препарат Одестон хорошо переносился больными, ни в одном случае его назначения побочных эффектов не наблюдалось. Результаты исследования представлены в таблице.

Инвазивные методы лечения
Инвазивные методы лечения рекомендованы пациентам с более выраженной симптоматикой. При неэффективности консервативной терапии, а также при подозрении на стеноз СО большинство пациентов нуждаются в эндоскопической папиллосфинктеротомии. При этом у больных с I билиарным типом заболевания хороший эффект наблюдается в 90% случаев. У пациентов с заболеванием II билиарного типа и повышенным базальным давлением сфинктера Одди (по результатам манометрии) эффективность папиллосфинктеротомии достигает 92%. Частота выявления нарушений при манометрии у пациентов с III билиарным типом заболевания весьма вариабельна (7–55%), положительный эффект возможен только у половины пациентов с заболеванием, а риск операции достаточно высок. Поэтому папиллосфинктеротомия при III билиарном типе практически не используется .
Инвазивные методы лечения рекомендованы пациентам с более выраженной симптоматикой. При неэффективности консервативной терапии, а также при подозрении на стеноз СО большинство пациентов нуждаются в . При этом у больных с I билиарным типом заболевания хороший эффект наблюдается в 90% случаев. У пациентов с заболеванием II билиарного типа и повышенным базальным давлением сфинктера Одди (по результатам манометрии) эффективность папиллосфинктеротомии достигает 92%. Частота выявления нарушений при манометрии у пациентов с III билиарным типом заболевания весьма вариабельна (7–55%), положительный эффект возможен только у половины пациентов с заболеванием, а риск операции достаточно высок. Поэтому папиллосфинктеротомия при III билиарном типе практически не используется .
Больные с рецидивирующим панкреатитом, обусловленным ДСО, обычно со стенозом панкреатического сфинктера, также являются кандидатами для проведения папиллосфинктеротомии. Однако из–за высокого процента осложнений, показания к папиллосфинктеротомия при панкреатическом типе ДСО должны ставиться очень взвешенно.
Эндоскопическая баллонная дилатация и установление временных катетеров–стентов составляют альтернативу папиллосфинктеротомии. Однако действенность баллонной дилатации в лечении пациентов с дисфункцией сфинктера Одди пока не доказана, и в настоящее время ее применение ограничено. Метод установления временных катетеров–стентов в общий желчный или панкреатический протоки целесообразно использовать у пациентов с нерасширенными желчными протоками, поскольку у них трудно прогнозировать исход папиллосфинктеротомии и, кроме того, высок риск возникновения панкреатита. Установка катетеров–стентов также не принадлежит к категории абсолютно безопасных методов .
Относительно новым, на стадии клинического изучения, методом лечения является инъекция ботулинистического токсина в дуоденальный сосок. Через 3–9 мес. эффект действия ботулинистического токсина исчезает. Ботулинистический токсин ведет к обратимому торможению выделения ацетилхолина в локальных двигательных нейронах, в результате чего происходит снижение тонуса СО. На сегодняшний день данный метод не имеет широкого распространения в клинической практике .
Таким образом, использование современных методов диагностики дисфункции сфинктера Одди с учетом клинических особенностей течения болезни позволяет у большинства больных своевременно диагностировать эту патологию.
Появление эффективных лекарственных препаратов с различным, а иногда и сочетанным механизмом действия, позволяет подобрать адекватную терапию, тем самым значительно улучшить самочувствие и качество жизни пациентов с функциональными нарушениями билиарного тракта. Инвазивные методы лечения следует использовать только при подтверждении стеноза сфинктера Одди.
3. Лейшнер У. Практическое руководство по заболеваниям желчных путей. – М.: ГЭОТАР Медицина, 2001. – 264 с.
8. Geenen J.E., Hogan W.J., Dodds W.J. Sphincter of Oddi // Gastroenterological Endoscopy. – Philadelphia: Sounders; 1987. – P. 735.
11. Lehman G.Y., Sherman S. Sphincter of Oddi dysfunction // Int. J. Poncreatol. – 1996. –Vot.20. – P. 11–25.
Рекомендуется частое питание с равномерными интервалами в течение дня для предупреждения сгущения желчи. Также необходимо избегать приема пищи, которая провоцирует боль (жареная, жирная).
Содержание
II. Фармакотерапия
1. Препараты, увеличивающие сократимость желчного пузыря (прокинетики), применятся обычно в виде курсового лечения в течение месяца и назначаются до еды.
Цизаприд действует через селективную стимуляцию освобождения ацетилхолина из постганглионарных нервных окончаний. Средние дозы составляют 10 мг 3 раза в день. Тримебутин действует как энкефалиновый агонист и оказывает прямой прокинетический эффект на гладкомышечные клетки. Суточная доза 300–600 мг делится на 3 приема. Одновременно с прокинетиками целесообразно применять препараты, оказывающие спазмолитический эффект на сфинктер Одди (мебеверин 100–300 мг в сутки или пинавреиум 150–200 мг в сутки).
2. Препараты, влияющие на наполнение желчного пузыря. Экстракт Fumaria officinalis (дымянка лекарственная) обладает амфохолеретической активностью: при гиперхолерезисе замедляет, а при гипохолерезисе увеличивает продукцию желчи. Другим свойством является спазмолитический эффект на сфинктер Одди. Fumaria officinalis входит в состав комбинированного препарата «Гепабенеi», который при дисфункции желчного пузыря назначают по 1–2 капсулы 3–4 раза в день в течение месяца.
3. Уменьшение висцеральной гипералгезии или воспаления. С этой целью используются нестероидные противовоспалительные препараты в стандартных дозировках.
III. Хирургическое лечение.
При неэффективности медикаментозного лечения и упорном течении болевого синдрома решается вопрос о проведении холецистэктомии, преимущество отдается лапароскопической холецистэктомии.
Основная цель лечения – снизить резистентность току желчи и секрету поджелудочной железы.
I. Диета
Рекомендации те же, что и при дисфункции желчного пузыря.
Применение медикаментозного лечения при дисфункции сфинктера Одди обосновано в тех случаях, когда подтвержден спазм сфинктера. При наличии стеноза проводится сфинктеротомия.
Используются селективные М-холиноблокаторы (бускопан внутрь в дозе 10–20 мг 3–5 раза в день или парентерально), спазмолитики (Fumaria officinalis , мебеверин, пинавериум). Нифедипин также приводит к снижению тонуса сфинктера и могут временно облегчать симптомы.
В последние время появились сообщения о применении ботулотоксина – потенциального ингибитора освобождения ацетилхолина. Введение болтулотоксина в сфинктер вызывает снижение давления в нем, улучшение тока желчи и купирование симптоматики.
III. Эндоскопическая сфинктеротомия – наиболее широко используемая процедура для больных с билиарноподобным вариантом дисфункции. Ее клиническая эффективность, т.е. полное исчезновение симптоматики, отмечено у 55–95% больных.
При панкреатитоподобном варианте проводится трансдуоденальная сфинктеротомия или септопластика панкреатического протока, клиническая эффективность которых составляет около 70%.
Дифференциальный диагноз желчнокаменной болезни
Дифференциальный диагноз желчнокаменной болезни с функциональными билиарными расстройствами основывается на некоторых клинических данных. Приступу острых болей в этом случае нередко предшествует нервно-эмоциональное перенапряжение. Боли не носят длительного, упорного характера, приступ не сопровождается лейкоцитозом, увеличением СОЭ, температура тела не повышается выше 37,5 °С.
Приступы билиарной боли, в т.ч. и при желчекаменной болезни необходимо дифференцировать также от острых болей другого происхождения, связанных с заболеваниями почек, кишечника, червеобразного отростка. При почечной колике боли, как правило, иррадиируют вниз живота: в паховую область, промежность, бедро; в момент приступа наблюдается поллакиурия. Наибольшую дифференциально-диагностическую ценность в этих случаях приобретает эхография.
Кроме того, следует проводить дифференциальную диагностику желчекаменной болезни с пептическими язвами желудка и 12-перстной кишки, панкреатитом. В этих случаях, кроме данных анамнеза, важное значение имеют результаты эндоскопического и ультразвукового исследований.
Приступы билиарной боли в редких случаях могут быть вызваны гельминтами (печеночная двуустка, аскариды и др.), прохождением кровяных сгустков по желчным путям.
Механическую желтуху, обусловленную закупоркой общего желчного протока камнем, необходимо дифференцировать от желтухи, обусловленной острым вирусным гепатитом, гемолитической анемией. В ряде случаев желтуху при холелитиазе, особенно у пожилых людей, трудно отдифференцировать от желтухи, возникшей в результате сдавления или прорастания общего желчного протока опухолью головки поджелудочной железы, обусловленной раком желчного пузыря. В подобных случаях наблюдается медленное развитие желтухи, непосредственно перед ее появлением не отмечается типичного приступа билиарной боли, наблюдается общее истощение больного, резкое увеличение СОЭ.
Значительно реже возникают трудности при разграничении холелитиаза и правосторонней нижнедолевой крупозной пневмонии, особенно у пожилых людей. В этом случае решающее значение имеют результаты физикального и рентгенологического исследований легких.
Дифференциальную диагностику хронического панкреатита в первую очередь необходимо проводить с опухолью поджелудочной железы. Нередко приходится дифференцировать хронический панкреатит от хронического холецистита и желчнокаменной болезни, гастродуоденита и пептических язв желудка и 12-перстной кишки, при которых наблюдаются боли в верхней половине живота, по характеру напоминающие таковые при хроническом панкреатите. Диспепсические явления, симптомы нарушенного пищеварения и всасывания, наблюдающиеся при панкреатите, часто становятся причиной необходимости дифференцирования этого заболевания от хронического энтерита и энтероколита, глютеновой болезни и дисахаридазодефицитных энтеропатий, некоторых других заболеваний кишечника, в том числе и от паразитарных (амебиаз, лямблиоз и др.).
В редких случаях, хронический панкреатит необходимо дифференцировать от гемохроматоза, хотя клиническая картина последнего весьма яркая: бронзовая окраска кожи, увеличенная плотная печень, диабет и др. Но наиболее наглядный признак — своеобразный цвет кожных покровов — в отдельных случаях недостаточно ярко представлен, в некоторых других маскируется сильным загаром или темным цветом кожи, характерным для некоторых народов (жители Африки, Средней Азии и др.). Увеличение печени, наличие симптомов поражения поджелудочной железы, включая сахарный диабет, можно рассматривать как следствие таких общих причин, как алкоголизм и грубые нарушения характера питания. Однако высокое содержание сывороточного железа (в 3-5 раз выше нормы) сразу обращает внимание, и у врача возникает предположение о гемохроматозе. Пункционная биопсия и гистологическое исследование биоптатов печени, кожи позволяют выявить характерное для гемохроматоза высокое содержание гемосидерина в клетках, после чего диагноз становится окончательно ясным.
У значительной части больных после холецистэктомии развивается дисфункция сфинктера Одди (ДСО) .
Согласно Римскому консенсусу III (2006 г.) под дисфункцией сфинктера Одди понимают нарушение его сократительной функции, препятствующее нормальному оттоку желчи и панкреатического секрета в двенадцатиперстную кишку .
Синдром абдоминальной боли
Считают, что в первый месяц после холецистэктомии более чем у 80% больных преобладает гипертонус сфинктера Одди, что связано с выключением регулирующей роли сфинктера Люткенса . Болевой синдром при наличии дисфункции сфинктеров в большинстве случаев обусловлен спазмом сфинктера Одди.
Диагностические критерии дисфункции сфинктера Одди :
1) эпизоды выраженной боли, локализованной в эпигастрии или правом подреберье, в сочетании со всеми следующими признаками;
2) продолжительность 30 мин и более;
3) частота развития симптомов: 1 раз и более за последние 12 мес;
4) интенсивность боли значительная: нарушает ежедневную активность и требует обращения за медицинской помощью;
5) отсутствуют структурные изменения, которые объясняли боль.
Следует помнить, что клинические симптомы (в первую очередь абдоминальные боли) после удаления желчного пузыря наблюдаются в 70–80% случаев и могут быть обусловлены целой группой причин, среди которых наиболее значимыми являются: диагностические ошибки, допущенные на дооперационном этапе во время обследования больного и/или во время операции; обострение или прогрессирование существовавших до операции заболеваний гепатопанкреатобилиарной зоны, технические погрешности и тактические ошибки, допущенные при проведении операции . Клинические симптомы могут быть обусловлены недиагностированными и некорректированными заболеваниями, существовавшими еще в предоперационный период (хронические заболевания печени, стриктуры, стенозы желчных путей, как врожденного, так и приобретенного характера, камни желчных протоков, холангит, панкреатиты, доброкачественные и злокачественные опухоли поджелудочной железы, особенно с локализацией процесса в области головки, заболевания желудка и двенадцатиперстной кишки, включая эрозивно-язвенные изменения, а также пара- и перипапиллярные дивертикулы двенадцатиперстной кишки. Ошибки, допущенные во время холецистэктомии: невыявленные камни в общем желчном протоке, повреждение протоков, оставление длинной культи пузырного протока и др. .
В силу указанных причин постановка диагноза «дисфункция сфинктера Одди» требует тщательного обследования больного. В качестве скрининговых диагностических методов используют лабораторные тесты (общий анализ крови, определение уровней гамма-глютамилтранспептидазы, щелочной фосфатазы, билирубина, аспартатаминотрансферазы, аланинаминотрансферазы, амилазы) и инструментальные методы диагностики (ультразвуковое исследование, эзофагогастродуоденоскопия, дуоденография). Применение высокоинформативных методов диагностики (эндоскопическая ретроградная холангиопанкреатография, магнитно-резонансная холангиография, эндоскопическая ультрасонография и др.) позволяет проводить своевременную и адекватную коррекцию анатомо-функциональных нарушений, развившихся после холецистэктомии или усугубленных ею. Для подтверждения дисфункции сфинктера Одди применяют эндоскопическую манометрию сфинктера .
В 2006 г. рабочей группой экспертов по функциональным расстройствам желудочно-кишечного тракта (ЖКТ) подготовлен Римский консенсус III, в соответствии с которым в рубрику Е «Функциональные расстройства сфинктера Одди» включены разделы: Е2 «Функциональное расстройство билиарного и панкреатического типов» .
Больные с билиарным типом дисфункции сфинктера Одди распределяются на три группы, представленные в таблице, тактика ведения которых существенно различается.
Аналогичная классификация используется у больных с панкреатическим типом дисфункции сфинктера Одди. В этих случаях большое значение придается не менее чем двукратному повышению уровня панкреатических ферментов в крови в период двух последовательных приступов болей, а также расширению панкреатического протока более 5 мм.
Больным 1-й группы, имеющим стеноз сфинктера Одди и высокую вероятность дисфункции сфинктера Одди (> 70%), проводится эндоскопическая сфинктеротомия без предварительного манометрического исследования, что уменьшает частоту осложнений.
У больных 2-й группы только в 50% случаев при манометрическом исследовании выявляется дисфункция сфинктера Одди. Большинство исследователей полагают, что этой группе больных необходимо провести предварительное медикаментозное лечение и лишь при его неэффективности проводить манометрию сфинктера Одди.
В 3-й группе больных причины болей в большинстве случаев обусловлены дискинезией сфинктера Одди, и, следовательно, манометрия последнего не показана.
Синдром избыточного бактериального роста и метаболизм желчных кислот в кишечнике
При наличии спазма сфинктера Одди в пищеварительный период нарушается пассаж желчи по кишечнику, сопровождающийся разнообразными проявлениями нарушения пищеварения. Нерегулярное поступление желчных кислот нарушает энтерогепатическую циркуляцию желчных кислот, переваривание и всасывание жиров, уменьшает бактерицидные свойства дуоденального содержимого, способствуя нарушению микробиоценоза тонкой кишки. В случае недостаточности сфинктера Одди, который при отсутствии резервуарной функции желчного пузыря не способен выдержать повышенное давление (более 300–350 мм вод. ст.) в общем желчном протоке, отмечается постоянное поступление желчных кислот в кишечник, что может быть причиной развития холагенной диареи .
Следует отметить, что при обоих типах дисфункции (спазм, недостаточность) наблюдается ряд симптомов, свидетельствующих о нарушении метаболизма желчных кислот в кишечнике (диспепсический симптомокомплекс). Основная роль в развитии указанных нарушений принадлежит изменению состава кишечной микрофлоры.
У здорового человека при наличии желчного пузыря синтезированные в гепатоцитах первичные желчные кислоты экскретируются в желчь конъюгированными с глицином или таурином и по желчевыводящим путям поступают в желчный пузырь, где и накапливаются . В стенках желчного пузыря происходит всасывание незначительного количества желчных кислот — около 1,3%. У здорового человека при наличии желчного пузыря основной пул желчных кислот находится в желчном пузыре и только после стимуляции пищей рефлекторно происходит сокращение желчного пузыря и желчные кислоты поступают в двенадцатиперстную кишку. Вторичные желчные кислоты — дезоксихолевая и литохолевая — образуются из первичных (холе- и хенодезоксихолевой соответственно) под воздействием анаэробных бактерий толстой кишки (рис. 1).
После реабсорбции вторичных желчных кислот происходит их конъюгация с глицином или таурином, и они также становятся компонентами желчи. Урсодезоксихолевая кислота (УДХК) — третичная желчная кислота не превышает 5% от всех желчных кислот организма человека и также образуется под действием ферментов микроорганизмов .
Из кишечника желчные кислоты с током портальной крови вновь попадают в печень, которая абсорбирует практически все желчные кислоты (примерно 99%) из портальной крови; совсем небольшое количество (около 1%) попадает в периферическую кровь (рис. 2).
Активное всасывание желчных кислот происходит в подвздошном отделе тонкой кишки, тогда как пассивная абсорбция идет за счет концентрации желчных кислот в кишечнике, поскольку она всегда выше, чем в портальной крови. В гепатоцитах токсичные свободные желчные кислоты, составляющие примерно 15% от всего количества желчных кислот, всосавшихся в кровь, превращаются в конъюгированные. Из печени желчные кислоты вновь поступают в желчь в виде конъюгатов. Подобная энтерогепатическая циркуляция в организме здорового человека совершается 2–6 раз в сутки в зависимости от режима питания; 10–15% от всех поступивших в кишечник желчных кислот после деконъюгации подвергаются более глубокой деградации в нижних отделах тонкой кишки. В результате процессов окисления и восстановления, вызываемых ферментами микрофлоры толстой кишки, происходит разрыв кольцевой структуры желчных кислот, что приводит к образованию ряда веществ, выделяемых во внешнюю среду. Учитывая, что желчные кислоты в норме предотвращают развитие избыточного микробного роста в кишечнике, у пациентов после холецистэктомии они рассматриваются также в качестве одной из причин развития данного синдрома, а также в качестве классических повреждающих факторов по отношению к слизистой оболочке желудка, пищевода, кишечника. Повреждающий эффект желчных кислот зависит не только от их концентрации, но и от конъюгации и рН окружающей среды, два последних процесса обеспечиваются микрофлорой кишечника. Желчные кислоты, обладающие детергентными свойствами, способствуют солюбилизации липидов мембран клеток поверхностного эпителия. Растворимые желчные кислоты проникают в эпителиальные клетки. Внутриклеточные концентрации желчных кислот могут в 8 раз превосходить их внеклеточные концентрации. Такое избыточное накопление приводит к повышению проницаемости мембран клеток, их разрушению, повреждению межклеточных контактов и в итоге к гибели клетки . Этот повреждающий эффект зависит не только от концентрации желчных кислот в рефлюксате, но и от продолжительности времени, в течение которого слизистая оболочка подвержена действию желчи. Под действием желчных кислот снижается количество фосфолипидов, теряется гидрофобность слизи . Конъюгированные желчные кислоты оказывают негативное влияние при кислых значениях рН, а неконъюгированные — при рН, равном 5–8. В силу указанных причин при нарушении микробиоценоза кишечника неконъюгированные желчные кислоты оказывают выраженное повреждающее действие на эпителиоциты. Зрелые и незрелые бокаловидные клетки из ткани толстой кишки здорового человека под действием желчных кислот подвергаются апоптозу.
Исследование биологических свойств бифидо- и лактобактерий показало, что популяция человеческой микробиоты оказывает многогранный спектр физиологически полезных воздействий. Применительно к обсуждаемой проблеме следует остановиться на некоторых из них.
Микрофлора кишечника принимает непосредственное участие в метаболизме и элиминации токсичных желчных кислот, в частности, холевой кислоты. В норме невсосавшаяся в дистальных отделах подвздошной кишки конъюгированная холевая кислота в толстой кишке подвергается деконъюнгации микробной холеглицингидролазой и дегидроксилированию при участии 7-альфа-дегидроксилазы . Образовавшаяся дезоксихолевая кислота связывается с пищевыми волокнами и выводится из организма. Большое значение имеет рН в просвете кишечника. При повышении значений рН дезоксихолевая кислота ионизируется и хорошо всасывается в толстой кишке, а при снижении — выводится. Повышение значений рН в толстой кишке приводит к повышению активности ферментов, приводящих к синтезу дезоксихолевой кислоты, ее растворимости и всасыванию и, как следствие, повышению в крови уровня желчных кислот, холестерина и триглицеридов. Одной из причин повышения рН может быть недостаток пребиотических компонентов в питании, нарушающих рост нормальной микрофлоры, в т. ч. бифидо- и лактобактерий.
Не менее важны эффекты, связанные с синтезом короткоцепочечных жирных кислот (КЦЖК) в результате анаэробного брожения доступных для бактерий ди-, олиго- и полисахаридов . Локально КЦЖК определяют снижение рН, обеспечивая колонизационную резистентность кишечника, принимают участие в регуляции кишечной моторики. Помимо этого КЦЖК важны для эпителия толстой кишки, т. к. именно бутират колоноциты используют для обеспечения своих энергетических потребностей. Кроме того, снижение рН, связанное с образованием КЦЖК, приводит к образованию ионов аммония из аммиака, образовавшегося в толстой кишке в процессе микробного метаболизма белков и аминокислот, который уже не может свободно диффундировать через кишечную стенку в кровь, а выводится с калом в виде аммонийных солей.
Результатом совместной симбиотической деятельности клеток эпителия кишечника и физиологической микрофлоры является формирование сложной специфической преэпителиальной структуры — слизистого барьера (биопленки, микробиологического барьера), состоящего из слизи, молекул секреторного IgA, индигенной флоры и ее метаболитов и защищающего слизистую оболочку кишечника от действия бактериальных и других токсинов физической и химической природы, включая желчные кислоты .
Лечение пациентов с дисфункцией сфинктера Одди
Основной целью лечения больных с дисфункцией сфинктера Одди является восстановление нормального тока желчи и поджелудочного сока из билиарных и панкреатических протоков в двенадцатиперстную кишку с использованием оперативного или консервативного лечения .
В связи с этим в задачи лечения входят:
- восстановление, а при невозможности — восполнение продукции желчи;
- восстановление тонуса сфинктерной системы;
- восстановление давления в двенадцатиперстной кишке (от этого зависит адекватный градиент давления в билиарном тракте).
Диетотерапия занимает существенное место в лечении данной категории больных. Общим принципом диеты является режим питания с частыми приемами пищи в небольшом количестве (5–6-разовое питание) с достаточным потреблением пищевых волокон, необходимых для восстановления моторно-эвакуаторной функции кишечника и коррекции микробиологических нарушений.
Для купирования болевого синдрома используют релаксанты гладкой мускулатуры, включающие несколько групп препаратов: антихолинергические средства — М-холиноблокаторы (препараты красавки, платифиллин, Метацин и т. п., в связи с выраженными побочными системными эффектами сфера применения ограничена), Бускопан (в отличие от предыдущих не проникает через гематоэнцефалический барьер и имеет низкую — 8–10% — системную биодоступность); миотропные спазмолитики: неселективные (дротаверин, отилония бромид и др.) и селективные — Мебеверина гидрохлорид .
Препаратами выбора для патогенетической терапии больных с функциональными заболеваниями билиарного тракта, безусловно, являются средства, селективно релаксирующие гладкую мускулатуру органов пищеварения, в частности мебеверин . Преимуществом препарата является релаксирующая селективность в отношении сфинктера Одди, в 20–40 раз превышающая эффект папаверина. Мебеверин оказывает нормализующее воздействие на мускулатуру кишечника, устраняя функциональный дуоденостаз, гиперкинез, спазм, не вызывая развитие нежелательной гипотонии. Препарат у данной категории пациентов может применяться длительно, курсами в дозе 200 мг 2 раза в день.
Для лечения синдромов мальдигестии и мальабсорбции назначают препараты панкреатина (Микразим, Креон, Панзинорм форте-Н, Панцитрат и другие).
Лечение синдрома избыточного бактериального роста в кишечнике
При наличии микробной контаминации тонкой кишки необходимо проведение деконтаминирующей терапии (невсасывающиеся кишечные антибиотики — рифаксимин, или кишечные антисептики (нитрофуранового ряда — Энтерофурил, Эрсефурил, фторхинолоны и др.) с одномоментным и/или последовательным применением пробиотиков и пребиотиков (Хилак форте, Лактулоза), лекарственных препаратов на основе пищевых волокон — Псиллиум и др.). Применение про- и пребиотических препаратов улучшает метаболизм желчных кислот, стимулирует регенерацию поврежденных деконъюгированными желчными кислотами эпителиоцитов кишечной стенки .
При наличии билиарной недостаточности назначают препараты УДХК (Урсосан). Применение препаратов в суточной дозе 10–15 мг/кг массы тела уменьшает степень билиарной недостаточности и выраженность дисхолии.
Фармакологические эффекты УДХК (Урсосана) разносторонни. Относительно рассматриваемой проблемы особое значение имеют следующие ее свойства. В первую очередь, это гидрофильность и отсутствие токсических свойств. УДХК вытесняет желчные кислоты, обладающие повреждающим действием на слизистые оболочки. При систематическом приеме УДХК становится основной желчной кислотой в сыворотке крови и составляет около 48% общего количества желчных кислот в крови, происходит дозозависимое увеличение ее доли в пуле желчных кислот до 50–75%. Это происходит, например, вследствие конкурентного захвата рецепторами желчных кислот в подвздошной кишке или за счет индукции холереза, богатого бикарбонатами, что приводит к увеличению пассажа желчи и повышенному выведению токсичных желчных кислот через кишечник. УДХК не оказывает негативного влияния на клетки (мицеллы УДХК практически не растворяют мембраны). Цитопротективные свойства УДХК имеют большое значение также с точки зрения защиты слизистой оболочки желудочно-кишечного тракта. В экспериментальных условиях УДХК продемонстрировала антиоксидантный эффект . Помимо этого, применение УДХК позволяет профилактировать развитие избыточного бактериального роста в кишечнике. Своевременная и правильная оценка клинической симптоматики с применением современных методов диагностики дисфункции сфинктера Одди, назначение адекватной комплексной терапии позволяют значительно улучшить самочувствие и качество жизни данной категории пациентов.
Литература
Е. А. Лялюкова, кандидат медицинских наук, доцент
М. А. Ливзан, доктор медицинских наук, профессор
ГБОУ ВПО ОмГМА МЗ РФ, Омск
Контактная информация об авторах для переписки: mlivzan@yandex.ru
Ю.В. Васильев
ЦНИИГ, Москва
Известно, что хронический панкреатит – группа заболеваний (вариантов), в основе появления которых лежат те или иные факторы, обычно рассматриваемые в качестве этиологических, морфологических и/или клинических критериев, определяющих развитие заболевания. Последние на ранних стадиях весьма схожи, однако по мере прогрессирования хронического панкреатита, в зависимости от появления экзокринной и/или эндокринной недостаточности поджелудочной железы и/или различных осложнений, появляются и некоторые различия .
Хронический панкреатит, как известно, может развиться вследствие различных причин, в т. ч. и вследствие обструкции панкреатического протока из-за рубцово-папиллярного стеноза или вследствие нарушения моторики сфинктера Одди. В частности, по данным некоторых исследователей , у 20 из 68 больных хроническим панкреатитом была выявлена дисфункция сфинктера Одди. Подобная связь возможна и между аномальным панкреатобилиарным сращением и рецидивирующим панкреатитом, ассоциируемыми с дисфункцией сфинктера Одди у детей и подростков . В принципе термин «дисфункция» обычно рассматривается как нарушение или расстройство функций какого-либо органа, преимущественно качественного характера.
Сфинктер Одди – фиброзно-мышечное образование, окружающее конечные участки общего желчного протока, главного панкреатического протока (вирсунгова протока) и общий канал в участке их прохождения через стенку двенадцатиперстной кишки. Основные функциональные особенности сфинктера Одди:
• регуляция тока желчи и панкреатического секрета в двенадцатиперстную кишку;
• предотвращение поступления содержимого из двенадцатиперстной кишки в общий желчный и вирсунгов протоки;
• обеспечение наполнения желчью желчного пузыря.
В настоящее время все чаще рассматриваются с различных точек зрения «Дисфункциональные расстройства билиарного тракта» (Рим, 1999). При этом дисфункция билиарного тракта условно подразделяется на два типа: дисфункцию желчного пузыря и дисфункцию сфинктера Одди.
Под дисфункцией сфинктера Одди чаще подразумевается доброкачественное клиническое состояние некалькулёзной этиологии, проявляющееся нарушением прохождения желчи и секрета поджелудочной железы на уровне соединения общего желчного протока и вирсунгова протока. Нарушение выделения панкреатического сока при прохождении через сфинктер Одди в двенадцатиперстную кишку, как известно, приводит к повышению давления в протоках поджелудочной железы – одной из главных причин развития хронического панкреатита и появления клинических симптомов, прежде всего – боли. Дисфункция панкреатического сфинктера фатерова соска, являющаяся вариантом дисфункции сфинктера Одди, может быть причиной развития панкреатита или причиной появления так называемых панкреатитоподобных болей. При дисфункции сфинктера Одди у 77 % больных с предполагаемым «идиопатическим» панкреатитом при дальнейшем обследовании выявляется повышение базального давления в сфинктере вирсунгова протока.
Хронический панкреатит, сочетающийся с дисфункцией сфинктера Одди, по некоторым данным , встречается в 4 раза чаще (относительный риск составляет 4,6) по сравнению с хроническим панкреатитом без дисфункции сфинктера Одди, развитие которой возможно как у мужчин, так и у женщин. Однако женщины в возрасте 35-60 лет, перенесшие ранее холецистэктомию по поводу калькулёзного холецистита, страдают чаще мужчин.
Среди причин появления «внепанкреатической» боли при хроническом панкреатите часто выделяются стеноз или спазм сфинктера Одди вследствие отёка и нарушений моторики, а также сдавление протоков кистой или псевдокистой поджелудочной железы (при увеличении их в объёме). Причиной развития хронического панкреатита может быть как первичный, так и вторичный склерозирующий холангит. Последний связан с воспалительными изменениями и склерозированием терминального отдела общего желчного протока, приводящими к его сужению, проявляющемуся отёком, длительным спазмом, а позднее и обструкцией вирсунгова протока вследствие папиллярного стеноза, приводящего к развитию и прогрессированию хронического панкреатита.
Среди факторов, способствующих повышению внутриполостного давления в двенадцатиперстной кишке, нередко выделяют дуоденальную дискинезию и дуоденальную гипертензию. Под синдромом дуоденальной гипертензии обычно понимают клинический симптомокомплекс, проявляющийся болью в животе и симптомами диспепсии, возникающими вследствие повышения внутрипротокового давления и нарушения транзита химуса по двенадцатиперстной кишке.
Наиболее часто в начальном периоде заболевания пациентов с хроническим панкреатитом беспокоят боли в верхней половине живота, в меньшей степени – диспепсические расстройства . В принципе, для болевого синдрома при хроническом панкреатите характерна вариабельность появления боли по частоте и длительности в различные периоды течения хронического панкреатита, в т. ч. в зависимости и от функционального состояния поджелудочной железы, что нередко затрудняет выяснение точной локализации возможного патологического очага, приводящего к появлению боли. Именно поэтому лечение больных хроническим панкреатитом, сочетающимся с дисфункцией сфинктера Одди, нередко становится неспецифическим, направленным прежде всего на устранение симптомов заболевания, наиболее беспокоящих конкретных больных.
По мере развития экзокринной недостаточности поджелудочной железы отмечается тенденция уменьшения интенсивности боли, однако при появлении осложнений возможно более или менее периодическое появление или усиление боли .
В 10-15 % случаев возможно «безболевое» течение хронического панкреатита, впервые проявляющееся появлением функциональной недостаточности поджелудочной железы.
Клинические проявления дисфункции сфинктера Одди
Клинические проявления этого заболевания довольно неспецифичны, основные из которых в период ухудшения состояния больных – тошнота, рвота, боль и/или метеоризм. Такие проявления дисфункции сфинктера Одди, как колики, не являются типичным симптомом дискинезий желчных путей. Более характерным, по наблюдениям некоторых исследователей , в данном случае является скорее ощущение тяжести в верхней половине живота. При этом базальное давление сфинктера Одди не превышает 40 мм рт. ст. Однако при сочетании хронического панкреатита с дисфункцией сфинктера Одди клинические проявления могут быть весьма вариабельными. В частности, в одних случаях боль может быть похожей на боль, возникающую при приступах хронического панкреатита; в других случаях возможна боль билиарного типа, считающаяся характерной для боли, возникающей при заболеваниях желчных путей; иногда боль похожа на приступ желчной колики, но возможно появление и неясной, трудно объяснимой боли в верхних отделах живота. Один из диагностических признаков – возникновение боли неясного происхождения, при которой возможно повышение уровней сывороточных печёночных ферментов, наблюдаемое в ряде случаев при так называемом идиопатическом панкреатите.
У части больных с дисфункцией сфинктера Одди, наряду с появлением боли, при пальпации живота возникает болезненность в тех или иных его отделах; у части больных возможно появление озноба, повышение температуры. В период между приступами боли состояние пациента может быть вполне удовлетворительным. Различие типа и выраженности клинических проявлений при дисфункции сфинктера Одди, очевидно, вынудило некоторых исследователей как-то систематизировать клинические данные. На Международном совещании гастроэнтерологов (Рим, 1999) было принято решение выделить критерии диагностики дисфункции сфинктера Одди, к которым условно был отнесён комплекс функциональных расстройств продолжительностью более трёх месяцев, основными клиническими симптомами которого являются:
• рецидивирующие приступы сильной или умеренной боли длительностью 20 и более минут, локализующейся в подложечной области и/или в правом подреберье (билиарный тип);
• боли, локализующиеся в левом подреберье, уменьшающиеся в своей интенсивности при наклоне туловища вперед (панкреатический тип);
• опоясывающие боли (сочетанный тип).
При этом боль нередко возникает в определенное время (начало возникновения – после приема пищи; появление боли в ночные часы), возможно появление тошноты и/или рвоты.
Согласно этому же совещанию (Рим, 1999) было предложено выделять:
• первичные билиарные дисфункции, обусловленные функциональными нарушениями желчевыделительной системы, проявляющиеся нарушениями оттока желчи и/или панкреатического секрета в двенадцатиперстную кишку;
• вторичные дискинезии билиарного тракта, сочетающиеся с органическими изменениями сфинктера Одди, желчного пузыря или с различными заболеваниями органов брюшной полости, что позволило бы систематизировать различные данные, получаемые разными исследователями.
Обследование больных с подозрением на дисфункцию сфинктера Одди
Клинико-лабораторное и инструментальное обследование больных с дисфункцией сфинктера, как и обследование больных хроническим панкреатитом, включает изучение симптомов, анамнеза заболевания и жизни, а также физикальное обследование. При лабораторном обследовании выявление изменения уровней печёночных ферментов (с повышением в два раза и более), повышение уровней АСТ и/или щелочной фосфотазы при двух и более исследованиях, а также изменение концентрации бикарбонатов в панкреатическом секрете свидетельствует о дисфункции сфинктера Одди при хроническом панкреатите.
Выявление клеток цилиндрического эпителия, не окрашенных желчью (не имбибированных), свидетельствует о наличии дуоденита, сопутствующего спазмам сфинктера Одди; выявление имбибированных клеток – указание на спазм сфинктера Одди, обусловленный воспалительными изменениями общего желчного протока.
При необходимости целесообразно проведение эндоскопической манометрии сфинктера Одди, выполняемой при эндоскопической панкреатохолангиографии (ЭПХГ), панкреатической дуктографии, традиционного УЗИ и/или эндоскопического УЗИ, сцинтиграфии печени и желчевыводящих путей и/или проведения ЭПХ, по результатам которой в выявленных случаях дисфункции сфинктера Одди отмечается замедление поступления контрастного вещества (более 5 минут). Такие неинвазивные методы, как ультразвуковая оценка диаметра панкреатического протока в условиях стимуляции секретином, менее информативны и имеют сравнительно низкую чувствительность. У 2/3 больных с дисфункцией сфинктера Одди обнаруживается повышение базального тонуса парасимпатического сфинктера.
К сожалению, проведение некоторых инструментальных методов обследования фатерова соска в обычной практике в силу различных причин не всегда возможно и даже иногда оказывается неоправданным. Так, по некоторым наблюдениям , оценка соотношения эффективности и риска не подтверждает целесообразность проведения манометрии с диагностическими целями и эндоскопической папиллотомии с лечебными целями. Определённые технические трудности проведения указанных выше инструментальных исследований, вероятность появления побочных эффектов (при эндоскопической папиллотомии – 1-2 % случаев) или осложнений (при эндоскопической манометрии – более 10 % случаев), а также летальных исходов (при эндоскопической папиллотомии – 0,8 %) – одна из причин, мешающих внедрению в широкую практику инвазивных инструментальных методов обследования фатерова соска и поджелудочной железы и соответственно своевременному распознаванию дисфункции сфинктера Одди.
Лечение больных
Основной подход к терапии хронического панкреатита, в т. ч. и сочетающегося с дисфункцией сфинктера Одди, – устранение боли и симптомов диспепсии, ликвидация воспалительных изменений поджелудочной железы и сфинктера Одди, а также сопутствующих поражений других органов, предотвращение осложнений, повышение качества жизни больных. В процессе проведения лечения необходимо, прежде всего, устранить (уменьшить) интенсивность и частоту появления боли, обеспечить «разгрузку» поджелудочной железы и восстановить функцию пищеварения. При этом в зависимости от состояния больных в лечении могут быть использованы как консервативные, так и хирургические методы, включая и эндоскопические.
При лечении целесообразно рекомендовать больным соблюдать диету с низким содержанием жиров, иcключить употребление алкогольных напитков. При сочетании хронического панкреатита с дисфункцией сфинктера Одди в зависимости от состояния в комплексном лечении пациентов целесообразно также использовать антисекреторную и спазмолитическую терапию.
В качестве антисекреторного препарата, усиливающего действие ферментных препаратов в устранении (уменьшении выраженности и частоты возникновения) боли и признаков внешнесекреторной недостаточности поджелудочной железы, возникающих у больных хроническим панкреатитом, целесообразно использовать омепразол в капсулах по 20 мг один-два раза в день за 30-40 минут до еды. Основное фармакодинамическое действие омепразола – ингибирование фермента Н+, К+-АТФазы в обкладочных клетках слизистой оболочки желудка, что позволяет не только уменьшить кислотообразование в желудке, но и уменьшить закисление содержимого двенадцатиперстной кишки, а также предохранить от разрушения в желудке использованные в лечении больных ферментные препараты. Это достоинство омепразола дает возможность эффективно применять его в лечении больных хроническим панкреатитом, в т. ч. и сочетающимся с дисфункцией сфинктера Одди, язвенной болезнью и гастроэзофагеальной рефлюксной болезнью. С учетом известного факта – лечение больных хроническим панкреатитом ингибиторами протонного насоса, одним из которых является омепразол, и ферментными препаратами нередко требует длительного времени (нередко более 8 недель) – на одно из первых мест выходит и возможная финансовая стоимость проводимой медикаментозной терапии. Не вызывает сомнения, что использование в лечении больных омепразола в подобных ситуациях, учитывая его невысокую финансовую стоимость, делает его доступным для всех слоёв населения.
Разделение причин возникновения боли и диспепсических расстройств на «панкреатические» и «внепанкреатические» достаточно условно. Существует несомненная связь между развитием боли и диспепсических расстройств, в большей или меньшей степени связанных между собой, но приводящих к появлению боли и симптомов диспепсии. Для повышения эффективности лечения больных хроническим панкреатитом, сочетающимся с дисфункцией сфинктера Одди, целесообразно использовать и пленалгин.
Пленалгин – комбинированный препарат, относящийся к группе аналгетических и спазмолитических средств, содержащий в своем составе ненаркотический аналгетик – метамизол натрия (аналгин), миотропное спазмолитическое средство – питофенона гидрохлорид и холинблокирующее средство – фенпиверина бромид. Метамизол натрия оказывает болеутоляющее, жаропонижающее и противовоспалительное действие; питефенона гидрохлорид (подобно папаверину) оказывает прямое миотропное действие на гладкую мускулатуру внутренних органов, вызывая её расслабление; фенпиверин благодаря холинблокирующему действию оказывает дополнительное расслабляющее воздействие на гладкую мускулатуру. Указанные выше качества пленалгина в лечении больных хроническим панкреатитом, в т. ч. и сочетающимся с дискинезией сфинктера Одди, позволяют использовать этот препарат с целью устранения (уменьшения интенсивности) боли благодаря расслаблению спазма сфинктера Одди, а также, в случае необходимости, и для устранения лихорадки.
Эндоскопические операции при дисфункции сфинктера Одди
Возможности применения эндоскопических операций при дисфункции сфинктера Одди достаточно противоречивы – в значительной степени в связи с тем, что нередко учитываются лишь ближайшие результаты лечения больных. Приводимые ниже сведения чаще свидетельствуют о недостаточной эффективности эндоскопических операций при дисфункции сфинктера Одди, несмотря на некоторые оптимистические заявления. В частности, после проведения эндоскопической билиарной сфинктеротомии отмечается высокий риск развития панкреатита, однако установка стента в панкреатический проток, по наблюдениям некоторых исследователей , достоверно снижает риск развития панкреатита у больных с гипертензией панкреатического сфинктера, подвергшихся эндоскопической сфинктеротомии.
По данным других исследователей , улучшение состояния при длительном наблюдении за больными с дисфункцией сфинктера Одди, которым была ранее проведена эндоскопическая сфинктеротомия, наблюдается чаще, чем у больных с подозреваемой дисфункцией сфинктера Одди, но с нормальными данными эндоскопической манометрии, которым не была проведена эндоскопическая сфинктеротомия. Однако почти во всех случаях, несмотря на проведение эндоскопической сфинктеротомии, у больных сохраняется боль, которая сопоставима с большинством хронических болезненных нарушений и которая предполагает многофакторную причину боли.
Панкреатическая сфинктеротомия сопровождается теми же осложнениями, что и билиарная, за исключением более высокой (в 2-4 раза) частоты возникновения панкреатита. Профилактическая установка стента в панкреатический проток снижает риск развития такого панкреатита, по одним наблюдениям , примерно на 50 %. По другим наблюдениям , эндоскопическая панкреатическая сфинктеротомия у половины пациентов достоверно приводит к подтверждённому клиническому улучшению (сроки наблюдения – 16 месяцев).
Эндоскопическая сфинктеротомия оказывается неэффективной примерно у половины больных с дисфункцией сфинктера Одди III типа, т. е. у больных без клинических признаков билиарной обструкции (отмечаются нормальные показатели печёночных проб, нормальный диаметр желчных протоков, неизменённое время дренирования при ЭПХГ), к тому же проведение этой эндоскопической операции связано с определённым риском. Для повышения эффективности лечения было предложено предварительно проводить лечение больных с дисфункцией сфинктера Одди однократными инъекциями ботулотоксина в дозе 100 мышиных единиц в область фатерова соска с оценкой результатов через 6 недель (эндоскопическая манометрия позволила подтвердить наличие дисфункции сфинктера Одди III типа). По мнению этих исследователей, эффективность предварительно проведённой инъекции ботулотоксина в область фатерова соска может служить прогностическим фактором, позволяющим предсказать получение продолжительного клинического эффекта от последующего проведения больным с дисфункцией сфинктера Одди эндоскопической сфинктеротомии. При постановке стентов больным хроническим панкреатитом, проявляющимся постоянной умеренной болью и выраженными стриктурами панкреатического протока, достигается первоначальный положительный клинический эффект в устранении симптомов у большинства больных (у 49 из 51 больного), осложнения – в 9 случаях (18 %). Однако дисфункция сфинктера Одди после постановки стента всё же остаётся частым поздним осложнением (у 27 из 49 больных, 55 %). Панкреатическое дренирование, по некоторым данным , привело к клиническому улучшению в 40 из 49 случаев (82 %), при этом у 22 из 40 больных положительный эффект сохранялся после удаления стента (средняя длительность наблюдения – 28,5 месяца).
Очевидно, результаты эндоскопических операций в значительной степени зависят от подбора больных, опыта врачей-эндоскопистов и, что не менее важно, от многопричинности появления боли у пациентов с хроническим панкреатитом, сочетающимся с дисфункцией сфинктера Одди.
Заключение
При выборе того или иного варианта лечения больных хроническим панкреатитом с предполагаемой дисфункцией сфинктера Одди необходимо, прежде всего, выявить или исключить её наличие. Учитывая многофакторность возможных причин появления боли и диспепсических расстройств, считающихся характерными для хронического панкреатита с внешнесекреторной недостаточностью поджелудочной железы, основные из которых – стеаторея, креаторея и амилорея, лечение больных хроническим панкреатитом, сочетающимся с дисфункцией сфинктера Одди, должно быть комплексным, направленным, особенно в период выраженного обострения, на возможные причины возникновения клинических симптомов. Сочетанное применение в лечении больных в качестве антисекреторного препарата омепразола и в качестве спазмолитического и обезболивающего препарата пленалгина позволит повысить эффективность и уменьшить стоимость лечения больных.
Литература
1. Васильев Ю.В. Хронический панкреатит: диагностика, лечение больных // Лечащий врач. 2004. № 2. С. 10-13.
2. Васильев Ю.В. Дифференцированный подход к антисекреторной терапии хронического панкреатита, сочетающегося с язвенной болезнью и гастроэзофагеальной рефлюксной болезнью // РМЖ. 2005. Т. 7. № 2. С. 57-60.
3. Васильев Ю.В. Болевой синдром при хроническом панкреатите: медикаментозное лечение больных // Фарматека. 2005. № 14. С. 44-48.
4. Васильев Ю.В. Аутоиммунный панкреатит // Экспериментальная и клиническая гастроэнтерология. 2005. № 2. С. 83-86.
5. Лейшнер У. Практическое руководство по заболеваниям желчных путей. М.: «ГЕОТАР-МЕД», 2001. 260 с.
6. Guelrud M., Morers C., Rodriguez M. et al. Sphincter of Oddi dysfunction in children with recurrent pancreatitis and anomalous pancreaticobillary union: an etiologic concept // Gastrointest. Endosc. 1999. Vol. 50. P. 194-199.
7. Lehman G.A., Sherman S. Гипертонус панкреатического сфинктера // Can. J. Gastroenterol. 1998. Vol. 12. P. 333-337.
8. Limder J.D., Klapow J.C., Linder S.D. et al. Incomplete response to endoscopic sphincterotomy in patients with sphincter of Oddi dyspynction: Evidence for chronic pain disorder // Am. J. Gastroenterol. 2003. Vol. 98. P. 1739-1743.
9. Okolo P.I. Pasricha P.J., Kallo A.N. Wheat are the long- term results of endo-scopic pancreatic sphincterotomu? // Gastrointest.Endosc. 2000. Vol. 52. P. 15-19.
10. Smits V., Badiga A.M., Rauws E,A.J. et al. Отдалённые результаты применения панкреатических стентов при хроническом панкреатите // Gastri-intest.Endosc. 1995. Vol. 42. P. 451-467.
11. Tamasky P.R., Palesch Y.Y., Cunningham J.T. et al. Pancreatic stentig pre-vents pancreatitis after biliary sphincterotomy in patients with sphincter of Oddi dysfunction // Gastroenterology. 1998. Vol. 115. P. 1519-1524.
12. Tarnasky P.R., Hoffman B., Afbakken L. et al. Дисфункция сфинктера Одди в связи с хроническим панкреатитом // Am. J. Gastroenterol. 1997. Vol. 92. P. 1125-1129.
13. Wehrmann T., Seifert H., Seipp M. et al. Эндоскопические инъекции ботулотоксина в лечении билиарной дисфункции сфинктера Одди // Endo-scopy. 1998. Vol. 30. P. 702-707.
