Склероз крыши вертлужной впадины
 Одной из наиболее частых локализаций ОА является ОА тазобедренного сустава – коксартроз (КА) (встречается в 40% случаев), который, как правило, протекает тяжело, сопровождается выраженным болевым синдромом, значительной утратой функции сустава, быстро инвалидизирует больного .
Одной из наиболее частых локализаций ОА является ОА тазобедренного сустава – коксартроз (КА) (встречается в 40% случаев), который, как правило, протекает тяжело, сопровождается выраженным болевым синдромом, значительной утратой функции сустава, быстро инвалидизирует больного .
Тазобедренный сустав является крупным шарнирным суставом, играющим основную роль в поддержании веса, осанки и передвижении (ходьба, бег, прыжки и т.д.). Именно поэтому он должен обладать большим объемом движений при выраженной стабильности. Стабильность сустава обеспечивается:
• сильными мышцами, действующими через сустав;
• прочной фиброзной капсулой;
• глубоким проникновением головки в суставную впадину.
Силы, действующие через тазобедренный сустав, часто значительны, например, при стоянии на обеих ногах (1/3 веса тела), стоянии на одной ноге (2,5 × вес тела), ходьбе (1,5–6 × вес тела). По-видимому, именно этим обусловлена высокая частота развития ОА тазобедренного сустава. Кроме того, формированию КА способствуют следующие факторы:
• травма сустава;
• идиопатическая, часто семейная, протрузия подвздошной впадины;
• деформация головки бедренной кости вследствие хондропатии;
• хронический артрит (чаще ревматоидный);
• остеонекроз;
• спортивные нагрузки.
Развивается КА обычно после 40 лет. Женщины и мужчины болеют одинаково часто. КА может поражать как один, так и оба тазобедренных сустава. Но даже в случае двустороннего поражения сначала, как правило, заболевает один сустав, и лишь потом к нему «подтягивается» второй .
Чаще всего при КА поражается верхний полюс тазобедренного сустава с верхнелатеральным смещением головки бедренной кости (около 60% больных КА, чаще мужчины). Верхний полюс сустава – зона, через которую проходит ось нагрузки массы тела, поэтому верхний полюс – наиболее уязвимый участок. Реже встречается поражение медиального полюса сустава с медиальным смещением головки и протрузией вертлужной впадины (около 25% больных, чаще женщины). Концентрическое поражение, при котором поражается весь сустав, – наиболее тяжелый вариант КА, встречается довольно редко.
Основной симптом КА – боль в паху. Чаще всего боль из паха распространяется вниз по ноге, по передней и боковой поверхностям бедра. Иногда такие болевые ощущения распространяются еще и на ягодицу. В некоторых случаях больного беспокоит только боль в коленном суставе, что значительно затрудняет диагностику. Характерна скованность в пораженном суставе после периода покоя. Постепенно к болевым ощущениям добавляется ограничение подвижности больной ноги. Больному трудно отвести ногу в сторону, подтянуть к груди, надеть носки или обувь, сесть на стул верхом, широко раздвинуть ноги. Обычно в первую очередь уменьшаются объем внутренней, а затем наружной ротации и угол отведения ноги. В наиболее тяжелых случаях можно услышать (но не пальпировать) крепитации при движении в суставе. Болезненность на латеральной поверхности сустава может быть обусловлена вторичным вертельным бурситом .
На поздних стадиях КА появляется хромота в связи с укорочением ноги вследствие миграции головки бедренной кости, а при двустороннем поражении – «утиная походка». Развивается атрофия мышц бедра и ягодицы, появляются характерные «анталгическая» (коксалгическая) походка и так называемый признак Тренделенбурга: при попытке больного опереться на пораженную конечность опускается таз.
Необходимо отметить, что в дебюте КА из-за широкой и вариабельной иррадиации боли боль в тазобедренном суставе необходимо дифференцировать с крестцово-подвздошной, корешковой болью, энтезопатиями, симфизитом, бурситом, парестетической мералгией .
В диагностике КА применяются преимущественно визуализирующие методики, позволяющие оценить структурные изменения в пораженных суставах. Несмотря на бурное развитие в последние годы таких современных методов медицинской визуализации, как рентгеновская компьютерная томография, магнитно-резонансная томография (МРТ), расширение возможностей ультразвуковой диагностики, рентгенография остается наиболее распространенным объективным методом диагностики и контроля лечения ОА и КА в частности. Это обусловлено доступностью данного исследования, экономичностью и достаточной информативностью. В целом рентгенологическая диагностика КА основана на выявлении сужения рентгенсуставной щели (РСЩ), субхондрального остеосклероза, остеофитов (ОФ). Для оценки изменений всегда проводится исследование обоих тазобедренных суставов. Выявленные рентгенологические признаки стадируются по Келлгрену–Лоуренсу.
В начальных стадиях КА (I–II стадии) определяются:
• незначительное сужение РСЩ;
• слабовыраженный субхондральный склероз;
• точечные кальцификаты в области наружного края крыши вертлужной впадины (начальные проявления остеофитоза);
• заострение краев ямки головки бедренной кости в области прикрепления круглой связки.
В поздних стадиях КА (III–IV стадии) отмечаются:
• прогрессирующее сужение РСЩ;
• формирование различной формы и размеров ОФ на краях суставных поверхностей вертлужной впадины;
• углубление вертлужной впадины, вызванное ростом ОФ;
• выраженный субхондральный склероз;
• в далеко зашедших случаях – уменьшение в объеме и уплощение суставной поверхности головки бедренной кости на фоне выраженной кистовидной перестройки костной ткани;
• костные кисты;
• асептический некроз головки бедренной кости;
• подвывихи бедренной кости .
МРТ является наиболее информативным неинвазивным объективным методом визуализации в диагностике КА, дающим информацию обо всех составных частях сустава одновременно и способствующим изучению структурных и функциональных параметров при заболевании тазобедренного сустава. Итак, МРТ позволяет получить информацию о состоянии:
• суставного хряща: локальные дефекты, неровность поверхности, выраженность истончения;
• субхондральной кости и костного мозга: ОФ, субхондральный костный склероз, образование субхондральных кист, отек костного мозга;
• мягких тканей;
• наличии синовита.
Таким образом, при подозрении на патологию тазобедренного сустава в дебюте заболевания больного необходимо направить на МРТ-исследование, выявляющее самые ранние признаки КА .
Артросонография (ультразвуковое исследование суставов) также должна использоваться в ранней диагностике КА, т.к. она дает возможность получить информацию о мелких деталях поверхности костей, связочно-сухожильного и мышечного аппарата, выявить признаки воспаления (синовит). Недостатками метода являются невозможность визуализации структуры костной ткани, субъективность оценки полученных данных .
Лечение КА – сложная задача, требующая терпения, последовательности, системности и от врача, и от больного. В терапии заболевания используется как широкий спектр немедикаментозных методов (разгрузка сустава, лечебная физкультура, снижение массы тела, физиотерапевтические процедуры и др.), так и фармакологических. Медикаментозное лечение КА предполагает назначение нестероидных противовоспалительных препаратов (НПВП), миорелаксантов. При развитии синовита возможно однократное введение в полость сустава глюкокортикоидов. Однако все перечисленные методы лекарственного воздействия оказывают временный симптоматический эффект, НПВП вызывают тяжелые осложнения. В этой связи современное лечение ОА, в т.ч. и КА, должно базироваться на длительном применении препаратов с минимальными сторонними эффектами и, возможно, влияющих на течение заболевание (болезнь-модифицирующий эффект). Целями такой терапии являются не только уменьшение выраженности симптомов заболевания, улучшение качества жизни больного, но и максимальное отдаление необходимости замены сустава.
Среди препаратов медленного действия, влияющих на симптомы ОА (боль, скованность, ограничение функции), и, возможно, сдерживающих темпы прогрессирования ОА, безусловно, наиболее изучены глюкозамин, хондроитин сульфат, а также их комбинации . Многочисленные проведенные исследования эффективности вышеназванных препаратов при ОА продемонстрировали значительное положительное влияние глюкозамина и/или хондроитин сульфата на симптомы, а также течение заболевания. Однако полученные результаты касаются главным образом ОА коленных суставов (гонартроза), в меньшей степени изучена эффективность глюкозамина и/или хондроитин сульфата при КА.
В связи с изложенным выше нами проведено исследование, в котором было оценено влияние длительной (в течение 1 года) терапии Терафлексом (представляет собой комбинацию глюкозамина и хондроитин сульфата) на симптомы ОА тазобедренного сустава.
Больные КА были разделены на основную (терапия Терафлексом) и контрольную группы. В основную группу вошли 44 пациента с КА: 32 (72,7%) женщины и 12 (27,3%) мужчин со средним возрастом 48,6±12,6 года и средней длительностью КА 6,5±4,7 года. В соответствии с классификацией Келлгрена–Лоуренса I стадия КА имела место у 11 (25%), II – у 29 (65,9%) и III – у 4 (9,1%) исследованных. Характеристика больных основной группы представлена в таблице 1.
Контрольную группу составили 28 пациентов с КА: 19 (67,9%) женщин и 9 (32,1%) мужчин со средним возрастом 46,7±10,4 года и средней длительностью КА 6,7±5,9 года. В соответствии с классификацией Келлгрена–Лоуренса I стадия КА имела место у 6 (21,4%) больных, II – у 19 (67,8%), III – у 3 (10,8%) исследованных. Характеристика больных контрольной группы представлена в таблице 2.
Критериями включения в исследование были: первичный КА, отсутствие других заболеваний суставов, функциональный индекс Лекена (ФИЛ) для КА не менее 8 и не более 12 баллов, отсутствие тяжелой сопутствующей патологии, рентгенологическая стадия КА не менее I и не более III по Келлгрену–Лоуренсу.
В ходе исследования оценивали клинические показатели больных (выраженность боли по визуально-аналоговой шкале (ВАШ) при ходьбе и в покое, ФИЛ для КА, глобальный индекс WOMAC ) на момент включения в исследование, через 6 мес. и 1 год наблюдения за больными обеих групп.
Терафлекс назначался традиционно на протяжении 6 мес., а далее повторными курсами по 2 капсулы/сут в течение 2 мес. с перерывом на 1 мес. Общая длительность приема Терафлекса составила 10 мес. При усилении болей в суставах пациенты принимали НПВП. Всем больным контрольной группы с момента включения в исследование был рекомендован прием НПВП в сочетании с различными видами физиолечения. При достижении положительного эффекта лечения НПВП принимались лишь при усилении болей в суставах.
Статистическую обработку полученных данных проводили с помощью статистического пакета Statistica. Для описания характера распределения количественных признаков определялись средние величины и стандартное отклонение. Достоверность различий оценивалась с использованием t-критерия Стьюдента при нормальном распределении признака и с помощью U–критерия Манна – Уитни при ненормальном распределении. Различия считались достоверными при р<0,05.
Оценка полученных данных продемонстрировала положительное влияние терапии Терафлексом на симптомы КА. Уже через 6 мес. непрерывного лечения препаратом значительно уменьшились выраженность боли при ходьбе и в покое, скованность, улучшилась функция пораженных суставов. Данные динамики клинических показателей основной группы представлены в таблице 3. Положительная тенденция сохранилась и через 1 год приема Терафлекса повторными курсами (ФИЛ, ВАШ покоя и ходьбы, индекс WOMAC достоверно отличались от своих исходных значений).
В контрольной группе через 6 мес. лечения также была отмечена некоторая положительная динамика клинических показателей, однако через 1 год их значения утратили достоверность различий с исходными. Данные динамики клинических показателей контрольной группы представлены в таблице 4. Сравнительная оценка полученных результатов лечения в основной и контрольной группах отражена на рисунке 1, а данные о проценте положительных результатов лечения в основной и контрольной группах – на рисунке 2.
Следует отметить, что на фоне лечения Терафлексом уже через 6 мес. наблюдения около половины пациентов смогли полностью отказаться от приема НПВП или значительно снизить их суточное потребление. Данная тенденция сохранялась и через 1 год терапии.
Таким образом, полученные нами результаты продемонстрировали положительный симптоматический, противовоспалительный эффект длительного лечения Терафлексом при ОА тазобедренных суставов. Оценить влияние терапии Терафлексом на прогрессирование КА (структурно-модифицирующий эффект) мы планируем в более длительном исследовании.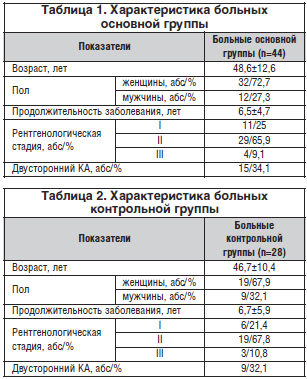


Литература
1. Коваленко В.Н., Борткевич О.П. Остеоартроз. Киев: МОРИОН, 2003.
2. Алексеева Л.И. Современные представления о диагностике, лечении и профилактике остеоартроза // РМЖ. 2000. Т. 8. № 9. С. 377–382.
3. Цурко В.В. Остеоартроз: проблема гериартрии. М: Ньюдиамед, 2004.
4. Цурко В.В. Остеоартроз: гериартрическая проблема // РМЖ. 2005. Т. 13. № 24. C. 1627–1631.
5. Доэрти М., Доэрти Д. Клиническая диагностика болезней суставов. Минск: Тивали, 1993.
6. Duncan R.C., Hay E.M., Saklatvala J. et al. Prevalence of radiographic osteoarthritis – it all depends on your print of view // Rheumatology. 2006. № 45. P. 757–760.
7. Duncan R., Peat G., Thomas E. et al. Symptoms and radiographic osteoarthritis: not as discordant as they are made out to be? // Digest for ours. Osteoarthritis. 2006. № 1. P. 3.
8. Kellgren J.H., Lawrence J.S. Radiographic assessment of osteoarthritis // Ann. Rheum. Dis. 1957. № 16. P. 494–501.
9. Link T.M., Steinbach L.S., Ghosh S. et al. Osteoarthritis: MR-imaging findings in different stages of disease and correlation with clinical findings // Radiology. 2003. № 226. P. 373–381.
10. Grassi W., Cervini C. Ultrasonography in rheumatology: an evolving technique // Ann. Rheum. Dis. 1998. Vol. 57. № 5. P. 268–271.
11. Grassi W., Lamanna G. Cervini C., Farina A. Sonographic imaging of normal and osteoarthritic cartilage // Semin. Arthritis Rheum. 1999. № 28. P. 398–403.
12. Hattori K., Ikeuchi K., Morita Y. et al. Quantitative ultrasonic assessment for detecting microscopic cartilage damage in osteoarthritis // Arthritis Res. Ther. 2005. № 7. P. 38–46.
13. Алексеева Л.И. Современные подходы к лечению остеоартроза // РМЖ. 2003. № 4. C. 85–88.
14. Zhang W., Moskovitz R.W., Nuki G. et al. OARSI recommendations for the management of hip and knee osteoarthritis, Part I: Critical appraisal of existing treatment guidelines and systematic review of current research evidence // Osteoarthritis and Cartilage. 2007. № 15. P. 981–1000.
15. Zhang W., Moskovitz R.W., Nuki G. et al. OARSI recommendations for the management of hip and knee osteoarthritis // Osteoarthritis and Cartilage. 2008. № 16. P. 137–162.
16. Zhang WB, Zhuang CY, Li JM, Yang ZP, Chen XL. Efficacy and safety evaluation of glucosamine hydrochloride in the treatment of osteoarthritis // Zhonghua Wai Ke Za Zhi. 2007. № 15. Р. 998–1001.
17. Lequesne M., Samson M., Gerard P., Mery C. Pain-function indices for the follow-up of osteoarthritis of the hip and the knee // Rev. Rheum. Mal. Osteoartic. 1990. № 57(9pt2). P. 32–36.
Область техники, к которой относится изобретение
Изобретение относится к области медицины, в частности к способу пластики крыши вертлужной впадины при ее дефектах и дисплазиях структурным аутотрансплантатом, как этап тотального бесцементного эндопротезирования тазобедренного сустава по поводу диспластического коксартроза, и может быть использовано в травматологии и ортопедии.
Уровень техники
Известен способ комбинированной аутопластики вертлужной впадины при заболеваниях тазобедренного сустава путем удаления патологически измененной ткани из очага поражения с последующим аутопластическим замещением операционного дефекта, при этом дополнительно в теле подвздошной кости формируют фигурный канал, через нижнюю плоскую часть которого к верхней губчатой костной поверхности свободного аутотрансплантата подводят аутотрансплантат из передне-верхней ости гребня крыла подвздошной кости на сосудисто-мышечной ножке, содержащей восходящую ветвь латеральной огибающей бедро артерии, и укрепляют его губчатым веществом книзу вплотную к ранее пересаженному свободному кортикально-губчатому костному или костно-хрящевому аутотрансплантату, а сосудисто-мышечную ножку пропускают через верхнюю конусовидную часть канала (см. пат. RU №2129841, МПК A61B 17/56, опубл. 10.05.1999 г.).
Недостатком данного способа является невысокая эффективность лечения заболеваний тазобедренного сустава и их последствий.
Известен способ формирования навеса крыши вертлужной впадины, включающий кортикотомию надацетабулярной части подвздошной кости, отгибание ее и введение в расщеп костного трансплантата, при этом сечение производят со стороны суставной поверхности от края крыши вертлужной впадины кверху и кнутри, плоскости сечения придают трехгранную форму, приподнимая надсеченный кортикальный слой, а трансплантат, имеющий форму соединенных между собой боковыми поверхностями под тупыми углами трех клиньев, вводят в расщеп и фиксируют винтами к подлежащей кости (см. пат. RU №2177757, МПК A61B 17/56, опубл. 10.01.2002 г.).
Недостатком данного способа является то, что округлая головка бедра не адаптируется к форме края крыши вертлюжной впадины, что нередко приводит к ее смещению в процессе фрезевой обработки ложа для чашки эндопротеза.
Наиболее близким по технической сущности и достигаемому положительному эффекту и принятым авторами за прототип является является способ аутопластического замещения операционных дефектов после некрэктомии очагов поражения в наиболее нагружаемых отделах вертлужной впадины костно-хрящевыми аутотрансплантатами, взятыми из нижних ненагружаемых отделов вертлужной впадины, включающий удаление патологически измененной ткани из очага поражения с последующим аутопластическим замещением операционного дефекта (см. И.Г.Маракуша. Артропластика тазобедренного сустава с замещением дефектов вертлужной впадины костно-хрящевыми аутотрансплантатами. // Вестник хирургии. — 1985. №2, — с.102-106).
Недостатком данного способа является невысокая жизнеспособность и улучшение условий кровоснабжения пересаживаемых свободных аутотрансплантатов путем одновременного применения аутотрансплантата на сосудисто-мышечной ножке.
Раскрытие изобретения
Задачей предлагаемого изобретения является разработка способа пластики крыши вертлужной впадины при ее дефектах структурным аутотрансплантатом, как этап тотального бесцементного эндопротезирования тазобедренного сустава по поводу диспластического коксартроза, обладающего повышением эффективности лечения заболеваний тазобедренного сустава по поводу диспластического коксартроза и их последствий.
Технический результат, который может быть получен с помощью предлагаемого изобретения, сводится к повышению эффективности лечения заболеваний тазобедренного сустава по поводу диспластического коксартроза и их последствий.
Технический результат достигается с помощью способа пластики крыши вертлужной впадины при ее дефектах и дисплазиях структурным аутотрансплантатом, включающего удаление патологически измененной ткани из очага поражения с последующим аутопластическим замещением операционного дефекта, при этом перед удалением патологически измененной ткани из очага поражения наносят кожный разрез в проекции большого вертела бедренной кости длиной от 10-15 см, начиная его на 4-5 см выше вертела, затем выполняют послойное рассечение подкожно-жировой клетчатки и широкой фасции бедра в том же направлении, что и кожный разрез, и на всем его протяжении длиной, необходимой для доступа к тазобедренному суставу, но без возможности обнажения надвертельной области, пересекают мышцу, напрягающую широкую фасцию бедра, выполняют продольное рассечение средней ягодичной мышцы и латеральной головки четырехглавой мышцы бедра на уровне большого вертела бедренной кости, при этом рассеченные мышцы разводят ретракторами Хомана, а капсулу сустава иссекают в пределах видимости, затем вывихивают бедро, пересекая при этом круглую связку бедра, выполняют остеотомию шейки бедренной кости, после чего головку удаляют, производят иссечение остатков капсулы, проводят обработку имеющейся вертлужной впадины и резецированной головки бедренной кости, которые имеют максимально конгруэнтную форму, затем резецированную головку бедренной кости и имеющуюся вертлужную впадину очищают от хрящевого покрова, удаляют зону субхондрального склероза до появления на их поверхности губчатого вещества, структурный аутотрансплантат прижимают к имеющийся диспластичной вертлужной впадине, превентивно фиксируют, контролируют положение и степени контакта трансплантата с ложем, выполняют фиксацию аутотрансплантата губчатыми винтами в его верхней части, затем формируют стандартными фрезами ложе под вертлужный компонент эндопротеза, при этом установку вертлужного компонента производят путем забивания его в полученное ложе, которое на 1,8-2,0 мм меньше диаметра вертлужного компонента.
В способе в качестве структурного аутотрансплантата используют резецированную головку бедренной кости.
Сущность способа пластики крыши вертлужной впадины при ее дефектах и дисплазиях структурным аутотрансплантатом заключается в следующем.
Проводят подробное рентгенологическое исследование, включая выполнение больным мультиспиральной компьютерной томографии, с последующей реконструкцией результатов в 3D компьютерную модель, что позволяет наиболее полно установить характер и степень дефекта крыши вертлужной впадины, по результатам которых проводят предоперационное планирование, в ходе которого определяют укорочение конечности за счет тазобедренного сустава, определяют центры вращения, это позволит в будущем определить место положения вертлужного компонента эндопротеза и степень его недопокрытия в месте дефекта крыши вертлужной впадины, также определяют линию резекции головки бедренной кости и положение бедренного компонента эндопротеза, при этом перед удалением патологически измененной ткани из очага поражения наносят кожный разрез в проекции большого вертела бедренной кости длиной от 10-15 см, начиная его на 4-5 см выше вертела, затем выполняют послойное рассечение подкожно-жировой клетчатки и широкой фасции бедра в том же направлении, что и кожный разрез, и на всем его протяжении длиной, необходимой для доступа к тазобедренному суставу, но без возможности обнажения надвертельной области, пересекают мышцу, напрягающую широкую фасцию бедра, выполняют продольное рассечение средней ягодичной мышцы и латеральной головки четырехглавой мышцы бедра на уровне большого вертела бедренной кости, при этом рассеченные мышцы разводят ретракторами Хомана, а капсулу сустава иссекают в пределах видимости, затем вывихивают бедро, пересекая при этом круглую связку бедра, выполняют остеотомию шейки бедренной кости, после чего головку удаляют, производят иссечение остатков капсулы, проводят обработку имеющейся вертлужной впадины и резецированной головки бедренной кости, которые имеют максимально конгруэнтную форму, затем резецированную головку бедренной кости и имеющуюся вертлужную впадину очищают от хрящевого покрова, удаляют зону субхондрального склероза, до появления на их поверхности губчатого вещества, структурный аутотрансплантат прижимают к имеющийся диспластичной вертлужной впадине, превентивно фиксируют, контролируют положение и степени контакта трансплантата с ложем, выполняют фиксацию аутотрансплантата губчатыми винтами в его верхней части, затем формируют стандартными фрезами ложе под вертлужный компонент эндопротеза, при этом установку вертлужного компонента производят путем забивания его в полученное ложе, которое на 1,8-2,0 мм меньше диаметра вертлужного компонента.
В способе в качестве структурного аутотрансплантата используют резецированную головку бедренной кости.
Краткое описание чертежей
На фиг.1 дан способ пластики крыши вертлужной впадины при ее дефектах и дисплазиях структурным аутотрансплантатом, линия резекции головки бедренной кости и положение бедренного компонента эндопротеза.
На фиг.2 — то же, выполнение кожного разреза в проекции большого вертела бедренной кости.
На фиг.3 — то же, выполнение остеотомии шейки бедренной кости согласно линии, определенной при предоперационном планировании.
На фиг.4 — то же, обработка вертлужной впадины и резерцированной головки бедренной кости, зона субхондрального склероза, хрящевой покров.
На фиг.5 — то же, прижатие аутотрансплантата, полученного из головки бедренной кости, суставной поверхностью к имеющейся диспластичной вертлужной впадине.
На фиг.6 — то же, выполнение привинтивного фиксирования спицами аутотрансплантата, контроль положения и степени контакта аутотрансплантата с ложем.
На фиг.7 — то же, выполнение фиксации аутотрансплантата губчатыми винтами в его верхней части.
На фиг.8 — то же, формирование ложа под вертлужный компонент эндопротеза.
На фиг.9 — то же, установка вертлужного компонента методом Preess-fit.
Осуществление изобретения
Примеры конкретного выполнения способа пластики крыши вертлужной впадины при ее дефектах структурным аутотрансплантатом.
Пример. Проводят подробное рентгенологическое исследование, включая выполнение больным мультиспиральной компьютерной томографии с последующей реконструкцией результатов в 3D компьютерную модель, что позволяет наиболее полно установить характер и степень дефекта крыши вертлужной впадины, по результатам которых проводят предоперационное планирование, в ходе которого определяют укорочение конечности за счет тазобедренного сустава, определяют центры вращения, это позволит в будущем определить место положения вертлужного компонента эндопротеза и степень его недопокрытия в месте дефекта крыши вертлужной впадины, также определяют линию резекции головки бедренной кости и положение бедренного компонента эндопротеза, см. фиг.1 (см. Травматология и ортопедия: Руководство для врачей / Под ред. Н.В.Корнилова. В 4 томах. — СПб.: Гиппократ, 2004. — Т.3: Травмы и заболевания нижней конечности / Под ред. Н.В.Корнилова и Э.Г.Грязнухина. — СПб.: Гиппократ, 2006. 896 с, с.156-158), при этом начальные этапы операции выполняют следующим образом. Положение больного на операционном столе на спине, с наклоном в контралатеральную сторону 20°, под тем или иным видом анестезии, после обработки операционного поля и отграничения его стерильным бельем, выполняют доступ к тазобедренному суставу. В данном случае он носит характер прямого латерального трансглютеального, кожный разрез наносят в проекции большого вертела бедренной кости длиной от 10-15 см, начиная его на 4-5 см выше вертела, см. фиг.2, затем выполняют послойное рассечение подкожно-жировой клетчатки и широкой фасции бедра в том же направлении, что и кожный разрез, и на всем его протяжении длиной, необходимой для доступа к тазобедренному суставу, но без возможности обнажение надвертельной области, далее пересекают мышцу, напрягающую широкую фасцию бедра, выполняют продольное рассечение средней ягодичной мышцы и латеральной головки четырехглавой мышцы бедра на уровне большого вертела бедренной кости, при этом рассеченные мышцы разводят ретракторами Хомана, капсулу сустава иссекают в пределах видимости, затем вывихивают бедро, пересекая при этом круглую связку бедра, далее выполняют остеотомию шейки бедренной кости согласно линии, определенной при предоперационном планировании, см. фиг.3, после чего головку удаляют, но не выбрасывают, поскольку ее используют в качестве структурного трансплантата, после удаления головки производят иссечение остатков капсулы (см. Травматология и ортопедия: Руководство для врачей / Под ред. Н.В.Корнилова. В 4 томах. — СПб.: Гиппократ, 2004. — Т.3: Травмы и заболевания нижней конечности / Под ред. Н.В.Корнилова и Э.Г.Грязнухина. — СПб.: Гиппократ, 2006. 896 с. с.158-159), далее приступают к обработке имеющейся вертлужной впадины и резецированной головки бедренной кости, которые имеют максимально конгруэнтную форму, резецированную головку бедренной кости и имеющуюся вертлужную впадину очищают от хрящевого покрова, удаляют зону субхондрального склероза до появления на их поверхности губчатого вещества, см. фиг.4, затем аутотрансплантат, полученный из головки бедренной кости, суставной поверхностью прижимают к имеющийся диспластичной вертлужной впадине, см. фиг.5, и превентивно фиксируют двумя спицами, см. фиг.6, контролируют положение и степени контакта трансплантата с ложем, при необходимости выполняют коррекцию положения аутотрансплантата, выполняют фиксацию трансплантата 2-3 губчатыми винтами в его верхней части, чтобы в последующем винты не помешали формированию ложа под вертлужный компонент эндопротеза, см. фиг.7, затем формируют стандартными фрезами ложе под вертлужный компонент эндопротеза, согласно данным, полученным при предоперационном планировании, добиваясь полного покрытия вертлужного компонента костной тканью, см. фиг 8, при этом установку вертлужного компонента производят методом Press-fit, то есть забивание его в полученное ложе, которое на 2 мм меньше диаметра вертлужного компонента, см. фиг 9, в результате чего происходит еще более плотная фиксация аутотрансплантата к ложу, при этом имплантацию бедренного компонента и ушивание раны проводят по общепринятой методике (см. Травматология и ортопедия: Руководство для врачей / Под ред. Н.В.Корнилова. В 4 томах. — СПб.: Гиппократ, 2004. — Т.3: Травмы и заболевания нижней конечности / Под ред. Н.В.Корнилова и Э.Г.Грязнухина. — СПб.: Гиппократ, 2006. 896 с., с.160-163).
По поводу пластики крыши вертлужной впадины при ее дефектах и дисплазиях структурным аутотрансплантатом, при диспластическом коксартрозе наблюдалось и оперировалось 49 больных.
Клинический пример.
Больной К. 58 лет поступил в клинику по поводу диспластического коксартроза, больному тремя годами ранее произведено тотальное эндопротезирование тазобедренного сустава, поскольку во время операции обнаружена плоская и резко скошенная вертлужная впадина с дефектом переднее-верхней стенки, то по предлагаемому изобретению была проведена операция. Со второго дня послеоперационного периода больному разрешили сидеть в кровати. С третьих суток ходить на костылях без опоры на оперированную ногу. К трем месяцам после операции нагрузка на оперированную конечность доводилась до 100%. Проводилось контрольное рентгенографическое исследование спустя 2 недели и 2-3-6 месяцев с момента операции с последующей сравнительной оценкой состояния структурного аутотрансплантата, степени его интеграции к воспринимающему ложу, а также положения и ориентации компонентов эндопротеза тазобедренного сустава.
Предлагаемое изобретение по сравнению с прототипом и другими известными техническими решениями имеет следующие преимущества:
— повышение эффективности лечения заболеваний тазобедренного сустава по поводу диспластического коксартроза;
— уменьшение осложнений после эндопротезирования на 4,5%.



