Симптомы инсульта мозга
Содержание
Инсульты бывают ишемические и геморрагические. Ишемический инсульт встречается в среднем в пять-шесть раз чаще, чем геморрагический
- Этиопатогенез ишемического инсульта
Чаще всего наблюдаются два типа ишемического инсульта — тромботический, обусловленный первичной тромботической окклюзией мозговых сосудов, и эмболический, обусловленный эмболией из отдаленного источника. Первичная тромботическая окклюзия обычно развивается в сосуде, просвет которого сужен в результате атеросклероза, например в сонной или базилярной артерии. Самый частый источник эмболии — сердце. Кардиогенная эмболия может возникать при мерцательной аритмии или инфаркте миокарда (из-за пристеночного тромбообразования), при протезированных клапанах, инфекционном эндокардите, миксоме предсердий. Реже источником эмболов служат изъязвленные атеросклеротические бляшки в дуге аорты и устье магистральных сосудов. Атеросклероз сонной артерии может быть причиной ее первичной тромботической окклюзии, но чаще это источник эмболии внутричерепных артерий. К редким причинам ишемического инсульта относятся тромбоз мозговых вен, эритроцитоз, менинговаскулярный сифилис, артерииты при туберкулезе и коллагенозах, расслаивающая аневризма аорты.
- Классификация ишемического инсульта
Инсульты классифицируют в соответствии с их предполагаемыми патофизиологическими механизмами. Прежде всего оценивают клинические проявления и их динамику. В зависимости от того, насколько долго сохраняется неврологический дефект, выделяют преходящую ишемию мозга (ПИМ), называемую также транзиторной ишемической атакой (ТИА) с полным восстановлением в течение 24 часов, малый инсульт (срок полного восстановления — больше 24 часов, но меньше одной недели) и завершившийся инсульт (дефект сохраняется более одной недели). Неврологические расстройства при эмболиях обычно развиваются внезапно и сразу достигают максимальной выраженности; инсульту могут предшествовать приступы преходящей ишемии мозга, однако они наблюдаются значительно реже, чем в случае первичной тромботической окклюзии. При тромботических инсультах неврологическая симптоматика обычно нарастает постепенно или ступенчато в виде серии острых эпизодов в течение нескольких часов или суток (прогрессирующий инсульт). В дальнейшем в основе диагноза лежит определение:
- локализации очага поражения;
- характера сосудистого патологического процесса;
- сведений о сохранных путях коллатерального кровотока в зоне ишемии.
Если неизбежным фактором адекватной терапии можно назвать точный диагноз, то необходимым условием корректности последнего является изучение клинической картины заболевания, то есть неврологического состояния больного непосредственно у его постели.
Таким образом, диагноз симптомокомплекса инсульта основывается на динамике клинической картины и характерном наборе субъективных и объективных симптомов.
- Клиника ишемического инсульта
Инсульты в 80% случаев наблюдаются в системе средней мозговой артерии, а в 20% — в других мозговых сосудах.
Ишемия в бассейне средней мозговой артерии. Имеющийся клинический опыт показывает, что до развития инфаркта мозга о сужении сосуда обычно «предупреждают” ТИА в бассейне средней мозговой артерии. Их симптоматика сходна с таковой при ТИА, связанных с ухудшением гемодинамики в результате выраженного стеноза внутренней сонной артерии, однако в противоположность последней ствол средней мозговой артерии и ее ветви обычно подвергаются закупорке эмболом.
В нашей стране, как и в других цивилизованных государствах мира, инсульт является третьей по значимости причиной увеличения смертности после сердечно-сосудистых и онкологических заболеваний. Инсульт — это та патология, которая поражает трудоспособное население, приводя к длительной госпитализации, стойкой инвалидизации больных, ухудшению качества жизни их семей и значительным экономическим затратам государства
За несколько дней до инсульта у больного возникают головные боли, слабость, помутнение в глазах, головокружение, преходящее онемение в руке и ноге. Явления нарастают, и в один из дней утром рука и нога перестают действовать. Сознание больной может не терять, но отмечает «туман” в голове. А может быть развитие внезапное, «инсультообразное”, которое в остром периоде практически не отличается от геморрагического инсульта. При развитии правосторонней гемиплегии расстройство речи в виде более или менее выраженной афазии может быть стойким. При поражениях теменной области коры и внутренней капсулы мозга у больного развиваются анозогнозия, метеморфопсия, аутоагнозия с бредовыми построениями. У больного имеется расстройство схемы тела с искаженным восприятием на границе выпавшего поля зрения, но он не понимает своего состояния.
Весьма тяжелы случаи заболевания, при которых имеется обширный очаг размягчения в результате выключения как подкорковых, так и корковых ветвей средней мозговой артерии. Часто такие больные не поднимаются с постели, особенно, если у них развивается ранняя сгибательная контрактура в парализованной ноге, слабо поддающаяся лечебному воздействию. В сравнительно нетяжелых случаях через 1-2 месяца движения в конечностях начинают восстанавливаться, однако восстановление в ноге идет лучше, чем в руке.
При часто встречающейся окклюзии отдельных ветвей средней мозговой артерии возникают неполные синдромы: моторная афазия с контрлатеральным парезом руки и мимической мускулатуры нижней половины лица при окклюзии верхних ветвей, сенсорная афазия при окклюзии нижних ветвей и другие. Моно- и гемиплегии оставляют неизгладимый след в моторике больного, иногда гемиплегическая походка (чаще в виде известной позы Вернике-Манна с согнутой рукой и разогнутой ногой) может остаться на всю жизнь. В парализованной конечности отмечаются вазомоторно-трофические расстройства: похолодание, цианоз, отечность, артропатии с резкой болезненностью в суставах, что ведет к их щажению и тем самым содействует развитию контрактур и атрофий. Вот почему восстановительные мероприятия в реабилитационном периоде столь важны.
Ишемия в бассейне передней мозговой артерии. При тех же общих симптомах своеобразием клинической картины является преобладающее при гемипарезах поражение ноги, иногда в виде гемиплегии. При левостороннем очаге наблюдается преходящая моторная афазия. Часто выступают характерные для поражения лобных долей нарушения психики.
Ишемия в бассейне задней мозговой артерии. Картина весьма многообразна в зависимости от места окклюзии. Так, при закупорке всего русла могут быть гемипарез, гемианестезия или гемигиперестезия, гемиатаксия, гемианопсия, а при левосторонней локализации еще и сенсорная афазия. При закупорке только корковой ветви отмечается гемианопсия, нижне-таламической — хореоатетоз, мучительные гиперпатии. Последние купируются мощными нейролептиками (аминазин).
Ишемия в бассейне базилярных и позвоночных артерий. Клиническая картина весьма разнообразна: от тетраплегии с двусторонним горизонтальным парезом взора при тромботической окклюзии ствола базилярной артерии; нистагма, головокружения, тошноты, дисфагии при стенозе внутричерепного отдела позвоночной артерии — до головных болей, головокружений и шума при часто встречающейся вертебро-базилярной недостаточности на фоне шейного остеохондроза.
Ишемия в бассейне сонной артерии. Окклюзия сонной артерии (стеноз, тромбоз, эмболия) чаще протекает бессимптомно, в случае же возникновения неврологических нарушений они бывают связаны главным образом с недостаточностью кровоснабжения в бассейне средней мозговой, а иногда и передней и задней мозговой артерии. Обычно имеет место так называемое «мерцание” симптомов. Развивающийся гемипарез, а то и полная гемиплегия с афазией и сочетающаяся с ними альтернирующая слепота через несколько минут или часов исчезают. Это обусловлено восстановлением тока крови по виллизиеву кругу, через анастомозы с наружной сонной артерией. Усиленная пульсация в артериях лица, низкое давление в артериях сетчатки обычно указывают на стеноз или окклюзию внутренней сонной артерии с той же стороны. Тромб в магистральном сосуде на шее может быть прощупан, верифицирован ангиографически и срочно удален хирургом.
Лакунарный инфаркт. Развивается вследствие окклюзии мелких пенетрирующих артерий атеросклеротической бляшкой или липогиалинозом, что чаще встречается при артериальной гипертонии и сахарном диабете; однако возможна и их эмболия. В основном они протекают бессимптомно, скудная единичная симптоматика (дизартрии, неловкость кисти, парез взора или атаксический гемипарез) протекают на фоне нормального ЭЭГ (диаметр поражения не превышает 1 см).
Преходящие нарушения мозгового кровообращения. Эти нарушения протекают чаще всего в виде ТИА, когда очаговый дефицит регрессирует за сутки. Специфические симптомы этих атак позволяют судить о вовлеченности той или иной артерии и о локализации очага, что имеет немаловажное значение для определения тактики лечения. Последняя планируется чаще всего с учетом не только и даже не столько локализации, сколько характера поражения. Например, единственный приступ расстройства речи и слабости кисти, купируемый через 12 часов, скорее говорит об эмболии, и нужно искать источник. Кратковременные (до 15 минут) и частые (5-10 раз в день) одиночные приступы говорят о преходящих нарушениях мозгового кровообращения, местной окклюзии на фоне атеросклероза с недостаточностью развития системы коллатералей.
Таким образом, становится понятным, что при преходящих нарушениях с транзиторными ишемическими атаками особенно важное значение имеют:
- недостаточность коллатерального притока крови к зоне ишемии;
- состояние свертывающей и противосвертывающей систем крови;
- уровень артериального давления, холестерина сыворотки крови, наличие нарушенной толерантности к углеводам, как факторы риска развития атеросклеротического процесса (тромбообразование, изъязвление, эмболия, стеноз), ведущие к окклюзии сосудов в головном мозге.
- Диагностика ишемического инсульта
Несмотря на то что уже по данным анамнеза, неврологического обследования и лабораторных данных можно поставить диагноз, важное значение как в диагностике, так и в дифференциальной диагностике и прогнозировании исхода имеют следующие методы:
- компьютерная томография, которая позволяет отличить инфаркт от кровоизлияния, то есть уточнить характер инсульта (геморрагический или ишемический);
- магнитно-резонансная ангиография, которая не очень пригодна для экстренных случаев, но безопасна вследствие своей неинвазивности;
- допплерография, особенно транскраниальная, которая позволяет оценить состояние мозгового кровотока;
- церебральная ангиография, которая незаменима, если планируется операция;
- ЭЭГ, которая выявляет зоны коркового и подкоркового поражения;
- сцинтиграфия и позитронно-эмиссионная томография, которые позволяют оценить мозговой метаболизм и имеют значение в стадии преходящих нарушений мозгового кровообращения и в самом начале инсульта.
В настоящее время совершенствование клинической диагностики и нейрорадиологических методов исследования позволяет уточнить характер и локализацию инсультов, а также изучить сопутствующие им поражения сосудов с высокой частотой и точностью, что делает лечение более целенаправленным, возможным и обязательным.
- Лечение ишемического инсульта
Лечение при ишемическом инсульте преследует в основном три цели:
- предупреждение инсульта благодаря уменьшению факторов риска;
- предотвращение первого или повторного инсульта путем удаления лежащего в его основе поражения — например, проведение каротидной эндартерэктомии;
- профилактику вторичного поражения мозга за счет поддержания адекватной перфузии в краевых участках ишемических зон и уменьшения отека.
Современные патогенетические представления. Развитие острой церебральной ишемии запускает патобиохимические каскадные реакции, исходом которых и является формирование инфаркта.
Анализ «ишемического каскада” свидетельствует о двух возможных направлениях терапии ишемического инсульта: первое – улучшение перфузии ткани мозга, и второе – нейропротективная или цитопротективная терапия. Наиболее перспективно раннее и комплексное вмешательство. Эффективность лечебных мероприятий зависит от своевременности их начала и от преемственности терапии во всех периодах заболевания.
Система поэтапного оказания медицинской помощи. В России разработана и функционирует следующая система оказания медицинской помощи больным мозговым инсультом:
1. Догоспитальный этап (специализированные неврологические и линейные бригады скорой помощи);
2. Этап интенсивной терапии (отделения нейрореанимации, блоки интенсивной терапии, нейрохирургические отделения);
3. Этап восстановительного лечения (неврологические отделения, реабилитационные отделения, центры);
4. Диспансерный этап (районный невропатолог, терапевт).
Преемственность лечебных мероприятий определяется общей тактикой ведения больного и сопряжена с решением лечебных и организационных проблем. Наряду с дифференцированной терапией инсультов важную роль играет базисная терапия, направленная на поддержание жизненно важных функций организма. Чем тяжелее протекает инсульт, тем более необходимой, многосторонней и комплексной становится базисная терапия, которая проводится индивидуально, под контролем лабораторных показателей, функций всех органов и систем (см. сокращенную схему кафедры неврологии и нейрохирургии РГМУ, 1997).
Базисная терапия. Базисная терапия предполагает в первую очередь правильный уход за больным. В течение нескольких суток больной должен находиться в горизонтальном положении с приподнятыми ногами. С самого начала необходимо проводить профилактику гипостатической пневмонии, гнойной язвы роговицы, пролежней, ранних контрактур. После завершения инсульта уже через 24-48 часов необходимо начинать пассивные движения в суставах, поворачивать больного в постели, очищать ему дыхательные пути. При упорной рвоте вводят назогастральный зонд, при дисфагии – показано парентеральное питание. Контролируют функцию выделительных органов.
Лечение инсультов предполагает сочетанное применение множества лекарственных, немедикаментозных, оперативных средств, назначаемых строго по показаниям и под контролем лаборатории, с участием кардиологов и при необходимости реаниматологов, нейрохирургов
Контроль артериального давления проводится с целью установления систолического давления на уровне 10 мм выше «рабочих” цифр, диастолического — не выше 120 мм рт. ст. Необходимо лечение сопутствующей патологии сердца: антиаритмические препараты по показаниям, противоинфекционные — при септическом эндокардите и т. д.
Регуляция водно-солевого обмена проводится инфузионной терапией под контролем рН-метрии, осмолярности мочи и крови, электролитов и биохимического анализа крови.
В борьбе с отеком мозга и в целях профилактики повышения внутричерепного давления предпочтителен дексазон (8+4+4+4 мг в/в) — при отсутствии тяжелых форм сахарного диабета, внутренних кровотечений, злокачественной артериальной гипертензии — или осмотические диуретики (2 раза в сутки реоглюман, маннитол 15% — 200 мл в/в капельно, через 10-15 минут лазикс 20 мг в/в).
В проведении базисной терапии должны участвовать кардиологи и реаниматологи.
Антикоагулянты. Их назначают только при возможности контроля за свертываемостью крови и при отсутствии геморрагического диатеза, обострения язвенной болезни, тяжелых почечных и печеночных болезней.
Вводят гепарин по 5000-10000 ЕД каждые 4 часа в/в струйно, можно капельно 1000 ЕД/час. Дозу коррегируют так, чтобы время свертывания или активное тромбопластиновое время увеличилось в два раза. Показатели свертывания определяются ежедневно. В случае передозировки гепарина, определяемого лабораторно или клинически (петехии, микрогематурия), вводят протамин (5 мл 1% р-ра протамина в 20 мл физ. р-ра). Его можно вводить, согласно инструкции изготовителя, через четыре часа после введения гепарина.
Через 1-2 суток с отменой гепарина переходят на непрямые антикоагулянты: фенилин, синкумар, варфарин, дикумарин. Нужен ежедневный контроль протромбинового времени. Назначают эти препараты на протяжении 3-4 недель. Влияние непрямых антикоагулянтов устраняют в срочных случаях плазмой (20 мл/кг) или в/в введением 50 мг витамина К. После выписки больного протромбиновое время можно определять 1-2 раза в месяц.
Антиагреганты. Применение антиагрегантов обусловлено тем, что агрегация тромбоцитов запускает процесс свертывания крови. Они назначаются уже с 3-5 дня инсульта и могут применяться годами и даже пожизненно курсами или постоянно. Наибольший клинический, хотя и противоречивый опыт накоплен в отношении аспирина, дипириданола и тиклида. Аспирин, избирательно подавляющий синтез тромбоксана А-2, назначается в основном в дозе 1 мг/кг, хотя есть исследования, подтверждающие эффективность уже 30 мг в сутки, и наоборот, есть работы, которые свидетельствуют об эффективности дозы 325 мг в сутки. Тиклид назначается по 250 мг 2 раза в сутки. Необходим контроль состояния желудочно-кишечного тракта с возможной профилактикой и лечением антацидами, минеральной водой, фитотерапией, и контроль периферической крови.
Индивидуальная антиагрегантная терапия предполагает назначение сосудистых препаратов, обладающих антиагрегантной активностью: трентала, бета-блокаторов, антагонистов кальция, стугерона, кавинтона, эуфиллина. Можно вводить в/в в остром периоде гордокс и контрикал (см. схему).
Даже при начальных проявлениях недостаточности кровоснабжения мозга (НПНКМ) рекомендуется назначение антиагрегантов, имеющих в своем составе никотиновую кислоту (эндурацин), полиненасыщенные жирные кислоты (эйконол) или йод (сплат, спирулина, морская капуста).
Сосудорасширяющие препараты. Амилнитрит, папаверин, изоксуприн могут повысить мозговой кровоток, однако они не очень эффективны. Кроме того, вазодилятация может привести к снижению кровоснабжения именно в зоне ишемии («обкрадывание”).
Нейропротекторная терапия. Нейро- или цитопротекторная терапия необходима для воздействия на основные звенья «ишемического каскада”. С первого же дня в/в капельно можно назначать церебролизин (10-20 мл), ноотропил (12 г в сутки), глицин (1-2 г сублингвально), семакс (6-9 мг интраназально). Эффективен аплегин по 5 мл в сутки в/в капельно. После 10-15 дней можно перейти с парентерального на пероральное введение препаратов.
Прочие средства. В последние годы вновь возник интерес к тромболитикам — стрептокиназе, урокиназе и, особенно, алтепазе и назаруплазе, синтезированных методами генной инжерии и обладающих избирательным действием на тромб. Однако результаты их исследований, так же как и налоксона (антогониста наркотических анальгетиков), барбитуратов, блокаторов глутаматных рецепторов, — неоднозначны. Эти препараты пока не имеют клинического значения.
Реабилитационные мероприятия. В фазе восстановления, когда состояние больного улучшается, важное значение имеют логопедическая помощь, массаж, физиотерапия, рефлексотерапия, лечебная гимнастика.
Хирургическое лечение. Оно возможно только при строгом учете показаний и противопоказаний и в специализированных госпиталях и центрах. Наиболее распространенная операция — это каротидная эндартерэктомия (КЭ), которую проводят при стенозе артерии более 70%, а также при менее выраженном стенозе, если имеются изъязвления бляшки. Операцию можно провести как с профилактической целью, так и неотложно, во время инсульта. Анализ литературы показал, что наиболее часто КЭ проводится у больных, перенесших ТИА или малый инсульт в результате атеросклеротического стеноза внутренней сонной артерии.
Реже проводят операции при поражении внечерепного отдела позвоночных артерий, при синдроме подключичного «обкрадывания”, поражениях дуги аорты, мозжечковом инфаркте со сдавлением ствола мозга (декомпрессия задней черепной ямки).
Литература
В Украине ежегодно происходит около 111 тысяч случаев инсульта и почти каждый третий больной умирает. 24 Канал обратился к врачу-неврологу Кужель Наталье, чтобы узнать, что такое инсульт, почему возникает, как распознать, какую первую помощь нужно оказать больному и что делать, чтобы уменьшить риск возникновения заболевания.
Читайте также: Все о сахарном диабете: первые симптомы, профилактика и факторы риска
Инсульт – нарушение работы и повреждение тканей мозга, которое возникает вследствие нарушения его кровообращения. Возникает он из-за внезапного прекращения поступления крови в клетки мозга, из-за чего они начинают отмирать.
Врачи распознают два вида инсульта: ишемический (возникает из-за блокировки сосудов тромбом) и геморрагический (возникает из-за разрыва сосуда, что приводит к кровоизлиянию). Более распространенным является ишемический инсульт – он составляет около 80% всех случаев.
Инсульт: инфографика
Михаил Игоревич Бевза пережил 2 ишемических инсульта, и, по его словам, больному трудно понять, что происходит, и самостоятельно диагностировать инсульт почти невозможно. Врач объясняет это тем, что болезнь повреждает мозг и больные могут даже не понимать, где они во время приступа. Поэтому для больных важно, чтобы люди, которые находятся рядом, смогли распознать симптомы инсульта, поскольку они не смогут себе помочь.
Симптомы
Михаил Игоревич вспоминает, что все началось очень внезапно с приступа ужасной головной боли.
Это была самая сильная головная боль, которую я чувствовал в жизни, хотелось встать, но не смог этого сделать, появилось ощущение онемения, а со временем вообще перестал чувствовать руку. Когда я попытался заговорить, то понял, что не могу произнести ни слова, а только отдельные звуки,
– рассказал больной инсультом Михаил Бевза.
Врач-невролог подтверждает, что это классические симптомы инсульта, и отмечает: если вы услышите от кого-то подобные жалобы – немедленно вызывайте скорую.
Ишемический инсульт
Инсульт – первые симптомы
- Внезапная и очень сильная головная боль (больные ее называют сильнейшей в жизни)
- Онемение конечностей, лица или даже паралич (преимущественно с одной стороны тела)
- Нарушение зрения
- Нарушение равновесия, координации и головокружение
Читайте также: Чем опасно недосыпание для подростков
Реабилитация после инсульта
Как распознать инсульт
По словам врача, распознать инсульт не всегда просто, но существует несколько действий, которые с большой вероятностью помогут определить заболевание.
- Попросите больного показать язык (у здорового человека он без искажений)
- Попросите поднять обе руки
- Попросите улыбнуться
- Попросите повторить простое предложение.
Если хоть с одним пунктом у человека возникли проблемы – нужно немедленно вызвать скорую. Чем дольше мозг будет недополучать кислород, тем больше клеток погибнет.
Как действовать до приезда скорой
В больнице больному должны немедленно ввести препарат T-PA, который предназначен для разжижения крови и растворяет тромбы, и по показаниям провести тромболитическую терапию. Пока не приехала скорая, больному нужно дать доступ к свежему воздуху (открыть окна или форточку),
– отметила врач-невролог Кужель Наталья.
Чтобы улучшить кровообращение, нужно чтобы больной лег, а под голову и плечи подложить подушки, голова должна быть приподнята над уровнем тела примерно на 30 градусов. Также нужно расстегнуть ремни, воротник и снять узкие вещи.
Читайте также: Кофе полезен для сердца, – ученые
При возможности измерьте артериальное давление, чтобы сообщить врачам скорой помощи, это поможет сохранить драгоценное время.
Измерение давления
Инсульт – профилактика заболевания
- Контролируйте давление (высокое давление – основная причина возникновения заболевания).
- Следите за весом тела и уровнем холестерина.
- Регулярно проверяйте сердце (ежегодно посещайте врача-кардиолога, даже при отсутствии жалоб на сердце, это поможет выявить болезнь на ранних стадиях).
- Следите за уровнем сахара в крови и занимайтесь профилактикой диабета (диабет и высокий уровень сахара повышает риск возникновения в 2,5 раза).
- Избегайте стрессов и следите за здоровым сном.
Редакция 24 Канала желает всем здоровья. Берегите себя!
Первая помощь при инсульте: видео
Вструктуре смертности населения во многих странах мира сердечно-сосудистые заболевания занимают первое место. Среди лиц с заболеваниями нервной системы пациенты с нарушением мозгового кровообращения составляют от 15 до 24,6%. В России в структуре смертности от болезней системы кровообращения первое место занимает ишемическая болезнь сердца (48%), второе – сосудистые заболевания мозга (39%). За последние 40 лет в странах с высоким уровнем дохода на душу населения заболеваемость инсультами увеличилась на 42%, в то время как в странах со средним и низким уровнем – более чем на 100%. Несмотря на то, что в последние годы в ряде развитых стран Европы прогнозируется снижение заболеваемости инсультом, ожидается, что общее число больных инсультом через 20 лет увеличится на 11%, главным образом из-за старения населения.
В результате исследований, проведенных в России, установлено, что заболеваемость инсультом является одной из самых высоких среди всех видов сердечно-сосудистых заболеваний, а смертность от него устойчиво занимает второе место в структуре общей смертности населения, уступая лишь кардиальной патологии.
В некоторых регионах России инсульт встречается чаще, чем инфаркт миокарда. В среднем 60% лиц, перенесших инсульт, становятся инвалидами, причем большинство из них зависят от окружающих или нуждаются в постороннем уходе. За последние 5 лет в РФ от болезней системы кровообращения умерли 6,4 млн человек, из них 18,9% лиц трудоспособного возраста .
В стране с 2007 г. реализуется программа по борьбе с инсультом, на проведение которой были выделены большие государственные средства. Разработанная программа стала отраслеобразующей, потому что с нее начался переход от советской двухуровневой системы здравоохранения к современной трехуровневой системе. Организован стратегический второй уровень путем создания межрегиональных, межрайонных, межмуниципальных центров и их размещения с учетом доступности для населения, которое проживает на закрепленной территории, с возможностью реализации «золотого часа» – поступления из любой точки региона в течение часа. Эта программа выстроена таким образом, чтобы врачи могли влиять на снижение смертности от инсульта и через снижение заболеваемости, и через снижение летальности. Изменилась структура смертности населения, во многих регионах инсульт сместился на третье место. Снижена летальность от инсульта, особенно в сельской местности. Наметилась тенденция к снижению заболеваемости инсультом .
Основным показателем, характеризующим мозговое кровообращение, является мозговой кровоток.
В норме объемный мозговой кровоток составляет 50–55 мл/мин на 100 г вещества мозга. При этом из крови экстрагируется 50% кислорода и 10% глюкозы. При аэробном гликолизе из 1 молекулы глюкозы синтезируются 33, при анаэробном – 2 молекулы АТФ. Около 60–70% энергии направляется на поддержание ионных каналов, остальная – на синтез, высвобождение и функционирование нейромедиаторов и клеточных структур. Адекватное кровоснабжение обеспечивается механизмами ауторегуляции, которые поддерживают тканевый мозговой кровоток на постоянном уровне независимо от изменений системного АД. Это очень важно для функционирования головного мозга. В настоящее время достаточно хорошо изучены критические уровни снижения мозгового кровотока. Выделяют несколько степеней реакции тканей головного мозга на это снижение. При первом уровне снижения (кровоток менее 50 мл/100 г ткани мозга/мин) происходит снижение синтеза белков и экспрессии генов. При втором уровне происходят активация анаэробного гликолиза, увеличение экстракции из крови лактата, развитие лактацидоза вплоть до токсического отека мозга. Второй уровень наблюдается при глубокой ишемии мозга (снижение объемного кровотока до 30 мл/100 г ткани мозга/мин). Третий – наиболее изученный уровень (снижение объемного кровотока до 20 мл/100 г ткани мозга/мин), при нем отмечаются дестабилизация клеточных мембран, нарушения каналов ионного транспорта, высвобождение избыточно возбуждающих нейротрансмиттеров. Особое значение при этом имеет глутаматный выброс . Установлено, что метаболизм кислорода и глюкозы в наибольшей мере страдает в центральной зоне ишемизированной территории, в меньшей – в демаркационной. Область мозга с наиболее выраженным снижением кровотока очень быстро необратимо повреждается – в течение 6–8 минут с момента развития инфаркта («сердцевина», или «ядерная» зона, ишемии).

В течение нескольких часов центральная область инфаркта окружена ишемизированной, но живой тканью, т.н. зоной ишемической «полутени», или пенумбры (penumbra). В области пенумбры в целом сохранен энергетический метаболизм и присутствуют лишь функциональные, но не структурные изменения. Это область критической перфузии, где нейрональная функция снижена из-за отсутствия адекватного метаболизма, но клетки остаются жизнеспособными с сохранным ионным гомеостазом. Так как резерв локальной перфузии исчерпан, нейроны в области пенумбры становятся чувствительными к любому дальнейшему падению перфузионного давления. За счет зоны пенумбры происходит постепенное увеличение размеров инфаркта. Именно пенумбра является главной мишенью лечения в первые часы и дни после развития инсульта. Зона ишемической «полутени» представляет не только топографическую зону, но и динамический процесс распространения биоэнергетических нарушений от ядерной зоны инфаркта к периферии. Продолжительность существования пенумбры индивидуальна у каждого больного и определяет границы временного периода, внутри которого с наибольшей эффективностью могут проводиться лечебные мероприятия («терапевтическое окно»). Патогенетический каскад, имеющий место при ишемии мозга, является сложным механизмом, протекающим на клеточном и субклеточном уровнях (рис. 1).
Скорость развития ишемическо-гипоксического каскада, на первом этапе которого всегда нарушаются энергосинтез и энергообмен, напрямую зависит от количества энергии, необходимой для функционирования каждого конкретного органа. Скорость развития ишемического каскада прямо пропорциональна степени снижения кровотока и может измеряться минутами или часами при острых расстройствах кровообращения, а также месяцами или годами при хронических. При ишемическо-гипоксическом каскаде депрессия синтеза АТФ (энергодефицит) сопровождается одновременной активацией выброса высокореактивных свободных радикалов и интермедиатов кислорода со свободной валентностью (окислительный стресс). Таким образом, энергодефицит и окислительный стресс являются даже не звеньями одной патологической цепи, а двумя сторонами патогенеза. Многочисленные промежуточные метаболиты энергосинтеза обладают высокой активностью, обусловленной их свободными валентностями. Они легко вступают в химические реакции с другими метаболитами и, становясь для соседних клеток эндотоксинами, последовательно повреждают и клеточные органеллы, и клеточные мембраны, и ткани, и органы.
Первичный энергодефицит провоцирует глутаматную эксайтотоксичность, являющуюся главным механизмом повреждения клеток при ишемии и гипоксии. Повреждение это обусловлено активацией глутаматных рецепторов возбуждающими аминокислотами (глутаматом и аспартатом). В результате развития ишемического каскада происходят деполяризация клеточных мембран, высвобождение глутамата, активация NМDА-рецепторов, активация кальциевых каналов. Далее повышается уровень внутриклеточного кальция, происходит активация ферментов, увеличивается синтез оксида азота и образование свободных радикалов. В результате этих процессов возникает необратимая клеточная смерть, или апоплексическая деполяризация нейронов. Лечение в этом случае должно быть направлено на разрыв цепи ишемического каскада.
Внутриклеточный ацидоз развивается при внутриклеточном накоплении ионов водорода и лактата. Ацидоз влияет на окислительное фосфорилирование митохондрий и способствует развитию внутриклеточного отека. Очень важный этап ишемического каскада – внутриклеточная гиперкальциемия. Концентрация ионов кальция способствует деполяризации мембран вследствие внутриклеточной гипонатриемии, которая приводит к повреждению нейронов. Происходят активация АТФ-киназы, повышение внутриклеточного АТФ, активация кальций-зависимых протеаз, фосфолипаз, нарушение фосфорилирования белков. Это приводит к нарушению синтеза белков и экспрессии генов. Таким образом, внутриклеточная гиперкальциемия запускает механизм, приводящий к активации внутриклеточных ферментов, что в свою очередь приводит к нарушению синтеза белков.
Окислительный стресс является универсальным патофизиологическим феноменом при многих патологических состояниях, при этом нервная система наиболее чувствительна к окислительному стрессу . В этих случаях основным фактором, повреждающим митохондриальные, плазматические и микросомальные мембраны, является высокоактивный гидроксильный радикал ОН. Повышенная продукция свободных радикалов, инициируемая при ишемии мозга арахидоновой кислотой, является одной из причин длительного спазма сосудов и срыва церебральной ауторегуляции, а также прогрессирования постишемического отека и набухания за счет дезинтеграции нейронов и повреждения мембранных насосов. В процессе ишемии вследствие энергодефицита снижается активность ферментов антиоксидантной защиты: супероксидисмутазы, каталазы и глутатионпероксидазы. Одновременно уменьшается количество практически всех водо- и жирорастворимых антиоксидантов. Под действием свободных радикалов изменяются свойства ряда ферментов, углеводов и белков, в т.ч. белков ДНК и РНК.
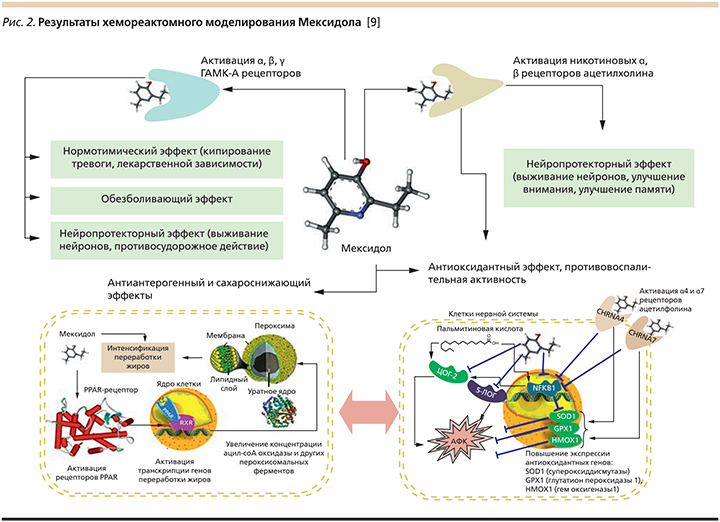
Наиболее распространенным антиоксидантом в неврологической практике является отечественный оригинальный препарат Мексидол, противоишемическое действие которого реализуется за счет его выраженных антиоксидантного, антигипоксантного и мембранотропных свойств. Мексидол был синтезирован в НИИ фармакологии РАМН в середине 1980-х гг.; за разработку и внедрение Мексидола в клиническую практику группе специалистов в 2003 г. была присуждена премия Правительства РФ. Мексидол состоит из двух связанных и функционально значимых соединений: 2-этил-6-метил-3-гидроксипиридина и янтарной кислоты. Наличие 3-гидроксипиридина в структуре Мексидола обеспечивает комплекс его антиоксидантных и мембранотропных эффектов, способность уменьшать глутаматную эксайтотоксичность, модулировать функционирование рецепторов, что принципиально отличает Мексидол от других препаратов, содержащих янтарную кислоту. Наличие сукцината в структуре Мексидола отличает его от эмоксипина и других производных 3-оксипиридина, поскольку сукцинат функционально значим для многих процессов, протекающих в организме, и является субстратом для повышения энергетического обмена в клетке. Сочетание в структуре Мексидола двух соединений с необходимыми свойствами обеспечивают его хорошую проходимость через гематоэнцефалический барьер, высокую биодоступность и воздействие на различные мишени, следствием чего является широкий спектр эффектов препарата и высокий терапевтический потенциал .
В ходе экспериментальных исследований показано влияние препарата Мексидол на развитие феномена эксай-тотоксичности in vitro. Установлено, что данный препарат подавляет развитие глутамат-индуцируемой нейротоксичности, аскорбатзависимого (неферментативного) и НАДФН2-зависимого (ферментативного) железо-индуцируемого перекисного окисления липидов, в высоких концентрациях обладает способностью связывать супероксидный анион-радикал, значительно повышает активность Se-зависимой глутатионпероксидазы . Данные эффекты лежат в основе антиоксидантного и антигипоксантного действия препарата. Результаты хемореактомного анализа молекулы Мексидола (рис. 2), проведенного О.А. Громовой и соавт., показали, что главными мишенями фармакологического действия молекулы Мексидола являются ацетилхолиновые рецепторы, ГАМК-А-рецепторы, ферменты циклооксигеназа-2, 5-липоксигеназа и PPAR-рецептор .
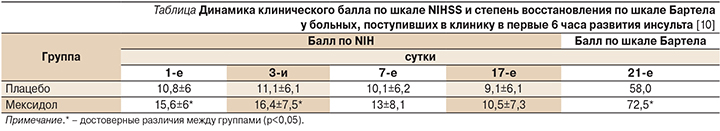
В рандомизированное двойное слепое плацебо-контролируемое исследование эффективности и безопасности Мексидола в комплексной терапии ишемического инсульта (ИИ) в остром периоде были включены больные ИИ в возрасте 45–85 лет, поступившие в первые 24 часа от начала заболевания. Выявлены достоверная опережающая динамика в регрессе неврологических нарушений по шкале NIHSS (National Institutes of Health Stroke Scale) к 14-м суткам заболевания в группе больных, получавших Мексидол, по сравнению с группой плацебо, а также достоверное функциональное восстановление (динамика клинического балла по шкале Бартела) на 21-е сутки у больных, включенных в исследование в первые 6 часов заболевания (см. таблицу). Установлена нормализация функциональной активности мозга при лечении Мексидолом, в т.ч. при проведении острой фармакологической пробы. Комплекс исследований антиоксидантной системы выявил повышение активности ее ферментов (супероксиддисмутазы, глутатионпероксидазы, глутатионредуктазы) при введении Мексидола по сравнению с плацебо. При анализе ферментов дыхательной цепи митохондрий отмечено повышение активности сукцинатдегидрогеназы. Таким образом, получено достоверное клиническое подтверждение эффективности Мексидола в остром периоде инфаркта мозга, особенно при раннем (до 6 часов) его применении, и уточнены в клинических условиях антигипоксические и антиоксидантные механизмы действия препарата .
Максимальный терапевтический эффект Мексидола наблюдается у пациентов с изначально повышенным содержанием продуктов перекисного окисления липидов и истощенной антиоксидантной защитой, что указывает на значение окислительного стресса в патогенезе цереброваскулярных заболеваний . Экспертный анализ лечения ИИ на догоспитальном этапе, проведенного в первые 24 часа заболевания, с транспортировкой до стационара, с дальнейшей комплексной терапией на госпитальном этапе, показал, что в группе пациентов, получивших оптимальное лечение на догоспитальном этапе с включением энергокорригирующей и антиоксидантной терапии Мексидолом, были лучшие показатели по функциональной шкале Бартела при выписке по сравнению с другими группами пациентов .
Согласно последним клиническим рекомендациям, в остром периоде инсульта на догоспитальном этапе Мексидол назначается в дозировке 250–500 мг (5–10 мл) внутривенно капельно или струйно медленно.
В реанимационном и неврологическом отделениях Мексидол применяется в дозе 500 мг (10 мл) внутривенно капельно на 200 мл физиологического раствора в течение 14 дней.
В дальнейшем в раннем реабилитационном периоде продолжается прием Мексидола в таблетированной форме по 250 мг (2 таблетки) 3 раза в сутки не менее 2 месяцев.
Опыт применения Мексидола при тромболитической терапии в дозе 500 мг/сут в течение 21 дня позволил уменьшить размеры ишемического очага, увеличить длительность периода терапевтического окна и уменьшить число соматических осложнений. Комбинация тромболитической терапии и Мексидола может способствовать предупреждению развития завершенного инфаркта и увеличить положительные исходы по показателям неврологической недостаточности и социальной адаптации . В клиническом исследовании Г.И. Ижбульдиной выявлено, что нейропротективная терапия 59 пациентов со среднетяжелым ИИ привела к повышению выживаемости (ни одного летального исхода); а у пациентов группы с тяжелым ИИ отмечено более быстрое уменьшение неврологического дефицита, особенно заметное улучшение речи, ранняя активизация — на 4–5-е сутки от дебюта заболевания.
Результаты опубликованного в 2016 г. исследования убедительно демонстрируют целесообразность применения Мексидола в остром и раннем восстановительном периодах ИИ у больных сахарным диабетом 2 типа (СД2). Показано позитивное влияние Мексидола на показатели липидного обмена и гемангиокорректорное влияние терапии Мексидолом на реологические показатели крови у больных ИИ и СД2. Отмечена бóль-шая терапевтическая эффективность Мексидола при длительной непрерывной терапии в течение 6 месяцев в дозе 750 мг/сут при пероральном приеме .
Согласно результатам рандомизированного двойного слепого мультицентрового плацебо-контролируемого в параллельных группах исследования эффективности и безопасности препарата Мексидол® при длительной последовательной терапии у пациентов с полушарным ИИ в остром и раннем восстановительном периодах (ЭПИКА), включение Мексидола в терапию ИИ способствовало более быстрому восстановлению двигательных функций, и более выраженному достоверному уменьшению симптомов и функциональных нарушений к 9–10-й неделе лечения. Подавляющее большинство пациентов в группе терапии Мексидолом отмечали, что у них не возникает никаких проблем с передвижением, самообслуживанием, выполнением повседневных дел (работа, учеба, домашние дела, семейные обязанности, проведение досуга), а также не чувствовали боли и дискомфорта, тревоги и депрессии. Это положительное воздействие отмечено у пациентов как с сопутствующим СД, так и получавших тромболитическую терапию.
В субпопуляции пациентов с СД в группе терапии Мексидолом достоверно более быстро купировались депрессивные расстройства, улучшалось качество жизни уже с 1-й недели лечения с сохранением преимуществ к окончанию лечения .
Таким образом, исследования механизмов ишемически-гипоксического каскада у больных инсультом свидетельствуют о том, что центральными звеньями патофизиологии ишемии мозга являются энергодефицит и окислительный стресс. В связи с многогранностью эффектов энергодефицита, участием высокоактивных промежуточных метаболитов энергосинтеза в процессах повреждения клеток, тканей и органов необходимо активное вмешательство с лечебной целью на различных стадиях патологического процесса для прерывания ишемически-гипоксического каскада. Применение антиоксидантных препаратов является важным звеном в лечении пациентов с ИИ. Оптимальным является применение антиоксидантов, сочетающих антигипоксантные, мембранотропные и энергокорректорные действия. Антиоксидатная терапия при ИИ должна начинаться как можно раньше (уже на догоспитальном этапе) и продолжаться в восстановительном периоде, что позволяет уменьшать число осложнений, повышать выживаемость, улучшать восстановление неврологических функций и вместе с тем качество жизни пациентов.




