Рилизинг гормоны
Гипоталамус — наиболее «древний» отдел промежуточного мозга, выполняющий в организме человека ряд важных функций, в частности, секретирует (выделяет) гормоны, регулирующие гормональную активность гипофиза.
Смотри также гозерелин лейпрорелин, рифатироин .
НАФАРЕЛИН (Nafarelin)
Синонимы: Синарел.
Фармакологическое действие. Нафарелин — аналог гонадотропин-рилизинг гормона, который оказывает стимулирующее влияние на секрецию (выделение) гонадотропинов гипофиза (гормонов гипофиза, стимулирующих активность половых желез) — лютеинизирующего (вызывающего образование желтого тела яичника) и фолликулостимулирующего (стимулирующего процесс созревания яйцеклеток у женщин и процессы спермогенеза /образования мужских половых клеток — сперматозоидов/ у мужчин) гормонов. Вначале это приводит к усилению стероидогенеза (образования стероидных гормонов) в яичниках, затем (при многократном применении препарата) к его угнетению.
Показания к применению. Эндометриоз (появление в различных органах участков ткани, сходных по строению с внутренней оболочкой матки и подвергающихся циклическим изменениям соответственно менструальному циклу).
Способ применения и дозы. Суточная доза 400 мкг, вводится интраназально (в полость носа) 2 раза по 200 мкг (утром и вечером). Лечение следует начинать между 2-м и 4-м днем менструального цикла и продолжать в течение 6 месяцев. Сопутствующий насморк не ослабляет назальную абсорбцию нафарелина (всасывание препарата слизистой оболочкой полости носа).
Во время применения препарата, а также через 8 месяцев после его отмены необходимо проводить оценку функционального состояния гипофиза.
Побочное действие. Покраснение лица, нарушение либидо (полового влечения), сухость влагалища, головная боль, эмоциональная лабильность, миалгия (боль в мышцах), уменьшение размера молочных желез, раздражение слизистой оболочки носа.
Противопоказания. Повышенная чувствительность к препарату, гонадотропин-рилизинг гормону и его аналогам, маточные кровотечения, беременность, кормление грудью, гормонально зависимые новообразования.
Форма выпуска. Раствор для интраназального применения, содержащий 0,002 г нафарелина ацетата в 1 мл в бутылочках с пульверизатором по 10 мл, рассчитанных на 30 дней лечения. Одно нажатие на пульверизатор обеспечивает введение 200 мкг препарата.
Условия хранения. Список Б. В прохладном месте.
ОКТРЕОТИД (Octreotide)
Синонимы: Сандостатин.
Фармакологическое действие. Октреотид представляет собой синтетический октапёптид, являющийся производным естественного гормона соматостатина и обладает сходными с ним фармакологическими эффектами, но значительно большей продолжительностью действия. Препарат подавляет патологически повышенную секрецию (процесс выработки и выделения) гормона роста, а также пептидов и серотонина, продуцируемых в гастроэнтеропанкреатической эндокринной системе (системе, включающей желудок, тонкий кишечник и поджелудочную железу).
У здоровых лиц октреотид подавляет секрецию гормона роста, вызываемую аргинином, стрессом и инсулиновой гипогликемией (пониженным содержанием сахара в крови, вызванным инсулином); секрецию инсулина, глюкагона, гастрина и других пептидов гастроэнтеропанкреатической эндокринной системы, вызываемую приемом пищи, а также секрецию инсулина и глюкагона, стимулируемую аргинином; секрецию тиреотропина (гормона гипофиза, регулирующего функцию щитовидной железы), вызываемую тиреолиберином.
У больных акромегалией (эндокринным заболеванием, сопровождающимся увеличением объема кистей, носа, нижней челюсти и т.д.) октреотид снижает концентрацию гормона роста и/или соматомедина А (биологически активного соединения, вырабатываемого в основном клетками печени, стимулирующего рост тканей и проявляющего инсулиноподобную активность) в плазме крови. Клинически значимое снижение концентрации гормона роста (на 50% и более) отмечается почти у всех больных, нормализация же уровня гормона роста в плазме (менее 5 нг/мл) достигается примерно у половины больных. У большинства больных акромегалией октреотид заметно снижает выраженность таких симптомов, как головная боль, отечность кожи и мягких тканей, гипергидроз (заболевание потовых желез с образованием мелких зудящих пузырьков), боль в суставах и парезы (уменьшение силы и/или амплитуды движений). У больных с большими аденомами (доброкачественными опухолями) гипофиза лечение октреотидом может привести к некоторому уменьшению размеров опухоли.
При карциноидных (раковых) опухолях применение октреотида может приводить к уменьшению выраженности таких симптомов, как ощущения приливов крови и диарея (понос), что во многих случаях сопровождается уменьшением концентрации серотонина в плазме и снижением выделения 5-гидроксииндолуксусной кислоты с мочой.
При опухолях, характеризующихся гиперпродукцией (усиленным образованием) вазоактивного интестинального пептида, применение октреотида приводит у большинства больных к уменьшению тяжелой секреторной диареи (поноса). Одновременно происходит уменьшение
сопутствующих нарушений электролитного (ионного) баланса, например, гипокалиемии (пониженного уровня калия в крови). У некоторых больных происходит замедление или остановка прогрессирования опухоли и даже уменьшение ее размеров. Клиническое улучшение обычно сопровождается уменьшением (вплоть до нормальных значений) концентрации вазоактивного интестинального пептида в плазме крови.
При глюкагономах (злокачественной опухоли /раке/ поджелудочной железы, продуцирующей инсулин) применение октреотида в большинстве случаев приводит к заметному уменьшению некротизирующей (приводящей к омертвению ткани) мигрирующей сыпи; уменьшается масса тела (действие на сахарный диабет, однако, незначительно). При гастрономах (злокачественной опухоли /раке/ желудка), синдроме Золлингера-Эллисона (комплексе симптомов при сочетании язвы желудка и двенадцатиперстной кишки с доброкачественной опухолью поджелудочной железы) октреотид уменьшает гиперсекрецию (повышенное выделение) соляной кислоты в желудке и связанные с этим симптомы, включая диарею, ощущение приливов крови. У некоторых больных отмечается уменьшение концентрации гастрина (белка, выделяемого слизистой оболочкой желудка, вызывающего усиление выделения пищеварительных соков желудком и поджелудочной железой) в плазме крови.
У больных с инсулиномами (опухолями поджелудочной железы, вырабатывающими инсулин) октреотид нормализует гликемию (снижает повышенное содержание сахара в крови), уменьшая уровень инсулина в крови (этот эффект, однако, может быть кратковременным — около 2 ч). Контроль гликемии может улучшаться и без одновременного продолжительного снижения уровня инсулина в крови.
У больных с опухолями, гиперпродуцирующими рилизинг-фактор гормона роста (выделяющими повышенное количество гипоталамических нейрогормонов, способствующих выделению гипофизом гормона роста), октреотид уменьшает выраженность симптомов акромегалии. В дальнейшем может уменьшиться гипертрофия (увеличение объема) гипофиза.
У больных с синдромом приобретенного иммунодефицита (СПИД), страдающих выраженной диареей (поносом), рефрактерной (устойчивой) к противоинфекционной или иной терапии, применение октреотида приводит к полной или частичной нормализации стула примерно в одной трети случаев.
У больных, которым проводятся операции на поджелудочной железе, применение препарата во время операции и после нее снижает частоту типичных послеоперационных осложнений (например, панкреатических свищей /образующихся в результате заболевания каналов, соединяющих поджелудочную железу с внутренними органами или внешней средой/, абсцессов /гнойников/, сепсиса /заражения крови микробами из очага гнойного воспаления/, послеоперационного острого панкреатита /воспаления поджелудочной железы/).
Показания к применению. Акромегалия (при отсутствии достаточного эффекта от хирургического лечения, лучевой терапии и лечения агонистами дофамина; у неоперабельных больных, а также больных, отказавшихся от хирургического лечения); опухоли гастроэнтеропанкреатической эндокринной системы (карциноидные опухоли /общее название опухолей, возникающих из клеток слизистой оболочки желудка/) с наличием карциноидного синдрома (сочетания «хронического энтерита /воспаления тонкой кишки/, воспаления клапанов сердца, телеангиэктазий /местного чрезмерного расширения мелких сосудов/ и пигментации кожи); опухоли, характеризующиеся гиперпродукцией вазоактивного интестинального пептида; глюкагономы; гастриномы /синдром Золлингера-Эллисона; инсулиномы/); опухоли, характеризующиеся гиперпродукцией соматолиберина; рефрактерная диарея у больных СПИДом; профилактика осложнений после операций на поджелудочной железе.
Способ применения и дозы. При акромегалии первоначально препарат вводят по 0,05-0,1 мг подкожно с интервалами 8 или 12 ч. В дальнейшем подбор дозы должен быть основан на ежемесячных определениях концентрации гормона роста в крови, анализе клинических симптомов и переносимости препарата. У большинства больных оптимальная суточная доза составляет 0,2-0,3 мг. Максимальная доза составляет 1,5 мг в день. Если после трех месяцев лечения октреотидом не отмечается достаточного снижения уровня гормона роста и улучшения клинической картины заболевания, терапию следует прекратить.
При эндокринных опухолях гастроэнтеропанкреатической системы препарат вводят подкожно в начальной дозе по 0,05 мг 1-2 раза в сутки. В дальнейшем в зависимости от достигнутого клинического эффекта, влияния на уровни гормонов, продуцируемых опухолью (в случае карциноидных опухолей -влияния на выделение 5-гидроксииндолуксусной кислоты с мочой) и переносимости, дозу препарата можно постепенно увеличить до 0,1 -0,2 мг 3 раза в день. В исключительных случаях могут потребоваться более высокие дозы. Поддерживающие дозы препарата следует подбирать индивидуально.
При рефрактерной диарее у больных СПИДом препарат вводят подкожно в начальной дозе (0,1 мг) 3 раза в сутки. Если после одной недели лечения диарея не стихает, дозу препарата следует увеличить индивидуально, вплоть до 0,25 мг 3 раза в сутки. Подбор дозы препарата следует вести на основании контроля за объемом стула и переносимостью препарата. Если в течение недели лечения октреотидом в дозе 0,25 мг 3 раза в день улучшения не наступает, терапию прекратить.
Для профилактики осложнений после операций на поджелудочной железе первую дозу 0,1 мг вводят подкожно за 1 ч до лапаротомии (вскрытия брюшной полости); затем после операции вводят подкожно по 0,1 мг 3 раза в сутки на протяжении семи последовательных дней.
У больных пожилого возраста нет необходимости снижать дозу октреотида.
В месте инъекции возможны боль, ощущение зуда или жжения, краснота и припухлость (обычно проходят в течение 15 мин). Для уменьшения явлений дискомфорта в месте инъекции рекомендуется доводить раствор препарата перед введением до комнатной температуры и вводить меньший объем препарата. Следует избегать нескольких инъекций в одно и то же место через короткие промежутки времени. Для предотвращения бактериального загрязнения рекомендуется прокалывать пробку многоразового флакона не более 10 раз.
Побочное действие. Анорексия (отсутствие аппетита), тошнота, рвота, спастические боли (связанные с резким сокращением гладких мыши внутренних органов) в животе, ощущение вздутия живота, избыточное газообразование, жидкий стул, диарея (понос) и стеаторея (высокое содержание жиров в каловых массах). Хотя выделение жира с калом может возрастать, нет указаний на то, что длительное лечение октреотидом может приводить к развитию нарушений всасывания (мальабсорбции). В редких случаях могут отмечаться явления, напоминающие острую кишечную непроходимость.
Побочные эффекты со стороны желудочно-кишечного тракта могут быть уменьшены, если инъекции октреотидом делать в промежутках между приемами пищи или перед сном.
При опухолях гипофиза необходимо тщательное наблюдение за больными, получающими препарат, так как возможно увеличение размеров опухолей с развитием таких серьезных осложнений, как Нарушения зрения. В этих случаях следует рассмотреть необходимость других методов лечения.
При лечении гастроэнтеропанкреатических эндокринных опухолей октреотидом в редких случаях может наступить внезапный рецидив (повтор) симптомов.
Известны отдельные случаи развития острого гепатита (воспаления ткани печени) без холестаза (застоя желчи), а также гипербилирубинемии (повышенного содержания билирубина /пигмента желчи/ в крови) в сочетании с увеличением активности ферментов: щелочной фосфатазы, гаммаглютамилтрансферазы и, в меньшей степени, трансаминаз.
Длительное использование препарата может приводить к образованию камней в желчном пузыре. У 10-20% больных, получающих .октреотид в течение длительного времени, возможно появление камней в желчном пузыре. Поэтому перед началом лечения, а также в процессе лечения октреотидом (через каждые 6-12 мес.) рекомендуется проведение ультразвукового исследования желчного пузыря. Если камни в желчном пузыре выявлены перед началом лечения, вопрос о применении октреотида решается индивидуально. В настоящее время нет указаний на то, что октреотид может отрицательно влиять на динамику развития уже имеющихся желчных камней или прогноз желчнокаменной болезни. Если камни в желчном пузыре появляются в процессе лечения препаратом, вопрос о продолжении лечения решается индивидуально. В случае, если симптомы желчнокаменной болезни отсутствуют и специального лечения не требуется, показано более частое наблюдение за больным. Если же имеются клинические проявления желчнокаменной болезни, следует проводить общепринятое лечение этого заболевания, включая терапию препаратами желчных кислот.
Возможно нарушение толерантности (переносимости) к глюкозе после приема пищи (обусловлено подавлением препаратом секреции инсулина); в редких случаях при длительном лечении возможно развитие персистирующей гипергликемии (стойкого повышения содержания сахара в крови).
У больных с инсулиномами (опухолями поджелудочной железы, вырабатывающими инсулин) на фоне лечения октреотидом может отмечаться увеличение выраженности и продолжительности гликемии (это связано с относительно меньшим влиянием препарата на подавление секреции инсулина по сравнению с влиянием на секрецию гормона роста и глюкагона /гормона поджелудочной железы, стимулирующего образование инсулина/). Таких больных следует внимательно осматривать в начале лечения октреотидом, а также при каждом изменении дозы препарата. Существенные колебания концентрации глюкозы в крови можно попытаться снизить путем более частого введения препарата.
У больных с сахарным диабетом, получающих инсулин, октреотид может снижать потребность в инсулине.
Противопоказания. Повышенная чувствительность к препарату. Беременность, кормление грудью.
Форма выпуска. Раствор для инъекций в ампулах по 1 мл (0,05, 0,1 или 0,5 мг октреотида) в упаковках по 10 штук; раствор для инъекций во флаконах по 5 мл (1 г октреотида).
Условия хранения. При температуре +2-+5 С. В процессе использования ампулы и флаконы можно держать при комнатной температуре до 2 недель.
СЕРМОРЕЛИН (Sermorelin)
Синонимы: Гереф.
Фармакологическое действие. Синтетический пептид (белок), соответствующий по структуре N-концевому фрагменту эндогенного (образующегося в организме) рилизинг-фактора гормона роста человека (гипоталамических нейрогормонов, способствующих выделению гипофизом гормона роста). По действию серморелин аналогичен рилизинг-фактору гормона роста, то есть,
взаимодействуя со специфическими мембранными рецепторами, стимулирует синтез и секрецию (выделение) гормона роста гипофизом (железой внутренней секреции, расположенной в мозге).
После внутривенного введения препарата в дозе 1,0 мкг/кг концентрация гормона роста в сыворотке крови возрастает до максимальной величины через 10-60 мин и уменьшается до первоначального уровня в течение 2-3 ч.
Показания к применению. Оценка функциональной способности и реактивности соматотропинов передней доли гипофиза (метод диагностики при подозрении на недостаточность гормона роста у низкорослых детей).
Способ применения и дозы. Дозы препарата устанавливаются индивидуально в зависимости от массы тела исследуемых лиц.
Препарат разводят непосредственно перед применением не менее, чем в 0,5 мл прилагаемого растворителя.
Препарат в дозе 1,0 мкг/кг вводят внутривенно быстро (в течение 30 сек) в утренние часы, натощак. Пробы венозной крови берут за 15 мин до введения препарата, непосредственно перед его введением и спустя 15, 30, 45, 60 и 90 мин после инъекции.
В случае, если уровень гормона роста в крови после введения препарата составляет 7 нг/мл или менее, у низкорослых пациентов причиной нарушения роста можно считать недостаточность гормона роста. В случае, если уровень гормона роста в крови после введения препарата составляет более 7 нг/мл, указанная выше причина нарушения роста маловероятна, следует применить провоцирующие тесты для исключения гипоталамической дисфункции (нарушения функции гипоталамуса — железы внутренней секреции).
Перед проведением теста с серморелином отменяют лекарственные средства, которые оказывают непосредственное воздействие на гипофизарную секрецию соматостатина: ингибиторы циклооксигеназы (нестероидные противовоспалительные средства, например, ацетилсалициловую кислоту или индометацин), средства, имеющие в своем составе соматостатин или индуцирующие высвобождение соматостатина, инсулина или глюкортикостероидов (гормонов коры надпочечников, влияющих на углеводный и белковый обмен).
Концентрации гормона роста могут возрастать под воздействием клофелина и левопы, а также при индуцированной инсулином гипогликемии (вызванном инсулином снижении уровня сахара в крови). Холинергические препараты, в целом, усиливают эффект серморелина, а антихолинергические средства -уменьшают этот эффект.
На результатах тестирования могут сказываться: одновременная терапия гормоном роста (в этом случает тест с серморелином проводят через 1-2 недели после отмены терапии); наличие нелеченного гипотиреоза (заболевания щитовидной железы) или одновременно проводимая терапия антитиреоидными препаратами; высокая концентрация соматостатина во время введения препарата; ожирение, гипергликемия (повышенный уровень сахара в крови) и повышенная концентрация жирных кислот в плазме крови (реакция гормона роста на введение серморелина при этом снижается).
Побочное действие. Ощущение жара и чувство прилива крови к лицу, боль в месте инъекции.
Противопоказания. Повышенная чувствительность к препарату, беременность, период кормления грудью.
Форма выпуска. Сухое вещество для инъекций по 50 мкг в ампуле в упаковке по 1 штуке, в комплекте с 1 ампулой растворителя (1 мл 0,9% раствора натрия хлорида).
Условия хранения. Список Б. В холодильнике при температуре +2-+S °С.
СОМАТОСТАТИН (Somatostatin)
Синонимы: Стиламин.
Фармакологическое действие. Синтетический 14-ами-нокислотный пептид, по структуре и действию сходный с естественным соматостатином.
Соматостатин препятствует выделению гастрина (белка, выделяемого слизистой оболочкой желудка, вызывающего усиление выделения пищеварительных соков желудком и поджелудочной железой), желудочного сока, пепсина (фермента, разрушающего белки) и уменьшает как эндокринную, так и экзокринную секрецию поджелудочной железы (выделение поджелудочной железой гормонов и пищеварительных соков), в том числе, подавляет секрецию глюкагона (гормона поджелудочной железы, стимулирующего выделение инсулина), что объясняет положительный эффект препарата при диабетическом кетоацидозе (закислении из-за избыточного содержания в крови кетоновых тел). Препятствует также выделению гормона роста. Помимо этого, соматостатин значительно уменьшает объем кровотока во внутренних органах, не вызывая значительных колебаний системного артериального давления.
Показания к применению. Выраженные острые кровотечения при язвенной болезни желудка или двенадцатиперстной кишки; острые кровотечения из варикозно расширенных вен пищевода (измененных вен, характеризующихся узловатым выпячиванием); выраженные острые кровотечения при эрозивных » язвенных гастритах (хроническом воспалении желудка с образованием дефектов слизистой оболочки и кровотечением); вспомогательное лечение свищей (образующихся в результате заболевания каналов, соединяющих полые органы между собой или с внешней средой) поджелудочной железы, желчных и кишечных свищей; профилактика осложнений, возникающих после хирургических вмешательств на поджелудочной железе; вспомогательное лечение при диабетическом кетоацидозе; диагностические и научно-исследовательские тесты, требующие подавления секреции гормона роста, инсулина, глюкагона.
Способ применения и дозы. Соматостатин вводят внутривенно — сначала медленно струйно в течение 3-5 мин в «ударной» дозе 250 мкг, затем переходят на непрерывную инфузию со скоростью 250 мкг/ч (что соответствует приблизительно введению 3,5 мкг/кг/ч). Активное вещество непосредственно перед введением разводят прилагаемым растворителем. Для приготовления раствора, предназначаемого для’инфузии в течение 12 ч, используют ампулу, содержащую 3000 мкг активного вещества. Для его разведения используют изотонический раствор натрия хлорида или 5% раствор глюкозы. Рекомендуется использование перфузионного шприцевого насоса. Раствор соматостатина в изотоническом растворе хлорида калия сохраняет стабильность в течение 72 ч. Приготовленный раствор препарата хранят в холодильнике.
Для лечения выраженных острых кровотечений из верхних отделов желудочно-кишечного тракта, в том числе из варикозно расширенных вен пищевода, применяют препарат как указано выше. При перерыве между двумя инфузиями препарата, превышающем 3-5 мин (смена системы для внутривенного введения или перфузионного шприца), производят дополнительную медленную внутривенную инфузию соматостатина в дозе 250 мкг для обеспечения непрерывности лечения. После остановки кровотечения (обычно это происходит менее, чем через 12-24 ч) продолжают лечение препаратом еше в течение 48-72 ч во избежание рецидива (повтора) кровотечения. Обычно общая продолжительность лечения составляет до 120ч.
При вспомогательном лечении свищей поджелудочной железы, желчных или кишечных свишей, осуществляют непрерывное введение соматостатина одновременно с полным парентеральным (минуя желудочно-кишечный тракт) питанием. При этом доза препарата составляет 250 мкг/ч. При закрытии свиша лечение препаратом продолжают еше в течение 1-3 дней и прекращают постепенно во избежание эффекта «отмены» (ухудшения самочувствия после резкого прекращения приема соматостатина).
Для профилактики осложнений после хирургических вмешательств на поджелудочной железе соматостатин вводят в начале хирургического вмешательства со скоростью 250 мкг/ч и продолжают введение в течение 5 дней.
При вспомогательном лечении диабетического кетоацидоза глрел&рат вводит ‘to скорость» 100-500 мкг/ч вместе с’инсулином (инъекция «ударной» дозы в 10 ЕД и одновременная инъекция со скоростью 1-4,9 ЕД/ч). Нормализация гликемии (снижение повышенного содержания сахара в крови) происходит в течение 4 ч, а исчезновение ацидоза (закисления) — в течение 3 ч.
Побочное действие. Головокружения и ощущение приливов крови к лицу (очень редко); тошнота и рвота (только при скорости введения свыше 50 мкг/мин).
В начале лечения возможно временное снижение уровня сахара в крови (вследствие ингибирующего /подавляющего/ действия препарата на секрецию /выделение/ инсулина и глюкагона). Поэтому у больных сахарным диабетом в этот период определяют содержание глюкозы в крови каждые 3-4 ч. Одновременно, по возможности, исключают прием углеводов. В случае необходимости вводят инсулин.
Противопоказания. Беременность; период, следующий непосредственно за родами; кормление грудью; повышенная чувствительность к соматостатину.
Следует избегать повторных курсов лечения препаратом в целях снижения до минимума возможности возникновения сенсибилизации (повышенной чувствительности к препарату).
Форма выпуска. Сухое вещество для инъекций в ампулах по 250 и 3000 мкг в комплекте с растворителем — 0,09% раствором натрия хлорида в ампулах по 2 мл.
Условия хранения. При температуре, не превышающей +25 ‘С.
| Версия для печати | Данная информация не является руководством к самостоятельному лечению. Необходима консультация врача. |
РИЛИ́ЗИНГ-ГОРМО́НЫ, рилизинг-факторы (от англ. release – освобождать, выпускать), пептидные нейрогормоны многих позвоночных животных и человека. Синтезируются гл. обр. в гипоталамусе. Секретируются в ответ на нервные или химич. стимулы. С током крови переносятся в переднюю долю гипофиза (аденогипофиз), где стимулируют (либерины) или угнетают (статины) образование или выделение т. н. тропных гормонов. Напр., кортиколиберин и тиролиберин способствуют соответственно выработке кортикотропина и тиреотропина, а пролактостатин и соматостатин препятствуют образованию пролактина и соматотропина. Благодаря Р.-г. обеспечивается взаимодействие высших отделов ЦНС с эндокринной системой. Некоторые Р.-г. синтезируются и секретируются в клетках др. органов. Так, соматостатин обнаруживается в желудке и поджелудочной железе и участвует в локальных механизмах регуляции функции этих органов.
Гипофизарный гормон, регулятор менструального цикла и образования половых гормонов у женщин, стимулятор синтеза тестостерона у мужчин.
Гликопротеидный гонадотропный гормон, вырабатывающийся в передней доле гипофиза под влиянием гонадотропин-рилизинг-гормона(люлиберина) гипоталамуса и половых стероидов (отрицательная обратная связь). До половой зрелости уровень ЛГ в крови низок. Во время пубертатного периода начинается циклическая секреция гонадотропинов, стимулирующая развитие половых желез и секрецию половых гормонов. Секреция лютеинизирующего гормона в течение суток имеет импульсный характер.
У женщин лютеинизирующий гормон стимулирует синтез эстрогенов, регулирует секрецию прогестерона и формирование желтого тела. Концентрация лютеинизирующего гормона изменяется в течение менструального цикла с предовуляторным пиком концентрации в середине его (концентрация ЛГ значительно превышает уровень ФСГ). Массированный выброс лютеинизирующего гормона в этот период вызывает овуляцию, образование желтого тела и перевод биосинтеза стероидов на продукцию прогестерона. В течение фолликулярной и лютеиновой фазы эстрогены оказывают отрицательное обратное влияние на выработку лютеинизирующего гормона (за исключением короткого периода перед пиком ЛГ в середине цикла, когда эстрадиол проявляет положительное обратное действие на секрецию ЛГ).
Во время беременности концентрация лютеинизирующего гормона снижается в результате роста концентрации эстрогенов. После менопаузы снижение тормозящего обратного влияния стероидов яичников вызывает повышение уровня ЛГ. В мужском организме ЛГ, действуя на яички, стимулирует в клетках Лейдига продукцию тестостерона. Обратное отрицательное влияние тестостерона блокирует синтез и высвобождение в гипоталамусе люлиберина, а в гипофизе — ЛГ. Уровень ЛГ увеличивается у мужчин к 60–65 годам.
При гонадальной причине бесплодия наблюдается увеличение концентраций ЛГ и ФСГ, сочетающееся с низкой концентрацией половых стероидов. Низкие концентрации гонадотропинов и половых стероидов наблюдаются в случае гипофункции гипофиза. В некоторых диагностических ситуациях важно соотношение ЛГ/ФСГ, которое в норме у женщин до менархе равно 1, после года менархе — от 1 до 1,5, в периоде от двух лет после наступления менархе и до менопаузы — от 1,5 до 2.
Важнейшая роль в регуляции гормональных функций гипофиза и периферических эндокринных желез принадлежит гипоталамусу.
Это своеобразный нейроэндокринный орган, обеспечивающий единство нервных и эндокринных процессов в организме. Гипоталамус имеет нервные связи с лимбической системой, ретикулярной формацией, корой головного мозга, гипофизом. Через гипофиз он связан с другими эндокринными железами. Нервные клетки гипоталамуса образуют нейрогормоны, или рилизинг-гормоны (рилизинг-факторы).
Рилизинг-гормоны гипоталамуса, регулирующие тропные функции аденогипофиза, по своей химической природе относятся к полипептидам. Местом их выработки являются соответствующие ядра гипоталамуса. К рилизинг-гормонам гипоталамуса относятся соматолиберин и соматостатин, пролактолиберин и пролактостатин, люлиберин, фоллиберин, кортиколиберин, тиролиберин, меланолиберин, меланостатин и др. Перечисленные рилизинг-гормоны имеют высокую биологическую активность и лишены видовой специфичности. Многие из них (ТРГ, Гн-РГ, ГР-РГ) синтезированы химическим путем. Механизм, посредством которого рилизинг-гормоны гипоталамуса стимулируют или тормозят инкрецию гормонов аденогипофиза, связан с изменением проницаемости клеточных мембран, однако пока еще достаточно не изучен. Полагают, что они ускоряют освобождение гормонов гипофиза и участвуют в их биосинтезе.
В связи с высокой устойчивостью к действию протеолитических ферментов, высокой активностью и отсутствием видовой специфичности рилизинг-гормоны, очевидно, получат широкое применение в животноводстве и ветеринарии.
Соматолиберин, или рилизинг-гормон, стимулирующий гормон роста (ГР-РГ), и соматостатин, или рилизинг-гормон, ингибирующий гормон роста (ГР-ИГ), вырабатываются в основном в области срединного возвышения и медиобазальной части гипоталамуса. Синтезированы аналоги ГР-РГ и ГР-ИГ. Действие рилизинг-гормонов на соматотропные клетки гипофиза осуществляется с участием цАМФ и цГМФ. Изменение соотношения цАМФ и цГМФ в клетках гипофиза обеспечивает регуляцию инкреции гормона роста.
Пролактолиберин, или пролактинстимулирующий гормон (ПСГ), и пролактостатин, или пролактинингибирующий гормон (ПИГ), вырабатываются в медиальной преоптической и некоторых других областях гипоталамуса. Эти рилизинг-гормоны соответственно стимулируют и тормозят иикрецию пролактина аденогипофизом. Физиологическими стимуляторами инкреции пролактина являются акт сосания и изменение концентрации эстрогенов в крови. Основным стимулятором инкреции ПИГ является дофамин.
Гонадолиберин, или гонадотропин-рилизинг-гормон (Гн-РГ), содержит в себе люлиберин и фоллиберин. Он образуется, в основном, медиобазальной частью гипоталамуса. В 1971 г. осуществлен синтез Гн-РГ. Этот гормон регулирует инкрецию лютеинизирующего гормона (ЛГ) и фолликулостимулирующего гормона (ФСГ) в гипофизе. Полагают, что выделение ЛГ или ФСГ обусловлено влиянием половых стероидов на гипоталамус и гипофиз. Повышение уровня эстрогенов в крови повышает чувствительность гипофиза к Гн-РГ и сопровождается освобождением ЛГ. Стимуляция выделения ЛГ осуществляется эстрогенами в меньших концентрациях и проявляется раньше, чем стимуляция выделения ФСГ.
В настоящее время существуют две гипотезы, объясняющие механизм действия Гн-РГ. Согласно первой Гн-РГ изменяет проницаемость клеточных мембран гонадотропов, вызывает их деполяризацию и повышает концентрацию ионов кальция, которые активируют выход гонадотропинов. Вторая гипотеза придает главное значение Гн-РГ в активации аденилциклазной системы и увеличении концентрации цАМФ в цитозоле клеток аденогипофиза. Допускается возможность объединения этих гипотез.
Кортиколиберин, или кортикотропин-рилизинг-гормон (КРГ),— гормон, стимулирующий инкрецию адренокортикотропного гормона (АКТГ) гипофизом. Основным местом синтеза КРГ является медиобазальная область гипоталамуса. КРГ выделяется из гипоталамуса с определенной цикличностью путем периодических выбросов. Механизм действия КРГ на клетки гипофиза, инкретирующие АКТГ, изучен недостаточно.
Тиролиберин, или тиротропин-рилизинг-гормон (ТРГ), — выделен из гипоталамуса овец, свиней. Для выделения одного миллиграмма чистого ТРГ потребовалось 300 000 гипоталамусов овец. ТРГ имеет одинаковую структуру у всех животных. Местом образования ТРГ является преоптическая область гипоталамуса.
ТРГ и тиреоидные гормоны, поступающие в кровь, регулируют тиротропную функцию гипофиза. ТРГ действует на рецепторы мембран тиротропных клеток при определенной концентрации Са++ и Na+ в экстрацеллюлярной жидкости.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Гипоталамус служит местом непосредственного взаимодействия высших отделов ЦНС и эндокринной системы. Природа связей, существующих между ЦНС и эндокринной системой, стала проясняться в последние десятилетия, когда из гипоталамуса были выделены первые гуморальные факторы, оказавшиеся гормональными веществами с чрезвычайно высокой биологической активностью. Потребовалось немало труда и экспериментального мастерства, чтобы доказать, что эти вещества образуются в нервных клетках гипоталамуса, откуда по системе портальных капилляров достигают гипофиза и регулируют секрецию гипофизарных гормонов, точнее их освобождение (возможно, и биосинтез). Эти вещества получили сначала наименование нейрогормонов, а затем рилизинг-факторов (от англ. release – освобождать), или либеринов. Вещества с противоположным действием, т.е. угнетающие освобождение (и, возможно, биосинтез) гипофизар-ных гормонов, стали называть ингибирующими факторами, или статинами. Таким образом, гормонам гипоталамуса принадлежит ключевая роль в физиологической системе гормональной регуляции многосторонних биологических функций отдельных органов, тканей и целостного организма.
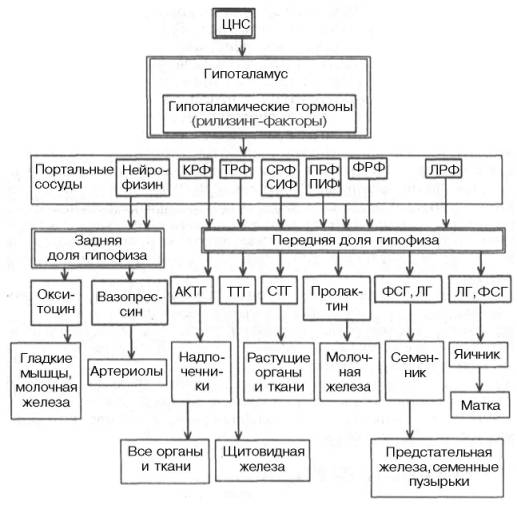
К настоящему времени в гипоталамусе открыто 7 стимуляторов (либерины) и 3 ингибитора (статины) секреции гормонов гипофиза, а именно: кортиколиберин, тиролиберин, люлиберин, фоллилиберин, соматолиберин, пролактолиберин, меланолиберин, соматостатин, пролактостатин и меланостатин (табл. 8.1). В чистом виде выделено 5 гормонов, для которых установлена первичная структура, подтвержденная химическим синтезом.
Большие трудности при получении гормонов гипоталамуса в чистом виде объясняются чрезвычайно низким содержанием их в исходной ткани. Так, для выделения всего 1 мг тиролиберина потребовалось переработать 7 т гипоталамусов, полученных от 5 млн овец.
Следует отметить, что не все гормоны гипоталамуса, по-видимому, строго специфичны в отношении одного какого-либо гипофизарного гормона. В частности, для тиролиберина показана способность освобождать, помимо тиротропина, также пролактин, а для люлиберина, помимо лютеи-низирующего гормона,– также фолликулостимулирующий гормон.
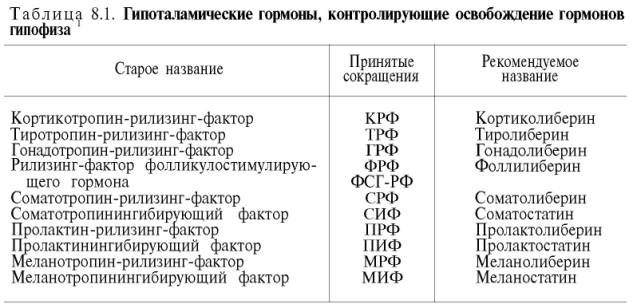
1 Гипоталамические гормоны не имеют твердо установленных наименований. Рекомендуется в первой части названия гормона гипофиза добавлять окончание «либерин»; например, «тиролиберин» означает гормон гипоталамуса, стимулирующий освобождение (и, возможно, синтез) тиротропина — соответствующего гормона гипофиза. Аналогичным образом образуют названия факторов гипоталамуса, ингибирующих освобождение (и, возможно, синтез) троп-ных гормонов гипофиза,- добавляют окончание «статин». Например, «соматостатин» означает гипоталамический пептид, ингибирующий освобождение (или синтез) гормона роста гипофиза — соматотропина.
Установлено, что по химическому строению все гормоны гипоталамуса являются низкомолекулярными пептидами, так называемыми олигопепти-дами необычного строения, хотя точный аминокислотный состав и первичная структура выяснены не для всех. Приводим полученные к настоящему времени данные о химической природе шести из известных 10 гормонов гипоталамуса.
1. Тиролиберин (Пиро-Глу–Гис–Про–NH2):
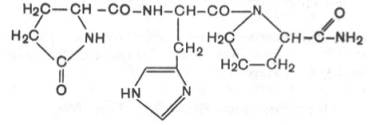
Тиролиберин представлен трипептидом, состоящим из пироглутаминовой (циклической) кислоты, гистидина и пролинамида, соединенных пептидными связями. В отличие от классических пептидов он не содержит свободных NH2- и СООН-групп у N- и С-концевых аминокислот.
2. Гонадолиберин является декапептидом, состоящим из 10 аминокислот в последовательности:
Пиро-Глу–Гис–Трп–Сер–Тир–Гли–Лей–Арг–Про–Гли-NН2
Концевая С-аминокислота представлена глицинамидом.
3. Соматостатин является циклическим тетрадекапептидом (состоит из 14 аминокислотных остатков) :

Отличается этот гормон от двух предыдущих, помимо циклической структуры, тем, что не содержит на N-конце пироглутаминовой кислоты: дисульфидная связь образуется между двумя остатками цистеина в 3-м и 14-м положениях. Следует отметить, что синтетический линейный аналог соматостатина также наделен аналогичной биологической активностью, что свидетельствует о несущественности дисульфидного мостика природного гормона. Помимо гипоталамуса, соматостатин продуцируется нейронами центральной и периферической нервных систем, а также синтезируется в S-клетках панкреатических островков (островков Лангерганса) в поджелудочной железе и клетках кишечника. Он оказывает широкий спектр биологического действия; в частности, показано ингибирующее действие на синтез гормона роста в аденогипофизе, а также прямое тормозящее действие его на биосинтез инсулина и глюкагона в β- и α-клетках островков Лангерганса.
4. Соматолиберин недавно выделен из природных источников. Он представлен 44 аминокислотными остатками с полностью раскрытой последовательностью. Биологической активностью соматолиберина наделен, кроме того, химически синтезированный декапептид:
Н-Вал–Гис–Лей–Сер–Ала–Глу–Глн–Лиз–Глу–Ала-ОН.
Этот декапептид стимулирует синтез и секрецию гормона роста гипофиза соматотропина.
5. Меланолиберин, химическая структура которого аналогична структуре открытого кольца гормона окситоцина (без трипептидной боковой цепи), имеет следующее строение:
Н-Цис–Тир–Иле–Глн–Асн–Цис-ОН.
6. Меланостатин (меланотропинингибирующий фактор) представлен или трипептидом: Пиро-Глу–Лей–Гли-NН2, или пентапептидом со следующей последовательностью:
Пиро-Глу–Гис–Фен–Aрг–Гли–NН2.
Необходимо отметить, что меланолиберин оказывает стимулирующее действие, а меланостатин, напротив, ингибирующее действие на синтез и секрецию меланотропина в передней доле гипофиза.
Помимо перечисленных гипоталамических гормонов, интенсивно изучалась химическая природа другого гормона – кортиколиберина . Активные препараты его были выделены как из ткани гипоталамуса, так и из задней доли гипофиза; существует мнение, что последняя может служить депо гормона для вазопрессина и окситоцина. Недавно выделен состоящий из 41 аминокислоты с выясненной последовательностью кортиколиберин из гипоталамуса овцы.
Местом синтеза гипоталамических гормонов, вероятнее всего, являются нервные окончания – синаптосомы гипоталамуса, поскольку именно там отмечена наибольшая концентрация гормонов и биогенных аминов. Последние рассматриваются наряду с гормонами периферических желез внутренней секреции, действующих по принципу обратной связи, в качестве основных регуляторов секреции и синтеза гормонов гипоталамуса. Механизм биосинтеза тиролиберина, осуществляющегося, скорее всего, нерибо-собальным путем, включает участие SH-содержащей синтетазы или комплекса ферментов, катализирующих циклизацию глутаминовой кислоты в пироглутаминовую, образование пептидной связи и амидирование проли-на в присутствии глутамина. Существование подобного механизма биосинтеза с участием соответствующих синтетаз допускается также в отношении гонадолиберина и соматолиберина.
Пути инактивации гормонов гипоталамуса изучены недостаточно. Период полураспада тиролиберина в крови крысы составляет 4 мин. Инактивация наступает как при разрыве пептидной связи (под действием экзо-и эндопептидаз сыворотки крови крысы и человека), так и при отщеплении амидной группы в молекуле пролинамида. В гипоталамусе человека и ряда животных открыт специфический фермент пироглутамилпептидаза, которая катализирует отщепление от тиролиберина или гонадолиберина молекулы пироглутаминовой кислоты.
Гипоталамические гормоны непосредственно влияют на секрецию (точнее, освобождение) «готовых» гормонов и биосинтез этих гормонов de novo. Доказано, что цАМФ участвует в передаче гормонального сигнала. Показано существование в плазматических мембранах клеток гипофиза специфических аденогипофизарных рецепторов, с которыми связываются гормоны гипоталамуса, после чего через систему аденилатциклазы и мембранных комплексов Са2+–АТФ и Mg2+–АТФ освобождаются ионы Са2+ и цАМФ; последний действует как на освобождение, так и на синтез соответствующего гормона гипофиза путем активирования протеинкиназы (см. далее).
Для выяснения механизма действия рилизинг-факторов, включая их взаимодействие с соответствующими рецепторами, большую роль сыграли структурные аналоги тиролиберина и гонадолиберина. Некоторые из этих аналогов обладают даже более высокой гормональной активностью и пролонгированным действием, чем природные гормоны гипоталамуса. Однако предстоит еще большая работа по выяснению химического строения уже открытых рилизинг-факторов и расшифровке молекулярных механизмов их действия.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ




