Рак прямой кишки выживаемость
Содержание
II РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
«Современные тенденции развития лекарственной терапии опухолей»
АДЪЮВАНТНОЕ ЛЕЧЕНИЕ РАКА ОБОДОЧНОЙ КИШКИ
Л.В. Манзюк, Ф.В. Доненко
Онкологический научный центр им.Н.Н. Блохина РАМН, Москва
Исследования, проведенные в последнее десятилетие, убедительно доказали важность адъювантной химиотерапии для больных раком ободочной кишки. Профилактическая лекарственная терапия, проводимая после радикальных операций, стала неотъемлемым этапом в комплексном лечении этой многочисленной группы пациентов. Эти же исследования показали, что целесообразность проведения адъювантной химиотерапии зависит от исходной стадии заболевания. Общая пятилетняя выживаемость для больных раком ободочной и прямой кишки составляет 61%, однако при локализованном процессе она выше — 92%, при наличии региональных метастазов — 63%, а при наличии отдаленных метастазов — 7% (1).
В настоящее время при раке ободочной и прямой кишки широко используется классификация Дюка или ее модификации, а так же классификация TNM, которые представлены в табл.1 (2).
Адъювантная химиотерапия стандартно назначается в стадии С по Дюку, так как высок риск развития метастазов и рецидивов, а лечение снижает этот риск и увеличивает пятилетнюю выживаемость. Считается, что больные с более низкими стадиями не имеют высокого риска развития метастазов и рецидивов, что оправдывало бы проведение профилактического лечения. Однако, значительная часть таких больных обманывают ожидания. Поэтому большое значение имеет поиск дополнительных прогностических факторов или маркеров, определяющих степень злокачественности опухоли и прогнозирующих течение болезни.
Таблица 1.
Классификации рака ободочной и прямой кишки и результаты пятилетней выживаемости в зависимости от стадии.
Показано, что высокий процент анеуплоидии ДНК и клеток в S-фазе предсказывают высокую частоту рецидивов и низкую выживаемость у оперированных больных в стадии B2 по Дюку (3). Значение других маркеров, таких как уровень РЭА до операции, наличие коллоида, экспрессия онкогенов, повреждение хромосом (делеция DDC на 18q и p53 на 17q), активность тимидилатсинтетазы, экспрессия Р-гликопротеина и др. до конца не ясно и активно изучается (4,5,6,7,8). Это необходимо для идентификации групп больных с высоким риском рецидивирования, которые также нуждаются в проведении профилактического лечения.
Первые исследования по оценке роли адъювантной химиотерапии при II-III стадиях рака ободочной кишки проведены Gastrointestinal Tumor Study Group (GITSG) в начале 80-х годов. Профилактическая химиотерапия 5-фторурацилом, проводимая после радикальной операции, сравнивалась с чисто хирургическим лечением. Было показано, что 5-фторурацил не улучшает отдаленные результаты (9). Первое исследование, показавшие положительное влияние адъювантной химиотерапии комбинацией MOF (CCNU + 5-FU + винкристин) на безрецидивную и общую выживаемость больных раком ободочной кишки II — III стадии (B2, C1 и C2 по Дюку), проведено Wolmark N с соавторами (10).
Положительное влияние профилактической химиотерапии 5-фторурацилом и левaмизолом у больных раком ободочной кишки после радикальных операций было продемонстрировано в двух исследованиях (11, 12). В первом исследовании (11) 400 пациентов раком ободочной кишки II-III стадии после радикальной операции были разделены на три группы: часть больных только наблюдалась, часть получила лечение левамизолом, часть лечилась комбинацией левамизола с 5-фторурацилом. Было показано, что профилактическое лечение левамизолом не улучшает результаты операции, а комбинация 5-фторурацила с левамизолом у больных с III стадией (стадия С по Дюку) улучшает безрецидивную и общую выживаемость. Второе исследование подтвердило результаты предыдущего: у больных с III стадией рака ободочной кишки профилактическая химиотерапия 5-фторурацилом с левaмизолом снизила риск рецидивов на 41%, а смертность на 33%(12). Таким образом, после проведенных исследований профилактическое лечение комбинацией 5-фторурацила с левамизолом у больных c III стадией (стадия С по Дюку) рака ободочной кишки было признано стандартным и рекомендовано для практического применения.
Возможный механизм синергического действия противоопухолевого препарата левамизола с 5-фторурацилом много обсуждался. Традиционно механизм действия левамизола рассматривался как иммуномодулирующий. Более поздние исследования на клеточных линиях рака ободочной кишки показали, что синергизм между двумя препаратами — результат включения 5-фторурацила в РНК, вследствие чего происходит аккумуляция НLA класса I РНК, которую левамизол делает стабильной (13).
Успешное применение комбинации 5-фторурацила с лейковорином при диссеминированном раке ободочной и прямой кишки подтолкнуло к изучению ее в качестве адъювантного лечения. В 1993 году Wolmark N. с соавторами (14) опубликовал результаты рандомизированного исследования, в котором сравнивалась комбинация MOF и комбинация 5-фторурацила с лейковорином у 1081 больного со стадией В2/С рака ободочной кишки после радикальных операций. Показано преимущество комбинации 5-фторурацила с лейковорином. Разные режимы применения 5-фторурацила с лейковорином были оценены у больных со стадией В и С рака ободочной кишки в качестве адъювантного лечения по сравнению с контрольной группой еще в трех евро-канадских исследованиях(15,16,17). В результате показано статистически достоверное снижение смертности на 22-35%, увеличение 3-летней безрецидивной выживаемости с 62 до 71%, а общей выживаемости с 78 до 83% у больных со стадией С, получавших адъювантное лечение, по сравнению с контролем.
До недавнего времени считалось, что профилактическое лечение комбинацией 5-фторурацила с лейковорином в течение 6 месяцев является более дешевым эквивалентом одногодичному применению 5-фторурацила с левамизолом. В 1997 году были опубликованы результаты рандомизированного исследования, включавшего 3759 больных со стадией В2/С рака ободочной кишки (18). Сравнивались четыре лечебных режима: I — 5-фторурацил с низкими дозами лейковорина, II — 5-фторурацил с высокими дозами лейковорина, III — 5-фторурацил с левамизолом, IY — 5-фторурацил с лейковорином и левамизолом. В результате установлено, что комбинация 5-фторурацила с лейковорином, применяемая 6 месяцев, не уступает по эффективности комбинации 5-фторурацила с левамизолом в течение 12 месяцев, а комбинация 5-фторурацила с лейковорином и левамизолом не имеет преимуществ перед другими режимами.
В настоящее время стандартным считается следующий режим профилактической химиотерапии при III стадии рака ободочной кишки: 5-фторурацил — 425 мг/м2 в/в 5 дней + лейковорин — 20 мг/м2 в/в 5 дней. Повторные курсы каждые 4-5 недель. Лечение в течение 6 месяцев. Основным проявлением токсичности этого режима является желудочно-кишечная (диарея). Одним из методов адъювантной химиотерапии рака ободочной кишки является использование короткой инфузии 5-фторурацила с гепарином в печеночную вену послеоперационно у больных с высоким риском развития метастазов в печень. По данным Taylor I с соавторами (19), который провел рандомизированное исследование, включавшее 244 больных, применение этой методики снижает риск развития печеночных метастазов и улучшает выживаемость. Однако более позднее рандомизированное исследование, основанное на наблюдениях за 1158 больными, получавшими или только операцию, или дополнительно 5-фторурацил с гепарином в печеночную вену, не подтвердило результаты Taylor с соавт., а показано лишь увеличение безрецидивной выживаемости (20).
Одним из аспектов адъювантного лечения при раке ободочной кишки является периоперационная химиотерапия, хотя ее роль еще окончательно не определена. С этой целью организовано рандомизированное исследование, в котором часть больных в течение 7 дней периоперационно получает 5-фторурацил, другая часть больных этого лечения не получает. В дальнейшем всем пациентам проводится стандартное лечение комбинацией 5-фторурацила с левамизолом. Возможно, это исследование внесет ясность в вопрос о роли периоперационной профилактической химиотерапии (21).
В последние годы появились сообщения об эффективности производного фторпиримидина препарата UFT в монотерапии или в комбинации с митомицином С в качестве адъювантного лечения у больных раком ободочной и прямой кишки (22, 23). Однако роль UFT, а также его комбинации с лейковорином должна быть уточнена в последующих исследованиях.
Различия в экспрессии антигенов между опухолевыми и нормальными клетками организма позволяют расширить возможности лечения ряда онкологических заболеваний. Для клеток колоректального рака показана экспрессия нескольких антигенов: раковоэмбрионального, мутантного K-ras, карбогидратных GM2, sTn(c), TF (c), sialyl-Le A, Le Y. Это делает возможным разработку антиген-специфических способов лечения колоректального рака (28).
Принципиально существуют два подхода к использованию антигенных различий между опухолевыми и нормальными клетками. Первый заключается в активации иммунной системы больного вакцинами, содержащими эти антигены. Второй — в пассивной иммунотерапии больного посредством введения противоопухолевых моноклональных антител.
Предклинические исследования показали эффективность обоих подходов. Так, введение мышам с опухолью толстого кишечника гуманизированных моноклональных антител huKS 1/4 -14-2, противоопухолевой антигенной детерминанте Ep CAM GA733-2 приводило практически к 80% излечению животных (24). Изготовление гуманизированных или «очеловеченных» антител стало необходимым после того, как была показана высокая эффективность их мышиных аналогов mAb 17-1A. В рандомизированных исследованиях, включавших 189 больных со стадией С рака ободочной кишки, при использовании моноклональных антител профилактически после удаления основной опухоли было показано увеличение пятилетней выживаемости на 30% и увеличение продолжительности безрецидивного периода на 27%. Однако введение чужеродного, в данном случае, мышиного, белка имеет определенные ограничения, обойти которые возможно при использовании гуманизированных антител. При клиническом изучении моноклональных антител I131-mAb Ab33 у 5 из 23 больных зарегистрирован противоопухолевый эффект (25). Разработка других антигензависимых способов лечения пока ограничена I и II фазами клинических исследований.
Вакцинация — это другой путь использования антигенных отличий опухоли для ее лечения. В настоящее время вакцинация проводится, как правило, больным с распространенным опухолевым процессом. Это, с одной стороны, может объяснить низкий иммунный ответ организма больного на антиген, но, с другой стороны, степень выраженности иммунного ответа коррелирует с более благоприятным прогнозом течения заболевания. Показано, что наличие ответа на антиидиотипические антитела 105 AD7 (мимикрируют с колоректальным опухолевым антигеном gp 72) является хорошим прогностическим признаком, так как у больных увеличивалась продолжительность безрецидивного периода. Так, у 23 больных была изучена антиидиотипическая вакцина, содержащая в качестве антигена моноклональные мышиные антитела 3Н1 (26,27).
Проводятся более широкие исследования по возможности использования в качестве адъювантной терапии вакцин на основе раково-эмбрионального антигена. В США вакцина, созданная на основе рекомбинантного РЭА, проходит I фазу клинических испытаний, и исследователи отмечают перспективность подобных работ, так как у больных с диссеминированным процессом на фоне экспрессии эндогенного РЭА удалось получить иммунный ответ и не было зарегистрировано никаких побочных реакций. В других клинических исследованиях у больных колоректальным раком удалось зафиксировать иммунный ответ к рекомбинантному РЭА, который проявлялся в РЭА-зависимых лимфопролиферативных процессах. Рекомбинантный РЭА использовали с адъювантом гидроксиалюминием и колониестимулирующими факторами. Отсутствие побочных эффектов позволило авторам рекомендовать изучение роли этой вакцины для лечения больных с менее распространенным процессом (28).
В заключение следует сказать, что согласительная конференция, проводившаяся под эгидой Национального ракового института (США) установила, что в качестве профилактического лечения при раке ободочной кишки в стадии С после радикальной операции должна использоваться комбинация 5-фторурацила с лейковорином в течение 6 месяцев или моноклональные антитела. Применение этих методов улучшает отдаленные результаты лечения больных.
Список литературы.
1. Саncer Facts. Figures-1996. Atlanta,GA: American Cancer Society; 1966: 1-33.
9. Buyse M., Leleniuch-Jacquotte A., Chalmess t. Adjuvant therapy of colorectal cancer JAMA, 1988, v.259, pp.3571-35-78.
13. ElMuataz G. Et al J. Nat. Cancer Inst., 1995., v. 87, pp. 489-495.
19. Taylor I., Machin D., Mullee M. Et al. A randomized controlled trial of colorectal cancer Br.J. Surg.,1985, v. 72, pp. 359-362.
-
 Агапов Михаил Андреевич заведующий хирургическим отделением, доктор медицинских наук, профессор
Агапов Михаил Андреевич заведующий хирургическим отделением, доктор медицинских наук, профессор
Что такое метастазы при раке прямой кишки
Метастазы при раке прямой кишки — это распространение патологических клеток опухоли от первичного места локализации в другие органы и ткани.
Метастазы при этом заболевании выявляются тем чаще, чем ниже дифференцировка клеток опухоли. Различают метастазы имплантационные (рак распространяется на близлежащие органы и лимфатические узлы) и отдаленные (раковые клетки попадают в удаленные органы по лимфатическим путям или по кровеносным сосудам).
Куда метастазирует рак прямой кишки
Если метастазирование идет имплантационным путем (около 21% метастазов), то раковый процесс распространяется в органы, расположенные анатомически близко к прямой кишке – лимфатические сосуды, параректальная клетчатка, мочевой пузырь. У мужчин это может быть предстательная железа, у женщин шейка матки, яичники или тело матки. Симптомы – это обычно боли различного характера в соответствующем органе, могут быть контактные кровотечения (у женщин), нарушения мочеиспускания. Иногда образуются свищевые ходы из прямой кишки во влагалище, мочевой пузырь или в матку, тогда появляются патологические выделения из влагалища или при мочеиспускании. Может происходить истечение мочи из прямой кишки. Наличие метастазов говорит о степени запущенности процесса. Появляются общие проявления рака:
- слабость;
- снижение веса;
- чрезмерная утомляемость;
- периодическое повышение температуры.
Если выявлена опухоль прямой кишки метастазы, распространяющиеся лимфогенным путем, будут обнаружены в регионарных лимфоузлах и по ходу лимфатических сосудов. У опухолей верхнего отдела, например, аденокарциномы прямой кишки, метастазы распространяются в лимфоузлы парааортальные (забрюшинные). Рак прямой кишки: метастазы в лимфоузлах гипогастральной группы будут найдены, если первичная опухоль локализуется в нижних отделах кишки.
Рак прямой кишки: отдаленные метастазы
Разрастаясь, опухоль прямой кишки может поражать сосуды венозного русла, а часть ее клеток при распаде попадает в кровоток. Так клетки мигрируют в отдаленные органы. Как правило, органы-мишени метастатических клеток – это:
- печень;
- легкие;
- надпочечники.
Рак прямой кишки с метастазами в печень может проявляться только местными симптомами (выделения слизи с кровью при дефекации, ложные позывы к дефекации), без признаков поражения печени. И тогда раковые опухоли органа выявляются при диагностических исследованиях (УЗИ, КТ или МРТ). Или больного могут беспокоить боли, чувство тяжести в правом подреберье. При врачебном обследовании (пальпации, перкуссии) определяется увеличенный размер печени, уплотнение ее и неровная поверхность. Метастазы в легких при раке прямой кишки занимают второе место по частоте появления среди отдаленных метастазов. Также, как и при метастатическом поражении печени, признаков вторичной опухоли легких больной может не ощущать.
Для выявления местных и отдаленных метастазов необходимо, перед началом лечения первичной опухоли прямой кишки, провести целый ряд дополнительных обследований:
- Обзорную рентгенографию грудной клетки (для обнаружения вторичных опухолей легких).
- Компьютерную томографию (иногда исследование совмещают с внутривенным введением контрастного вещества – особенно информативен этот метод при исследовании метастазов в надпочечники).
- УЗ исследование органов таза, мочеполовой системы. В т.ч. трансректальное исследование.
- Магнитно-резонансную томографию.
- Лапароскопия.
- Другие дополнительные исследования (при необходимости).
После получения итогов этих исследований, а также лабораторных анализов крови, мочи, изучения результатов биопсии, принимается решение о виде и объеме лечебных мероприятий.

Врачи Университетской клиники МГУ им. М.В. Ломоносова в работе
Задать вопрос
Лечение рака прямой кишки является актуальной проблемой современной онкологии. В некоторых случаях рак прямой кишки требует комбинированного лечения, то есть сочетания хирургического, лучевого и химиотерапевтического методов, выбор этапности и объема которого зависит от стадии заболевания.
Лучевая терапия в основном проводится на предоперационном этапе, в случаях значительного локорегионарного (местного) распространении опухоли, с целью уменьшения её размеров и повышения радикальности предстоящей операции. Лучевая терапия рака прямой кишки проводится при локализации опухоли в средне- и нижнеампулярном отделах прямой кишки. При локализации опухоли в верхнеампулярном и/или ректосигмоидном отделе прямой кишки лучевая терапия не проводится.
Химиотерапия может проводиться как на предоперационном этапе, с целью уменьшения размеров первичной опухоли, уменьшения размеров имеющихся метастазов, так и в послеоперационном периоде, в тех случаях, когда при исследовании материала, удаленного во время операции обнаруживаются лимфатические узлы с метастазами опухоли (регионарные метастазы). Другим основанием для назначения химиотерапии является наличие отдаленных метастазов.
Но в любом случае, операция является основным этапом лечения.
В нашем стационаре проводится комбинированное лечение злокачественных опухолей прямой кишки. Оно включает в себя:
1. Оперативное лечение:
- традиционные (открытые) оперативные вмешательства
- Лапароскопические операции
- Роботассистированные операции (при помощи робота Da Vinci).
2. Химиотерапевтическое лечение:
- Предоперационная (неоадъювантная) химиотерапия
- Послеоперационная (адъювантная) химиотерапия
Операция выбора
Принципиальными факторами, влияющими на выбор объема оперативного вмешательства, является соблюдение двух обязательных условий:
- обеспечение максимального радикализма операции, то есть удаление раковой опухоли вместе с зонами и путями регионарного метастазирования в едином фасциальном (эмбриональном) футляре
- и стремление хирурга обеспечить максимальную физиологичность выполняемой операции.
Кроме того, выбор характера и объема оперативного вмешательства (в первую очередь органосохраняющего) зависит от степени местного распространения опухолевого процесса и уровня локализации опухоли в прямой кишке.
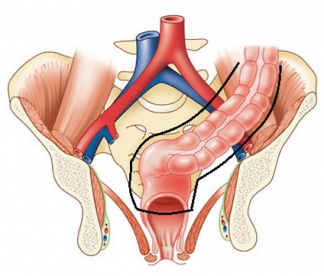
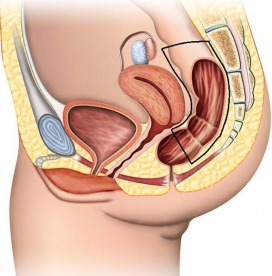
В нашем стационаре используется следующая классификация локализации раковой опухоли:
Уровни локализации рака прямой кишки
|
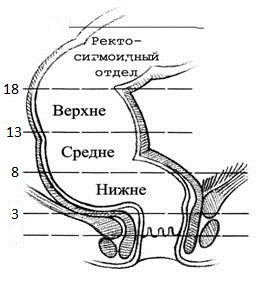
|
С учетом перечисленных факторов все операции на прямой кишке можно разделить на две группы – с сохранением и без сохранения сфинктерного аппарата прямой кишки.
В последние годы, прежде всего благодаря развитию медицинского инструментария, появлению специальных сшивающих аппаратов количество органосохраняющих операций неуклонно растет.
Лечение рака ректосигмоидного, верхне- и среднеампулярного отделов
При раке ректосигмоидного, верхне- и среднеампулярного отделов прямой кишки операцией выбора является внутрибрюшная (передняя) резекция прямой кишки.
Смысл операции заключается в удалении (резекции) части прямой кишки с окружающей её жировой клетчаткой в единой фасциально-футлярной капсуле (мезоректумэктомия) ниже опухоли на 5-6 см.
Хирургическое лечение рака прямой кишки
Резекция части прямой кишки
Хирургическое лечение рака
Удаление части прямой кишки
Данный этап операции особенно важен, так как адекватность и полнота его выполнения является важнейшим фактором для профилактики местного рецидива (из околопрямокишечных лимфатических узлов). Адекватная и полная лимфодиссекция с учетом основного пути лимфооттока также является очень важным фактором профилактики локорегионарных рецидивов, ассоциированных с заболеванием регионарных лимфатических узлов. Она достигается за счет высокой перевязки нижней брыжеечной артерии у места её отхождения от брюшной аорты.
Операция при раке прямой кишки
Циркулярный сшивающий аппарат
Завершается операция формированием межкишечного анастомоза (соустья) между оставшейся частью прямой кишки и вышележащим отделом толстой кишки (чаще всего с сигмовидной кишкой). Анастомоз формируется либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов циркулярного шва. Тем самым восстанавливается непрерывность кишечной трубки.
Лечение рака нижнеампулярного отдела прямой кишки
На протяжении длительного периода времени операцией выбора с позиции соблюдения принципов онкологического радикализма при локализации опухоли в нижнеампулярном отделе прямой кишки была брюшно-промежностная экстирпация прямой кишки. Суть операции заключалась в удалении всей прямой кишки с окружающей её параректальной клетчаткой и вместе со сфинктерным аппаратом.
| Удаление прямой кишки при нижнеампулярной локализации | Формирование колостомы на передней брюшной стенке |
Операция завершается формированием противоестественного заднепроходного отверстия (колостомы) на передней брюшной стенке.
В настоящее время брюшно-промежностная экстирпация выполняется только при больших распространенных опухолях, которые располагаются глубоко в малом тазу и вовлекают мышцы анального сфинктера или в случае локализации опухоли на расстоянии 1-2 см от анального сфинктера.
В нашем стационаре используется более радикальная методика — «цилиндрическая» экстралеваторная брюшно-промежностная экстирпация прямой кишки в модификации Хольма. Суть операции сводится к выполнению промежностного этапа вмешательства в положении больного лежа на животе, что обеспечивает более радикальное удаление опухоли при локализации ее в нижнеампулярном отделе. Выполнение промежностного этапа в положении пациента лежа на животе дает существенные преимущества при визуализации структур таза, особенно у мужчин.
В случае расположения опухоли на расстоянии 3 см и выше от анального жома возможно выполнение сфинктеросохраняющей операции, так называемой ультранизкой передней резекции прямой кишки. Суть операции заключается в том, что также удаляется прямая кишка вместе с окружающей параректальной клетчаткой в едином фасциальном футляре, высоко у аорты перевязывается нижняя брыжеечная артерия, а сама линия резекции прямой кишки проходит непосредственно над сфинктерным аппаратом.
Завершается операция как и при оперировании ректосигмоидного, верхне- и среднеампулярного отделов — формированием межкишечного анастомоза (соустья) между оставшейся частью прямой кишки и вышележащим отделом толстой кишки (чаще всего с сигмовидной кишкой). Анастомоз также формируется либо с помощью ручного шва, либо с помощью специальных сшивающих аппаратов, что позволяет восстановить непрерывность кишечной трубки.
Единственной особенностью этой операции является то, что её можно выполнить только лапароскопически или роботассистированно. Это связано с особенностями топографии прямой кишки, которая располагается в полости малого таза, в очень малом и узком по объему пространстве в окружении костей таза, крупных магистральных сосудов и нервных сплетений.
После операции
Раньше, при выполнении подобных операций традиционным способом, в послеоперационном периоде пациенты сталкивались с нарушением функции тазовых органов, в первую очередь у них были проблемы с мочеиспусканием. Сейчас, благодаря использованию малотравматичных эндовидеохирургических методов (лапароскопические и роботические операции на хирургическом комплексе Da Vinci) с их высокой четкостью и детализацией мельчайших структур можно выполнять бережные нервосохраняющие операции. Благодаря которым у больных не только не нарушается мочевыделительная функция, но и сохраняется способность получения полового удовлетворения (оргазма), что особенной важно для молодых пациентов.
Роботоассистированное лечение рака прямой кишки
Робот Да Винчи. Положение ассистента.
Робото ассистированная операция
Положение оперирующего хирурга.
По мнению большинства авторов, а также по результатам множества исследований установлено, что наиболее оптимальным местом использования роботоассистированных операций является так называемая хирургия малых пространств, к которым относится и малый таз.
В нашем стационаре выполняется весь спектр операций на прямой кишке как традиционным (открытым) методом, так и высокотехнологичными малотравматичными методами: лапароскопически и роботассистированно.
Наш стационар с его онкологическим отделением единственный в городе Санкт-Петербурге имеющий роботический комплекс DaVinci. Специалисты нашего отделения проходили стажировку в крупнейших клиниках и научных центрах США и Европы, накоплен серьезный собственный опыт выполнения такого рода операций.
Эти операции относятся к разряду высокотехнологичных, а потому дорогостоящих. Однако, благодаря наличию федеральных квот эти операции доступны всем нуждающимся в них.