Причины эозинофилии
![]()
статьи схожей тематики
Л.Я.Дубей, к.м.н.
Институт патологии крови и трансфузионной медицины АМН Украины, Львов
В 1879 г. P.Erlich впервые описал клетки крови с большим количеством интрацитоплазматических гранул, которые хорошо окрашиваются кислой краской эозином, и ввел термин «эозинофил». Эозинофилы являются основными клетками крови и тканей, играющими важную роль в аллергических реакциях, при паразитарных инвазиях, кожных болезнях, болезнях соединительной ткани, неопластических состояниях и т. п.
Подобно нейтрофилу или базофилу, эозинофил относится к гранулоцитам, образующимся в костном мозге. Морфологически это клетка диаметром 8 мкм, состоящая из двусегментного ядра (в некоторых случаях может быть три сегмента и более), мембраны и цитоплазмы, в которой содержится большое количество гранул (рис. 1). Различают два вида гранул: первичные и малые. Эозинофилспецифические гранулы в 20 % случаев связаны с мембранами. В них находится большое количество высококатионного основного белка, играющего важную роль в развитии аллергических реакций и токсически действующего как на бактерии, так и на паразитов. С помощью электронной микроскопии исследована ультраструктура гранулы, которая состоит из мембраны, прямоугольного или квадратного кристаллического ядра и матрикса (рис. 2). Следует отметить, что эозинофильные гранулы специфичны и уникальны по своим функциям. Они содержат большое количество биологически активных медиаторов как в ядре, так и в матриксе. На эозинофильной мембране находятся рецепторы к IgE, IgG, IgA, а также к комплементу (C1q, C3b/C4b, C5a), рецепторы для интерлейкина 5 (IL-5), IL-3 и гранулоцитарно-моноцитарного колониестимулирующего фактора (GM-CSF).
Основные эозинофильные медиаторы
Протеины эозинофильных гранул:
— большой эозинофильный белок;
— эозинофильный катионный протеин;
— эозинофильная пероксидаза;
— эозинофилообразующий нейротоксин.
Мембранные медиаторы:
— лейкотриены LCT4, LCВ4;
— фосфолипидные медиаторы, активирующие лейкоциты (РАF);
— циклооксигеназные медиаторы (PGE1, PGE2, тромбоксан В2).
Цитокины, которые продуцируются эозинофилами:
— интерлейкины (IL-1, IL-2, IL-3, IL-4,
IL-5, IL-6, IL-8);
— факторы роста (TGF-α, TGF-β,
GM-CSF, TNF-α);
— интерфероны (IFN-γ).
Эозинофильный гранулоцит является производным от общей клетки-предшественника миелопоэза (CD34+). В дальнейшем при дифференциации образуется клетка-предшественник эозинофилопоэза. В костном мозге у здоровых лиц эозинофильные бласты не встречаются. Иногда можно увидеть эозинофильный промиелоцит, в котором находятся одиночные эозинофильные гранулы. В процессе пролиферации и дифференциации образуются созревшие сегментоядерные эозинофилы с характерной структурой ядра и цитоплазмой.
Факторами, влияющими на пролиферацию и дифференциацию эозинофильного ряда, выступают цитокины, которые вырабатываются как самими созревшими формами эозинофильных гранулоцитов (IL-3, IL-5, GM-CSF), так и Т-хелперными лимфоцитами (IL-2,
IL-3, IL-5, туморнекротизирующий фактор α (TNF-α)). Считается, что IL-5 является ключевым в конечной дифференциации эозинофильных клеток, начиная с коммитированных предшественников (рис. 3).
Нормальная концентрация эозинофильных гранулоцитов в периферической крови составляет от 0 до
0,24 Г/л (Wintrobe M., 1999). Однако другие авторы считают, что нормальный уровень эозинофилов находится в пределах от 0,015 до 0,65 Г/л. В некоторых литературных источниках указывается на то, что концентрация эозинофилов в периферической крови составляет от 0 до 0,5 Г/л.
Существует несколько критериев для определения понятия «эозинофилия». По данным T.Robak (2002), эозинофилия — это состояние, при котором наблюдается увеличение количества эозинофилов в периферической крови — более
0,35 Г/л. А по мнению M.Wintrobe, эозинофилией считается такое состояние, когда количество эозинофилов превышает 0,5 Г/л. Чаще всего эозинофилия ограничивается периферической кровью. Однако в некоторых случаях она сочетается с тканевой инфильтрацией эозинофильными гранулоцитами.

В клинической практике встречаются эозинофилии, которые часто сочетаются с лейкоцитозом и гиперлейкоцитозом, однако выступают при этом основным симптомом.
Эозинофилии классифицируют по степени тяжести и различают по генезу возникновения.
Классификация эозинофилий
По степени тяжести:
— 0,50–1,50 Г/л — легкие,
— 1,50–5,00 Г/л — средней тяжести,
— свыше 5,00 Г/л — тяжелые.
По генезу возникновения:
— клональные,
— неклональные (вторичные, реактивные).
Клональная эозинофилия обусловлена злокачественной пролиферацией клеток, наблюдающейся при острой и хронической эозинофильной лейкемии, и очень редко встречается у детей.
Неклональные (вторичные) эозинофилии возникают вследствие стимуляционного действия цитокинов IL-1, IL-3, IL-5, TGF-α непосредственно на клеточных предшественников эозинофилов. Наиболее частые причины вторичных эозинофилий: воспалительные процессы; глистные инвазии; аллергия; прием некоторых медикаментозных препаратов; болезни кожи и соединительной ткани; неопластические состояния.
У новорожденных (как недоношенных, так и доношенных) в первые три месяца жизни бывает физиологическая эозинофилия. При этом количество эозинофилов может быть в три раза выше, чем у взрослых, и всегда носит транзиторный характер. Считается, что эозинофилия у грудного ребенка может отображать процесс роста и начало установления азотистого баланса.
Паразитарные инвазии выступают причиной как умеренной, так и значительной эозинофилии в 15–25 % случаев. По данным литературы, существует четкая взаимосвязь между паразитарной инфекцией и эозинофилией. Последняя наиболее часто наблюдается при миграционной стадии аскаридоза, миграционной и клеточной стадиях стронгилоидоза, описторхоза, фасциолеза, при распространенной перманентной миграции в организме личинок токсакароза. По данным G.Kephart и соавторов, эозинофилы выполняют функцию убийц паразитов, так как выделяют на них внутренние цитоплазматические ферменты, большие основные протеины. В таблице представлены основные виды паразитарных инфекций, которые вызывают эозинофилию у детей.
Известно, что ассоциация между аллергическими заболеваниями и эозинофилией имеет вторичный характер и участвует в развитии реакций гиперчувствительности немедленного типа. Зачастую такие реакции встречаются при бронхиальной астме, атопических дерматитах, крапивнице, анафилактических состояниях, ангионевротическом отеке, возникают вследствие приема различных лекарств. Последние образуют с белком комплекс «гаптен–белок», к которому вырабатываются антитела, соединяющиеся с лекарственным средством.
Особого внимания заслуживает инфильтрация эозинофилами легких в сочетании с эозинофилией периферической крови — так называемый PIE-синдром (pulmonary infiltrates with eozinophilia). К этому синдрому относятся: классический синдром транзиторного легочного эозинофильного инфильтрата (синдром Leffler), синдром аллергического ангиита и гранулематоза (синдром Charg–Strauss), синдром гиперчувствительного васкулита и аллергический бронхопульмональный аспергиллез (АВРА-синдром). Укажем, что «легочная эозинофилия» может протекать как остро, так и хронически, а также со смертельным исходом или доброкачественно.

Эозинофильные инфильтраты пищеварительного тракта у детей встречаются редко (5 % случаев) и могут быть как локализованными, так и диффузными. В 70 % случаев поражается антральный отдел желудка, реже — двенадцатиперстная и тонкая кишки. Упомянутые инфильтраты сочетаются с аллергическими заболеваниями (бронхиальной астмой, медикаментозной и пищевой аллергией), а в 90 % случаев — с эозинофилией периферической крови.
Следует отметить, что при некоторых доброкачественных и злокачественных заболеваниях наблюдается увеличение количества эозинофилов.
Доброкачественные и злокачественные новообразования, при которых часто встречаются вторичные эозинофилии:
— гемобластозы,
— ангиоиммунобластная лимфаденопатия,
— доброкачественные новообразования кожи,
— новообразования пищеварительного тракта,
— неопластические процессы молочной железы, почек, легких,
— онкогинекологические заболевания.
Неклональные (вторичные) эозинофилии довольно часто выявляются при гематоонкологических заболеваниях, при которых увеличение количества эозинофилов в периферической крови связано с чрезмерной продукцией опухолевыми клетками IL-5 и других цитокинов.
Вторичные эозинофилии, обусловленные гематоонкологическими заболеваниями:
— хронические миелопролиферативные заболевания
• хроническая миелоидная лейкемия
• эритремия
• эссенциальная тромбоцитемия,
— миелодиспластический синдром,
— эозинофильный фасциит,
— острая миелоидная лейкемия,
— острая лимфобластная лейкемия,
— системный мастоцитоз.
Болезни соединительной ткани (ревматоидный артрит, узелковый периартериит) могут сопровождаться увеличением количества эозинофилов в периферической крови, которое носит вторичный характер. При воспалительных процессах, обусловленных вирусной, бактериальной и грибковой инфекцией, наблюдается реактивная эозинофилия периферической крови.
Наиболее редкие причины вторичных эозинофилий:
— эозинофильная гранулема легких,
— мезентериальная эозинофилия,
— эозинофильный асцит,
— реакция отторжения трансплантата почки,
— эозинофильный перикардит,
— эозинофильный кардиофиброз,
— эозинофильный миокардит,
— синдром эозинофильной миалгии
(α-tryptofan),
— синдром токсичного масла.
Одним из тяжелых заболеваний, связанных с гиперэозинофилией и вовлечением в патологический процесс различных органов и систем, является идиопатический гиперэозинофильный синдром (ГЭС). В педиатрической практике ГЭС встречается очень редко. По данным T.Olson и соавторов, в подавляющем большинстве случаев ГЭС отмечается у мальчиков. Диагноз ГЭС довольно тяжело поставить на ранней стадии. Критериями диагностики ГЭС являются увеличение количества эозинофилов в периферической крови свыше 1,5 Г/л и продолжительность эозинофилии более 6 мес, при отсутствии других известных ее причин.
В зависимости от прогноза выделяют следующие типы ГЭС:
І тип — бессимптомный, с медленным течением, преобладающим поражением легких, ангиоэдемой, высоким уровнем IgЕ и хорошим ответом на гормонотерапию;
ІІ тип — с худшим прогнозом: в процесс вовлекаются различные органы и системы (доминируют эндомиокардиальные и неврологические нарушения);
ІІІ тип — подобен миелопролиферативному синдрому со значительной гепатоспленомегалией, анемией и тромбоцитопенией или лейкемии с цитогенетическими аномалиями эозинофильных предшественников.
Частота поражений внутренних органов при ГЭС:
— система кроветворения — 100 % случаев
— сердечно-сосудистая система — 58 %
— кожа — 56 %
— нервная система — 54 %
— легкие — 49 %
— селезенка — 30 %
— органы зрения — 23 %
— пищеварительный тракт — 23 % случаев.
Кроветворная система вовлекается в патологический процесс всегда. Общее количество лейкоцитов в периферической крови детей, больных ГЭС, превышает 20 Г/л. Наблюдается персистирующая эозинофилия с преобладанием зрелых эозинофилов и небольшим количеством незрелых клеток. В некоторых случаях отмечаются гиперсегментация ядер, вакуолизация цитоплазмы клетки и уменьшение количества гранул. У части больных имеет место умеренный нейтрофилез с небольшим количеством незрелых нейтрофильных гранулоцитов. У половины больных детей наблюдается умеренная анемия, а у 30 % — тромбоцитопения. Гипертромбоцитоз встречается в 15 % случаев. При исследовании костного мозга обнаруживается его гиперклеточность за счет гиперплазии эозинофильного ростка. Представлены все стадии созревания эозинофилов. Однако диспропорционального увеличения количества незрелых форм или бластов не наблюдается. Эритропоэз и мегакариоцитопоэз не имеют существенных отличий (Глузман Д.Ф., 2000).
Изменения в сердечно-сосудистой системе при ГЭС — наиболее часто встречающаяся и непосредственная причина смерти у детей. Выделяют три стадии повреждения сердечной мышцы при ГЭС: сегментарный ангиит и некроз миокарда; отложение фибрина и образование тромбов; формирование рубцового склероза.
У половины детей с ГЭС наблюдаются изменения кожи; кроме гиперэозинофилии они могут быть единственным признаком этого синдрома. Зачастую имеют место покраснение, узелковые высыпания на теле и конечностях. При гистологическом исследовании выявляют воспалительные изменения со значительным процентом эозинофилов.
У половины больных с ГЭС в процесс вовлекается нервная система. В таких случаях диагностируются энцефалопатия, периферическая нейропатия, очаговая симптоматика, обусловленная наличием тромбозов сосудов. У детей с энцефалопатией при ГЭС наблюдаются явления дезориентации, атаксии и потеря памяти. У большинства пациентов течение ГЭС сопровождается продолжительным непродуктивным кашлем, удушьем и астмоподобными состояниями, которые свидетельствуют о вовлечении в патологический процесс дыхательной системы.
У части детей снижается острота зрения, более чем в 50 % случаев диагностируются эписклерит, блефарит, конъюнктивит, кератит, воспаление глазных мышц, ограничение движений глазных яблок, нарушение подвижности зрачка. Перечисленные офтальмологические болезни обусловлены микротромбозом глазных сосудов. В 23 % случаев ГЭС сопутствует эозинофильное воспаление желудка и тонкой кишки.
Для установления клональной и неклональной (реактивной, вторичной) эозинофилии должны быть проведены такие основные исследования:
— копрограмма,
— тест на наличие антител к антигену конкретного паразитарного возбудителя,
— тест на наличие антиглютеновых антител,
оценка гуморального (IgA, IgG, IgM, IgE-сывороточный и секреторный) и клеточного иммунитета,
— аллергические пробы,
— тесты для выявления болезней соединительной ткани (HLA-B27, антинуклеарные антитела и т. п.),
— ультразвуковое исследование внутренних органов и сердца,
— рентгенография органов грудной клетки,
— фиброэзофагогастродуоденоскопия и колоноскопия,
— морфологические исследования периферической крови и костного мозга, цитохимические исследования,
— иммунофенотипичные исследования,
— цитогенетические и молекулярно-биологические исследования,
— иммуногистологические исследования.
Таким образом, эозинофилия всегда имеет причину, диагностический поиск которой в большинстве случаев оказывается безуспешным. Довольно часто эозинофилия протекает бессимптомно. Как гематологический синдром ее можно выявить случайно (при плановом обследовании) или когда ребенок обследуется по поводу какой-либо болезни. Независимо от характера — клональный или реактивный — длительное течение даже незначительной эозинофилии является вредным для внутренних органов.
Содержание
Статьи на похожую тематику:
1. Л. В. Квашнина, В. П. Родионов Плохой аппетит у детей: миф или диагноз?
2. Опыт применения бронхорила для лечения бронхообструктивного синдрома у детей
3. Э.Я.Фисталь, Г.Е.Самойленко, С.Г.Хачатрян Диагностика и лечение ожогов у детей
4. О. В. Зайцева Кашель у детей: дифференциальный диагноз, рациональный выбор терапии
5. Н. Л. Аряев, Е. А. Старец, Н. В. Котова Высокоактивная антиретровирусная терапия ВИЧ-инфекции у детей
6. Эволюция, проблемы и современные стандарты антимикробной терапии пневмоний у детей
7. Д.Д.Иванов, Т.П.Иванова Возможности Ксилата (Xylatum) в лечении ацетонемического синдрома у детей
8. И.Б.Ершова, А.А.Мочалова, Е.В.Чернова, С.Н.Черкасова /гастроентерологія/ Антибиотик-ассоциированная диарея у детей
9. М. А. Георгиянц, Г. И. Белебезьев, В. А. Корсунов Интенсивная терапия при острых кишечных инфекциях у детей
10. О.С.Третьякова Тромбоцитопении как причина геморрагического синдрома у детей: алгоритм диагностики и терапии
| |
|
|
Страница 6 из 11
Гиперэозинофильный синдром (синдром Леффлера II)
Гиперэозинофильный синдром (ГЭС) – болезнь, при которой в крови увеличивается количество клеток-эозинофилов, в той или иной степени повреждающих внутренние органы. На медицинском языке небольшое повышение эозинофилов называется «эозинофилия», а значительное – «гиперэозинофилия».
Здоровые эозинофилы (эозинофильные гранулоциты) – одна из иммунных, то есть защитных, сил организма. Они играют особенную роль в борьбе человека с болезнями, с паразитами, а также при аллергии, участвуют в общем управлении и связи всех звеньев иммунной системы. Свое название они получили, потому что хорошо окрашиваются краской-эозином. При большом увеличении в этих клетках можно увидеть мелкие гранулы, в которых эозинофилы «хранят» запас очень активных химических веществ.
Эозинофилия, которая возникает как ответ организма на некоторые инфекции, болезни крови, болезни суставов, называется вторичной, или реактивной. При такой реакции организма повышение эозинофилов в крови безопасно в отличии от гиперэозинофильного синдрома. Гиперэозинофильный синдром отличается от реактивных (вторичных) эозинофилий тем, что при этом заболевании в кровь постоянно поступает слишком много химических защитных веществ, и поэтому страдают внутренние органы: кишечник, сердце, легкие и другие. Бывает, что больные ГЭС жалуются на случаи «странной» нехватки воздуха, диарею, отеки, необъяснимую слабость, потливость, сыпь. Пациенты могут ощущать тяжесть в подреберьях, потому что увеличены печень или селезенка, в которых оседают опухолевые клетки. Со временем ГЭС может переходить в лимфому или острый лейкоз.
Диагноз
Диагноз «ГЭС» ставят, если у пациента длительно повышены эозинофилы крови и поражены внутренние органы. Очень важно при постановке диагноза исключить другие причины, которые могут привести к похожим изменениям крови (астму, более частые миелопролиферативные болезни крови и другие), поэтому пациента всесторонне обследуют: делают гистологическое, цитологическое и цитогенетическое исследования костного мозга. Могут потребоваться компьютерная томография и другие специальные анализы. Как правило, при ГЭС типичных изменений в генах не выявляют, хотя при выполнении цитогенетического исследования могут быть найдены некоторые поломки. Обнаружить изменения тех или иных генов очень трудно, но если их находят, то это влияет на выбор лечения.
Лечение
В настоящее время общепринятым методом лечения ГЭС является назначение лекарств, постоянный прием которых останавливает размножение больных клеток, и такие лекарства оказывают минимальное нежелательное побочное действие. Самочувствие пациента улучшается. Если со временем болезнь переходит в лимфому или острый лейкоз, то их лечат по схемам острых лейкозов или лимфом. Молодых пациентов врачи стараются вылечить с помощью пересадки стволовых (материнских) клеток крови.
В последние годы в клинической практике врачей различных специальностей все чаще встречаются заболевания и синдромы, сопровождающиеся высокой эозинофилией периферической крови. При этом особое внимание привлекают так называемые большие эозинофилии крови, при которых количество эозинофилов превышает 1500 в 1 мкл . Длительная эозинофилия может приводить к патологическому состоянию, приобретающему черты отдельной нозологии. Авторы описывают этиологию, патогенез, клинику, диагностику и принципы лечения идиопатического гиперэозинофильного синдрома (ИГЭС) и реактивной эозинофилии. С практической точки зрения особые трудности представляют диагностика и лечение ИГЭС – тяжелого заболевания, требующего длительной терапии. 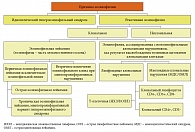 Рис. 1. Этиологическая классификация эозинофилии
Рис. 1. Этиологическая классификация эозинофилии
При эозинофилиях отмечается укорочение клеточных циклов на ранних этапах созревания эозинофилов, увеличивается митотический индекс, время генерации эозинофильных лейкоцитов сокращается в 3 раза, а время появления в кровотоке – в 2 раза. Кроме того, эозинофилы способны возвращаться в кровоток из тканей и длительно рециркулировать (Т1/2 – 44 ч) .
Функции эозинофилов
Эозинофил как отдельный клеточный элемент впервые описал Пауль Эрлих (Paul Ehrlich) в 1879 г. Именно он применил кислый краситель эозин, названный в честь греческой богини утренней зари, для гистологической окраски крови и тканей. П. Эрлих показал, что эозинофилы составляют от 1 до 3% лейкоцитов периферической крови у здоровых индивидуумов.
В течение последующих 40 лет накопилось много информации об эозинофилах: повышение числа клеток было связано с бронхиальной астмой и гельминтной инвазией. Кроме того, было установлено, что число эозинофилов в тканях животных значительно повышалось после анафилактической реакции. Это позволило предположить, что эозинофилы обеспечивают гиперчувствительность при анафилаксии. Эта гипотеза оставалась основным объяснением функции эозинофилов с начала XX века вплоть до 1980-х гг.
Согласно современным представлениям, эозинофилы – это неделящиеся гранулоциты, которые, как и другие полиморфноядерные лейкоциты (ПМЯЛ), непрерывно образуются в костном мозге из единой стволовой клетки. Эозинофилопоэз и дифференцировку эозинофилов из клеток-предшественников регулируют Т-лимфоциты путем секреции колониестимулирующего фактора гранулоцитов и макрофагов (ГМ-КСФ), интерлейкина-3 (ИЛ-3) и интерлейкина-5 (ИЛ-5). Кроме того, ИЛ-5 и ГМ-КСФ активируют эозинофилы, индуцируя переход клеток из нормальной плотности в низкую (меньше 1,085).
Продолжительность жизни эозинофилов составляет 10–12 дней. Покинув костный мозг, где они образуются и созревают в течение 3–4 дней, эозинофилы несколько часов циркулируют в крови (период их полужизни составляет 6–12 часов). Затем, подобно нейтрофилам, они покидают кровяное русло и уходят в периваскулярные ткани, главным образом в легкие, желудочно-кишечный тракт (ЖКТ) и кожу, где остаются в течение 10–14 дней. На каждый эозинофил периферической крови приходится примерно 200–300 эозинофилов в костном мозге и 100–200 в других тканях.
По данным светооптического исследования, диаметр эозинофилов составляет 12–17 мкм; они обычно несколько крупнее, чем нейтрофилы. В отличие от зрелых полиморфноядерных лейкоцитов, ядра которых имеют около четырех долек, ядра эозинофилов, как правило, состоят из двух долек, связанных между собой нитью. Основным своеобразием их цитоплазмы является наличие двух типов специфических гранул (больших и малых), которые имеют красный или оранжевый цвет. Даже в плохо окрашенных мазках эозинофилы можно отличить от гранул нейтрофилов, так как они более многочисленны и отчетливо крупнее. Большие гранулы содержат уникальные для эозинофилов основные протеины: большой основной протеин (БОП), эозинофильный катионный протеин (ЭКП), эозинофильную пероксидазу (ЭПО), эозинофильный нейротоксин (ЭН), ранее называвшийся эозинофильным протеином Х, и гомолог БОП. Малые гранулы содержат ферменты арилсульфатазу В и кислую фосфатазу, также обнаруживаемые в азурофильных гранулах нейтрофилов. Лизофосфолипаза В (кристаллы Шарко – Лейдена) – фермент мембран эозинофилов – не играет важной роли в патогенезе болезней и не имеет диагностической ценности.
Функции эозинофилов точно неизвестны. Эозинофилы обладают многими функциями других циркулирующих фагоцитов, таких как ПМЯЛ и моноциты. Хотя эозинофилы способны к фагоцитозу, они уничтожают находящиеся внутри них бактерии менее эффективно, чем нейтрофилы. Прямых доказательств того, что эозинофилы убивают паразитов in vivo, нет, но они токсичны для гельминтов in vitro, и гельминтозы часто сопровождаются эозинофилией. Эозинофилы могут модулировать реакции гиперчувствительности немедленного типа, инактивируя медиаторы, высвобождаемые тучными клетками (гистамин, лейкотриены, лизофосфолипиды и гепарин). БОП и ЭКП токсичны для некоторых паразитов и клеток млекопитающих. ЭН способен серьезно повреждать миелиновые нервные волокна. БОП и ЭКП связывают гепарин и нейтрализуют его противосвертывающую активность. ЭПО в присутствии перекиси водорода и галогенов генерирует окислительные радикалы. Длительная эозинофилия иногда приводит к повреждению тканей, механизмы которого пока не ясны. Степень повреждения связана с эозинофильной инфильтрацией тканей, продолжительностью эозинофилии и степенью активации эозинофилов. Наибольшее повреждающее действие эозинофилов обнаружено при состояниях, подобных синдрому Черджа – Стросс и идиопатическому гиперэозинофильному синдрому.
Эозинофилы в нормальном мазке крови составляют от 1 до 5% лейкоцитов. В абсолютных числах за норму принято 50–250 эозинофилов в 1 мкл (50–250 × 106/л) периферической крови. Критическим уровнем, который указывает на патологический процесс, связанный с увеличением числа эозинофилов, является уровень клеток, превышающий 450 в 1 мкл.
Выделяют 3 степени эозинофилии: легкую – 400–1500 клеток в 1 мкл, умеренную – 1500–5000 клеток в 1 мкл, тяжелую – больше чем 5000 клеток в 1 мкл. Многие гематологи считают эозинофилию умеренной при наличии 10–15% эозинофилов в периферической крови; выраженной, если их количество превышает 15%; а состояния, при которых количество эозинофилов больше 15–20%, предложено называть «большими эозинофилиями крови». Они обычно сочетаются с увеличением общего количества лейкоцитов.
Абсолютное число эозинофилов в периферической крови у здоровых людей варьирует в пределах 0–0,45 × 109/л. Количество эозинофилов обратно пропорционально возрасту человека (у новорожденных детей их больше всего). Суточные колебания числа эозинофилов находятся в обратной зависимости от уровня кортизола в плазме, причем максимум приходится на ночные часы, а минимум – на утренние.
В различных клинических ситуациях активация эозинофилов может происходить по разным, пока еще недостаточно изученным механизмам, и результаты этой активации могут носить как защитный (в большей или меньшей степени) характер, например, при гельминтозах, аллергических болезнях, так и явно патологический (при гранулематозных процессах). Изначально, в ситуациях с нормальной реактивностью, основная функция эозинофилов заключается в ограничении аллергических процессов: эозинофилы препятствуют их генерализации путем утилизации медиаторов аллергического воспаления и локализации воспалительного ответа. Однако при патологии эта мера защиты выходит за рамки биологической целесообразности и начинает приобретать черты того или иного заболевания .
Этиология и патогенез эозинофилии
С точки зрения этиологии эозинофилии разделяют на две большие группы: идиопатический гиперэозинофильный синдром и реактивную эозинофилию (рис. 1). Реактивная эозинофилия может иметь клональные (злокачественные) и неклональные (вторичные) характеристики .
Причинами неклональной (реактивной) эозинофилии (10−40% от общего количества лейкоцитов) наиболее часто являются :
- аллергические заболевания: бронхиальная астма, сенная лихорадка, экзема, крапивница, ангиоотек, лекарственная аллергия, укусы насекомых, сывороточная болезнь и др.;
- иммунопатологические нарушения: синдром Оменна (разновидность тяжелого комбинированного иммунодефицита), первичные иммунодефициты;
- кожные болезни: чесотка, токсикодермия, герпетиформный дерматит, ангионевротический отек, пемфигус;
- паразитарные заболевания: аскаридоз, трихинеллез, эхинококкоз, висцеральная форма larva migrans, стронгилоидоз, филяриоз, малярия, токсоплазмоз, пневмоцистоз;
- гематологические заболевания: лимфогранулематоз, состояние после спленэктомии, анемия Фанкони, тромбоцитопения с отсутствием лучевой кости (TAR-синдром), синдром Костманна (агранулоцитоз новорожденных – аутосомно-рецессивное заболевание), инфекционный мононуклеоз;
- семейный гемофагоцитарный синдром;
- семейная эозинофилия;
- ионизирующая радиация и облучение;
- легочная эозинофилия: идиопатическая острая эозинофильная пневмония, идиопатическая хроническая эозинофильная пневмония, эозинофилия с системными проявлениями и бронхиальной астмой (синдром Черджа – Стросс), тропическая эозинофилия, аллергический бронхолегочный аспергиллез, гранулематоз Вегенера;
- гастроинтестинальные нарушения: эозинофильный гастроэнтерит, язвенный колит, энтеропатия с потерей протеинов, болезнь Крона;
- смешанная группа патологических состояний: узелковый полиартериит, метастатическая болезнь, цирроз печени, перитонеальный диализ, хроническая почечная болезнь, синдром Гудпасчера, саркоидоз, тимома.
Известные на сегодняшний день механизмы формирования эозинофилий периферической крови – антителозависимый хемотаксис, развивающийся при паразитозах (IgE- или IgG-антитела); иммунный, опосредованный через IgE (характерен для аллергии); ответ на эозинофильный хемотаксический фактор, выделяемый некоторыми опухолями; собственно опухолевая эозинофилия (лейкоз) – не позволяют создать целостного представления о патогенезе данного феномена при патологических процессах разного генеза .
Исследованиями последних лет было показано, что эозинофил является одной из наиболее агрессивных эффекторных клеток воспаления. Эозинофильные гранулы служат источником большого количества цитотоксических продуктов, повышенное содержание которых обусловливает формирование высокого микробицидного потенциала, реализуемого как в отношении инородных субстанций, так и окружающих тканей . Однако в современной литературе эозинофильный гранулоцит принято рассматривать не только в качестве активного участника развития аллергических заболеваний и противогельминтного иммунитета, но и как важный фактор поддержания тканевого и иммунологического гомеостаза. Эозинофилы обладают способностью секретировать широкий спектр биологически активных веществ, экспрессировать на своей поверхности разнообразные рецепторные структуры и адгезивные молекулы. Лейкоциты эозинофильного ряда за счет секреции иммунорегуляторных молекул (интерлейкина-6 (ИЛ-6), интерлейкина-10 (ИЛ-10), интерлейкина-2 (ИЛ-2), интерферона-гамма (ИФН-гамма)) участвуют в регуляции функций иммунокомпетентных клеток. Вместе с тем эозинофилы принимают участие в процессах фагоцитоза, клеточной репарации, презентации антигена, воспаления, реализации врожденного и приобретенного иммунитета, свертывания крови и др. .
Основным источником цитокинов в организме являются Т-лимфоциты-хелперы (Th). Активация Th-1-лимфоцитов, продуцирующих ИЛ-2, ИЛ-3, ИФН-гамма и фактор некроза опухолей альфа (ФНО-альфа), приводит к запуску клеточного иммунного ответа. Формирование же иммунного ответа по гуморальному типу происходит при доминирующем влиянии Th-2-цитокинов – интерлейкина-4 (ИЛ-4), ИЛ-5, ИЛ-6, интерлейкина-9 (ИЛ-9) и др. . Согласно современным представлениям, именно нарушение баланса продукции цитокинов Th-1/Th-2 может иметь важное патогенетическое значение в развитии многих заболеваний .
Особое влияние на процессы пролиферации, дифференцировки и активации лейкоцитов эозинофильного ряда оказывают медиаторы, вырабатываемые преимущественно Th-2-лимфоцитами . Так, ключевым медиатором, модулирующим функциональную активность эозинофилов, является ИЛ-5 (эозинофилопоэтин), который относится к группе провоспалительных Th-2-цитокинов. ИЛ-5, первоначально названный фактором роста II В-клеток, избирательно стимулирует образование эозинофилов из их коммитированного предшественника колониеобразующей единицы эритроидного ряда (КОЕ-Э). ИЛ-5 наряду с ИЛ-3 и ГМ-КСФ активирует их дегрануляцию и высвобождение цитотоксичных протеинов, регулирует экспрессию интегриновых молекул (CD11b, СD18), приводящих к увеличению циркулирующих эозинофилов, и посредством ингибирования апоптотической гибели лейкоцитов эозинофильного ряда пролонгирует время их пребывания в кровотоке . Антагонистом ИЛ-5 в регуляции процессов программированной гибели эозинофилов является интерлейкин-12 (ИЛ-12) .
Хемокины и эотаксины, выделяемые эндотелием, эпителием, моноцитами и Т-лимфоцитами, соединяются с хемокиновым рецептором-3 эозинофилов, что приводит к миграции последних в ткани. После активации эозинофилы экспрессируют высокоаффинный Fc-рецептор к IgE, IgG и компонентам комплемента, взаимодействие которых способствует высвобождению из эозинофильных гранул токсических продуктов и провоспалительных цитокинов: пероксидазы, коллагеназы, катионного протеина, нейротоксина, лейкотриенов, компонента комплемента С4 и т.д. В дальнейшем эозинофилы подвергаются апоптозу или некрозу и фагоцитируются макрофагами.
Поглощение апоптированных эозинофилов предотвращает выделение содержащихся в них тканетоксичных веществ. Это также приводит к высвобождению из макрофагов антивоспалительных цитокинов (трансформированный ростковый фактор-бета, ИЛ-10, простагландин Е2). Когда же эозинофилы подвергаются некрозу, высвобождается их тканетоксичное содержимое (катионный белок, ферменты, липиды, нейротоксины). Фагоцитоз некротизированных эозинофилов макрофагами приводит к высвобождению провоспалительных цитокинов (тромбоксан В2 и ГМ-КСФ). По этой причине при лечении эозинофилии применяют препараты, индуцирующие именно апоптоз эозинофилов (глюкокортикостероиды, циклоспорин) .
Несмотря на то что эозинофилы в основном демонстрируют две главные функции – модуляцию реакций гиперчувствительности немедленного типа и деструкцию паразитов (в первую очередь гельминтов), персистенция эозинофилии в периферической крови может приводить к эндотелиальному и эндокардиальному повреждению вследствие внутрисосудистой дегрануляции этих клеток. Цитолитические энзимы, содержащиеся в гранулах эозинофилов, повреждая эндотелиальные клетки всего организма, могут обусловливать развитие тромбозов или эндокардиального фиброза .
Наиболее часто больные с эозинофилией выявляются в практике пульмонологов и аллергологов . Однако эозинофилия не является редкостью и при заболеваниях сердца и сосудов (системные васкулиты) . Весьма часто вышеназванный синдром встречается у больных с паразитарными (описторхоз, трихинеллез, шистосомоз, филяриоз и др.), грибковыми (аспергиллез) и вирусными (гепатиты А, В и С, инфекционный мононуклеоз) заболеваниями . Кроме того, гематологи и онкологи весьма часто сталкиваются с проблемой трактовки причин возникновения синдрома эозинофилии у больных с неопластическими процессами системы крови, происходящими из клеток-предшественников как лимфо-, так и миелопоэза (острый миелолейкоз, лимфогранулематоз, острый лимфобластный лейкоз, эозинофильная лейкемия) . Прием лекарственных препаратов также может привести к развитию эозинофилии . Описаны генетически детерминированные формы эозинофилии и идиопатический вариант ее возникновения .
Клиническая картина ИГЭС
Идиопатический гиперэозинофильный синдром характеризуется длительным повышением числа эозинофилов периферической крови и инфильтрацией эозинофилами многих органов и тканей, что и обусловливает клиническую картину мультиорганного повреждения. ИГЭС – редкое заболевание неизвестной этиологии, впервые описанное в 1968 г. Термин «идиопатический гиперэозинофильный синдром» предложен Чесидом и соавт. в 1975 г. Эмпирически ИГЭС включает:
- продолжающуюся эозинофилию > 1,5 × 109/л в течение более 6 месяцев или смерть до 6 месяцев, связанную с признаками и симптомами гиперэозинофильных заболеваний;
- отсутствие свидетельств паразитарных, аллергических или других известных причин эозинофилии, несмотря на комплексное обследование;
- предположительные признаки и симптомы органного вовлечения, включая гепатоспленомегалию, органические сердечные шумы, сердечную недостаточность, диффузные аномалии центральной нервной системы, фиброз легких, лихорадку, потерю массы тела или анемию, а также гистологически доказанную эозинофильную инфильтрацию пораженного органа или ткани или наличие объективного доказательства клинической патологии, ассоциированной с эозинофилией, если нет другой выявленной ее причины .
Идиопатический гиперэозинофильный синдром представляет собой диагноз исключения и ставится в том случае, если причину ИГЭС выяснить невозможно.
Недавние исследования продемонстрировали, что так называемый ИГЭС представляет собой значительную группу гетерогенных нарушений, которые могут являться результатом пролиферации лимфоцитов или самих эозинофилов.
ИГЭС встречается у мужчин чаще, чем у женщин (9:1), начинается между 20 и 50 годами. У детей этот синдром также не редкость. Мальчики болеют чаще девочек, их соотношение составляет 4:1. У детей ИГЭС может ассоциироваться с трисомией 8-й или 21-й хромосомы .
Клиническая картина синдрома проявляется такими неспецифическими симптомами, как общее недомогание, анорексия, потеря массы тела, периодические боли в животе, ночная потливость, кашель (как правило, непродуктивный), мышечные боли, ангионевротический отек, крапивница, повышение температуры тела. Частота поражения органов различна, гематологический синдром встречается у 100% больных, поражение сердца – у 58%, кожные проявления – у 56%, поражение нервной системы – у 54%, легочный синдром – у 49%, поражение печени – у 30%, гастроинтестинальные симптомы – у 23% .
Ключевую роль в постановке диагноза играет подсчет числа лейкоцитов и определение формулы крови. Так, число лейкоцитов у отдельных больных повышается до 90 000 и более, наблюдается выраженная эозинофилия, составляющая более 50% от общего количества лейкоцитов, что всегда побуждает исключать лейкоз. Высокое содержание клеток белой крови приходится на зрелые формы эозинофилов, однако у части больных появляются и клетки-предшественники эозинофилов. Исследование костного мозга демонстрирует его обогащение как зрелыми формами эозинофилов, так и их предшественниками. Хромосомных и цитогенетических изменений при ИГЭС не описано.
Прогностически неблагоприятным признаком считается поражение сердца, так как это может стать причиной инвалидности, а при особенно тяжелых формах патологического процесса – непосредственной причиной смерти пациента. В клинической картине можно выделить три фазы поражения миокарда. Начальная стадия описывается как стадия острого некроза; интермиттирующая стадия, следующая за некротической, характеризуется образованием внутрисердечных тромбов, которые формируются на месте развившегося ранее некроза; наконец, третья стадия – фибротическая.
Острая стадия некроза миокарда возникает в первые полтора месяца от развития гиперэозинофильного синдрома. Повреждение эндомиокарда происходит вследствие его инфильтрации лимфоцитами и эозинофилами; из гранул последних выделяется значительное число веществ, приводящих к некрозу кардиомиоцитов и формированию асептических микроабсцессов миокарда. На этой стадии заболевания клинические проявления минимальны, поэтому только произошедшая тромбоэмболия и активный поиск ее источника могут выявить признаки повреждения миокарда, наступившего вследствие эозинофильной инфильтрации эндомиокарда и развившегося некротического процесса. Начальные проявления эозинофильной инфильтрации могут подтверждаться биопсией эндомиокарда, тогда как эхокардиография и другие методы диагностики поврежденного миокарда малоспецифичны и малочувствительны. На второй стадии происходит формирование тромбов на поврежденном эндокарде. Третья стадия обусловлена воздействием белков эозинофилов на эндокард и характеризуется прогрессирующим фиброзом с вовлечением клапанов, укорочением хорд, формированием митральной и трикуспидальной недостаточности, развитием рестриктивной кардиомиопатии. Клиническими проявлениями этой стадии могут быть одышка, боль в области сердца, лево- и правожелудочковая недостаточность, шумы регургитации . При проведении эхокардиографии обнаруживаются утолщение створок митрального и трикуспидального клапанов, утолщение эндокарда, внутрисердечные тромбы, наблюдается нарушение диастолической функции желудочков . Описана атриовентрикулярная блокада высокой степени, проявляющаяся синкопальными состояниями у больной с локальным истончением межжелудочковой перегородки, выявленным при проведении эхокардиографии .
Неврологические симптомы у больных с ИГЭС могут возникнуть вследствие тромбоэмболии сосудов головного мозга, а также проявиться клиническими симптомами энцефалопатии или периферической невропатии. Церебральная тромбоэмболия возникает вследствие заноса тромба из полости сердца и проявляется в виде инсульта или же преходящих ишемических эпизодов. Терапия антикоагулянтами, как правило, не приносит желаемого эффекта, так как эмболии могут рецидивировать, несмотря на проводимую терапию. Энцефалопатия проявляется изменениями в сфере сознания, снижением памяти, возможно развитие атаксии. У некоторой части больных появляются признаки поражения моторных нейронов, о чем свидетельствует возрастающий мышечный тонус, положительный рефлекс Бабинского. Периферическая невропатия возникает почти у каждого второго больного с ИГЭС в результате токсического влияния эозинофильных белков, освобождающихся при дегрануляции эозинофилов, и проявляется в виде изменения чувствительности и атрофии мышц. Тяжесть поражения периферической нервной системы варьирует от нетяжелых невропатий до параплегии с восстановлением функций на фоне лечения преднизолоном .
Патологические изменения со стороны кожных покровов являются достаточно частой клинической проблемой у больных с ИГЭС. Больные обращаются по поводу ангионевротических отеков, уртикарных и эритематозных высыпаний, образования зудящих папул и узелков. В основе возникновения кожных симптомов лежит периваскулярная инфильтрация эозинофилами, в меньшей степени нейтрофилами. Биопсия выявляет периваскулярные инфильтраты, содержащие эозинофилы, нейтрофилы, мононуклеары, признаки васкулита отсутствуют. Реже наблюдаются язвы слизистых носа, рта, глотки, пищевода, желудка . При биопсии обнаруживаются неспецифические изменения в виде смешанных инфильтратов без эозинофилов, иногда микротромбы. Развитие кожных симптомов, таких как ангионевротический отек, уртикарные высыпания, относится к числу признаков, которые свидетельствуют о благоприятном течении болезни. Они достаточно быстро регрессируют при назначении терапии глюкокортикостероидами.
Больные с симптомами ринита при гиперэозинофильном синдроме могут иметь назальную эозинофилию, полипы при отсутствии аллергологического анамнеза, отрицательных кожных тестах, нормальном уровне IgE и отсутствии непереносимости аспирина.
Изменения, наблюдаемые со стороны органов дыхания, разнообразны по своим клиническим проявлениям. Больные часто жалуются на появление непродуктивного кашля, одышку, но бронхиальная астма не является характерным признаком для больных с ИГЭС. При рентгенологическом исследовании лишь у 25% больных выявляются инфильтраты, возникающие вследствие миграции эозинофилов в паренхиму легких. Возможно развитие легочного фиброза, особенно у больных с эндокардиальным фиброзом .
Эозинофильный гастрит, эозинофильный энтероколит, хронический активный гепатит, эозинофильный холангит и синдром Бадда – Киари вследствие обструкции печеночных вен являются результатом эозинофильного поражения ЖКТ .
Диагностика эозинофилии
Как упоминалось выше, постановка диагноза ИГЭС представляет значительную сложность, поскольку ИГЭС является диагнозом исключения и ставится в том случае, если причину ИГЭС выяснить невозможно. Поэтому, согласно этиологической классификации, необходимо исключить реактивные эозинофилии (клональные и неклональные).
Учитывая разнообразие патологий, при которых наблюдается эозинофилия, а также тяжесть осложнений, для дифференциальной диагностики реактивных эозинофилий разработан диагностический алгоритм, который включает ряд лабораторных и клинико-инструментальных исследований.
При выявлении легкой и среднетяжелой эозинофилии используются следующие лабораторные исследования: анализ кала на наличие цист, яиц и фрагментов паразитов, определение серологических маркеров паразитарных инфекций, титра изогемагглютининов, уровней IgM и IgE; исключение диффузных заболеваний соединительной ткани: обнаружение антинуклеарных антител, антител к двухцепочечной ДНК, антинейтрофильных цитоплазматических антител (АНЦА). Для диагностики поражений пищеварительного тракта определяют серологические маркеры вирусных гепатитов, молочный преципитин; с целью дифференциальной диагностики с синдромом раздраженного кишечника определяют скорость оседания эритроцитов (СОЭ), проводят эндоскопию, биопсию слизистой оболочки кишки, радиологические исследования органов брюшной полости; рентгенографию органов грудной клетки; биохимическое исследование крови для определения печеночной и почечной функций.
С целью исключения возможных органных поражений в объем обследования включают эхокардиографию, электрокардиографию, определение концентрации кардиального тропонина Т в сыворотке крови. У некоторых пациентов проводится биопсия печени; исследуются функциональные легочные тесты, бронхоальвеолярный лаваж; осуществляются неврологическое обследование, включающее осмотр, электроэнцефалографию, исследование глазного дна, нервной проводимости, радиологическое исследование головного мозга.
При персистирующей тяжелой эозинофилии используются методы определения клональности (иммунофенотипирование, цитогенетическое исследование костного мозга) .
Дифференциальная диагностика проводится с паразитарными и грибковыми заболеваниями, острой эозинофильной лейкемией, синдромом Черджа – Стросс.
Лечение ИГЭС
Целями лечения больных ИГЭС являются увеличение продолжительности и качества жизни, достижение ремиссии, снижение риска обострений, предотвращение необратимого повреждения жизненно важных органов, уменьшение риска развития побочных эффектов лечения.
Пациента с ИГЭС госпитализируют для уточнения диагноза, оценки прогноза и подбора лечения, а также при обострении заболевания и развитии осложнений.
Лечебная программа заключается в назначении глюкокортикостероидов (ГКС), винкристина, гидроксимочевины и интерферона-альфа, которые могут замедлить прогрессирование болезни . Кроме того, в некоторых исследованиях продемонстрирована эффективность внутривенного введения антител к ИЛ-5 (меполизумаб (mepolizumab)), что позволяло снизить дозу системных ГКС. При сердечно-сосудистых осложнениях могут потребоваться интенсивная терапия и хирургическое вмешательство.
В некоторых случаях при проведении лечения необходима консультация смежных специалистов. Так, проведение интенсивной терапии, любое изменение лечения требует консультации гематолога, появление или усугубление кожных проявлений – дерматолога, при отсутствии эффекта лечения неврологических проявлений или развитии новых нужна консультация невролога, при отсутствии динамики легочного процесса или наличии отрицательных изменений – пульмонолога, при развитии или ухудшении поражений сердца – кардиолога, при появлении или ухудшении состояния ЛОР-органов – ЛОР-врача.
Продолжительность утраты пациентом трудоспособности при ИГЭС зависит от тяжести заболевания. В случае госпитализации она может составлять 30–90 дней. Дальнейшее ведение пациента и его амбулаторное наблюдение должны осуществлять специалисты, обладающие опытом лечения данного заболевания. Даже на фоне активного лечения возможно развитие угрожающих жизни состояний, требующих срочной госпитализации, при этом стационар должен быть многопрофильным, а его сотрудники – обладать соответствующим опытом.
Прогноз при идиопатическом гиперэозинофильном синдроме относительно благоприятный. Проводимое лечение позволяет значительно снизить смертность пациентов. Современные клинические наблюдения демонстрируют 10-летнюю выживаемость более 70% больных.
Три главных причины эозинофилии
1. Инфекционная симптоматика
Во всём мире самой распространённой причиной эозинофилии является паразитарная инвазия. Эозинофилия настолько часто встречается с гельминтозами, что врач должен инстинктивно рассматривать возможность паразитарной инвазии при любом появлении эозинофилии. Правда, есть и исключения. Например, отсутствие эозинофилии прежде всего характерно для инвазии, вызванной Ciardia Lamblia.
Очень высокая степень эозинофилии характерна для следующих паразитарных инвазий: шистосомоз (более распространён в Африке), трихинеллёз, висцеральная миграция личинок и филяриоз (более распространён в Азии). При этих инвазиях наблюдается лимфаденопатия и гепатоспленомегалия, которые могут привести к диагностической путанице с эозинофильными синдромом.
Необходимо учитывать, что после начала лечения паразитарной инвазии количество эозинофилов в крови возрастает ещё больше и держится довольно длительное время. Это повышение свидетельствует об адекватной реакции на лечение.
Умеренная эозинофилия может наблюдаться в фазу выздоровления от инфекционно-воспалительных заболеваний, так называемая «заря выздоровления» (в разгар инфекционного заболевания количество эозинофилов может, наоборот, снижаться).
2. Аллергическая симптоматика
Уже давно замечено, что эозинофилия развивается у больных с аллергией. Обычно количество эозинофилов в крови на фоне аллергии превышает 0,6*109/л. Однако, следует иметь ввиду, что если абсолютное число эозинофилов превышает 1*109/л, то вряд ли эозинофилия обусловлена аллергией и в этом случае надо активно поискать другие причины эозинофилии.
3. Онкологическая симптоматика
Немотивированная высокая эозинофилия всегда требует всестороннего онкологического обследования, в том числе и пункции костного мозга.
При злокачественных заболеваниях эозинофилы могут обнаруживаться в тканях опухоли. При этом опухоли, при которых в тканях новообразования обнаруживаются эозинофилы, имеют более благоприятный прогноз, чем те, что протекают без эозинофилии.
Наиболее часто эозинофилия наблюдается в сочетании с раком носоглотки, бронхов, аденокарциномой желудка, толстого кишечника, матки и щитовидной железы.
Злокачественная трансформация эозинофилов наблюдается при остром эозинофильном лейкозе. Тем не менее, эозинофилия не является редкостью и при других лейкозах, например, при остром лимфобластном лейкозе или остром миелобластном лейкозе. Иногда бывает очень трудно отличить острый эозинофильный лейкоз от реактивной эозинофилии, связанной с острым лимфобластным или миелобластным лейкозами. Существенную помощь в дифференциальной диагностике дают исследования специальных маркёров клеток.
В развёрнутой стадии хронического миелолейкоза, помимо других признаков, наблюдается увеличение селезёнки (как правило) и печени (реже), повышение количества базофилов и/или эозинофилов в крови (базофильно-эозинофильная ассоциация).
Изолированная гепатоспленомегалия и лимфаденопатия с эозинофилией свидетельствуют о болезни Ходжкина. Если спленомегалия наблюдается в сочетании с массивными образованиями в брюшной полости, например, с миелобластомами или хлоромами, причиной её является лейкоз (острый лимфобластный или острый эозинофильный) .
Если у больного с эозинофилией и болезнью Ходжкина в стадии ремиссии происходит увеличение количества эозинофилов, то, скорей всего, этот рост предвещает рецидив заболевания. Вообще, повторное выявление эозинофилии после успешного лечения злокачественной опухоли означает угрозу рецидива или метастазирования. В этом смысле эозинофилия может служить предиктором эффективности терапии.




