Препараты при нейропатии нижних конечностей
Наверняка вы знаете, что дефицит некоторых важных веществ в организме может проявляться, в частности, болью в пояснице и мышцах. Какая же здесь взаимосвязь, и что можно рассказать об этом покупателям?
Группа особого назначения
Для нормального функционирования нервной системы и деятельности мозга самыми важными можно, пожалуй, назвать витамины группы В. Несмотря на то, что каждый из них отвечает за определенный участок работы, их всегда определяют в один «отряд». Они по праву носят название нейротропных средств и используются при лечении радикулопатии и боли в нижней части спины (БНС), поскольку способны подействовать на спастический компонент заболевания, оптимизировать восстановление поврежденных нервных клеток и добиться полной ремиссии.
В1 (тиамин)
Регулирует работу нервной системы и мозга, способствует миелинизации нервных волокон и улучшает проведение нервных импульсов
В6 (пиридоксин)
Важен для нормальной работы нервной системы и синтеза нейромедиаторов, нормализует процессы возбуждения и торможения в ЦНС
В12 (цианокобаламин)
Защищает нервные волокна от разрушения, блокирует синтез медиаторов воспаления и боли, улучшает обмен серотонина
В дефиците
Недостаток витаминов группы В – прямой путь к нарушению работы нервной системы, к депрессии, хронической усталости, неврологическим проблемам. Так, гиповитаминоз витамина В1 грозит развитием болезни бери-бери, для которой характерны такие признаки, как слабость, атрофия мышц, невриты, параличи. Одним из проявлений нехватки В6 могут стать периферические полиневриты, поэтому витамин нередко включают в комплексную терапию радикулитов, невритов и невралгий. Даже незначительный дефицит В12 может привести к расстройствам нервной системы (плохое настроение, усталость, быстрая утомляемость, нервозность, нарушения сна).
Где взять?
Витамины группы В не накапливаются в организме, и их запас нужно пополнять каждый день. При этом важно учитывать, что вещества, содержащиеся в пищевых продуктах (злаки, хлеб грубого помола, крупы, кисломолочные продукты, зеленые листовые овощи, мясо, рыба, дрожжи и др.), легко разрушаются при термической обработке, совместном употреблении с кофеином, алкоголем и рафинированным сахаром, при курении. Также витамины активно выводятся из организма при приеме антибиотиков, стрессах, ОРВИ.
Выходом из ситуации может стать прием препаратов витаминов группы В. Причем эффективнее принимать их в комплексе, чем каждый по отдельности, потому что они усиливают действие друг друга. Особенно это важно при радикулопатии и БНС, лечение которых обычно продолжительное и комплексное. Поскольку БНС сопровождается повреждающим воздействием на нервные волокна, то без восстановления их структуры невозможно добиться полного избавления от радикулопатии. Но это может произойти при использовании высокодозированных препаратов витаминов группы В.
Например, в растворе для инъекций Мильгамма ® содержатся тиамина гидрохлорид (В1 – 100 мг), пиридоксина гидрохлорид (В6 – 100 мг) и цианокобаламин (В12 – 1 мг). Введение в лекарственную форму местного анестетика лидокаина (20 мг) позволяет уменьшить болезненность инъекций и способствует дополнительному облегчению болевого синдрома.
Препарат для перорального применения Мильгамма ® композитум помимо В6 (100 мг) содержит также жирорастворимую форму витамина В1 – бенфотиамин (100 мг). Он быстрее проникает в нервную ткань, нормализует происходящие в ней процессы и подавляет нейропатическую боль. Комплексное использование с инъекционной формой (Мильгамма ®) помогает восстановить структуру и функцию поврежденного нерва при радикулопатии. Благодаря своим свойствам, он уменьшает потребность пациентов в НПВП, что позволяет сократить их дозу и продолжительность приема, снижая тем самым риск побочных эффектов со стороны ЖКТ.
Комплексное лечение радикулопатии
1) НПВП (Мовалис и др.)
2) Миорелаксанты (Мидокалм, Сирдалуд и др.)
3) Витамины группы В (Мильгамма®, Мильгамма® композитум)
— 1-й этап: 10 инъекций внутримышечно
— 2-й этап: по 1 драже 3 раза в день в течение 6 недель1
Радикулопатия – комплекс симптомов, сопровождающий повреждение корешка спинномозгового нерва в результате механического воздействия (сдавления)
С целью восстановления поврежденных нервных волокон при радикулопатии используют комплексные препараты, содержащие терапевтические дозы нейротропных витаминов группы В
1 Левин О.С. Комплекс витаминов группы В (Мильгамма) в лечении
дискогенной пояснично-крестцовой радикулопатии, Журнал неврологии и психиатрии, № 10, 2009.
Мила Мартынова, провизор
Содержание
Что такое сенсорная полинейропатия
Полинейропатия – группа заболеваний, характеризующихся поражением нервных окончаний. Независимо от типа основными клиническими проявлениями патологии являются развитие мышечной слабости, снижение сухожильных рефлексов и нарушение чувствительности в дистальных отделах конечностей. Заболевание носит хронический прогрессирующий характер. Лечением полинейропатии верхних и нижних конечностей занимается невропатолог.
Основные причины заболевания:
- нарушения в иммунной системе, генетическая предрасположенность;
- тяжелые хронические болезни;
- длительное применение отдельных фармпрепаратов;
- алкоголизм (препараты для лечения алкогольной полинейропатии эффективны только в случае полного отказа от алкоголя);
- системные заболевания, нарушение метаболизма;
- ВИЧ-инфекция.
Полинейропатия может носить аллергический, токсический, воспалительный и травматический характер. По течению заболевание бывает острым (развитие от трех до пяти дней), подострым (развивается в течение двух-трех недель) и хроническим (вялотекущая форма с неярко выраженной симптоматикой).
Диабетическая полинейропатия
Диабетическая полинейропатия – наиболее распространенный вид заболевания, требующий своевременного и квалифицированного лечения. Опасные последствия патологии – атрофия мышц и появление язв.
При диабетический полинейропатии больной жалуется на жжение и боли в нижних конечностях. Чувствительность снижается, появляется мышечная слабость. Проявления усиливаются по ночам. При тяжелой форме появляются язвы на ногах, развивается нейроостеоартропатия. Лечение полинейропатии направлено на устранение причин, влияющих на развитие болезни.
Демиелинизирующая полинейропатия: симптоматика
Патология относится к хроническим заболеваниям с медленно нарастающей симптоматикой. Развитие этого вида полинейропатии связано с распадом в организме белка, отвечающего за высокую скорость проведения импульса по нервам.
Основные симптомы демиелинизирующей полинейропатии:
- чувство покалывания и жжения в нижних конечностях;
- боли ноющего характера;
- общая усталость;
- апатия и депрессия (не сильно выраженная);
- незначительное повышение температуры;
- парестезия;
- мышечная слабость.
На нашем сайте https://www.dobrobut.com/ вы сможете записаться на консультацию к специалисту, который более подробно расскажет о симптомах полинейропатии ног и лекарственной терапии, которая поможет остановить развитие заболевания.
Диагностика болезни
Для уточнения диагноза врач может назначить такие обследования: УЗИ внутренних органов, рентгенографию, развернутый анализ крови, биохимию, электромиографию, люмбальную пункцию. Кроме того, потребуется консультация узкопрофильных специалистов (эндокринолога и терапевта).
Для поставки диагноза крайне важно изучить наследственность пациента.
Лечение патологии
Лечение сенсорной полинейропатии – сложный и очень длительный процесс. Основная задача терапии – прекратить воздействие поражающего фактора на нервную систему. К примеру, при диабетической необходимо добиться снижения глюкозы в организме, а при токсической полинейропатии – прекратить контакт с химическим веществом, вызвавшем патологию.
Медикаментозная терапия состоит из обезболивающих, глюкокортикоидов, антиоксидантов, витаминов группы В, сосудорасширяющих средств и препаратов, улучшающих метаболизм и микроциркуляцию. В отдельных случаях показана полная очистка крови.
Физиотерапевтические методы при дистальной полинейропатии:
- магнитотерапия и грязелечение;
- электростимуляция спинного мозга;
- иглоукалывание – эффективный метод для восстановления чувствительности;
- дарсонвализация;
- гальванотерапия;
- лечебный массаж и лечебная физкультура.
Физиотерапия особенно полезна при наследственной форме патологии и рекомендована в подострый период.
Профилактика заболевания и прогноз
Профилактические мероприятия помогут избежать столь грозного заболевания, как сенсомоторная полинейропатия. Обратите внимание на свой рацион питания, проверьте уровень сахара и откажитесь от курения и алкоголя. Неконтролируемый прием лекарственных препаратов недопустим. Своевременное лечение воспалительных заболеваний, соблюдение мер предосторожности при работе с химическими препаратами и регулярное выполнение физических упражнений помогут сберечь здоровье.
При своевременном выявлении и квалифицированном лечении прогноз по заболеванию всегда благоприятный. В противном случае человеку грозит инвалидность.
Связанные услуги:
Консультация невролога
Судороги в ногах
Полинейропатия является заболеванием периферийных нервов. Передача возбуждения ограничена или полностью отсутствует. Сначала пациенты жалуются на «мурашек» или онемение. Симптомы проявляются в стопах, реже в кистях рук, но могут проявляться и в других частях тела. На более поздних стадиях появляются боли и возможна потеря чувствительности, вследствие чего не ощущаются даже сильный холод или высокая температура.
Причиной полинейропатии в Австрии в большинстве случаев является сахарный диабет. Степень повреждения нервов зависит от возраста, продолжительности заболевания и уровня содержания сахара в крови.
В клинике Пираварт полинейропатия диагностируется как основное заболевание, но зачастую обнаруживается и как побочный диагноз при другом основном заболевании.
Точное исследование причин
При подозрении на полинейропатию проводится клиническое обследование с точным анамнезом. Устанавливаются предзаболевания, вид нарушений чувствительности, нарушения моторики и болевые ощущения. Помимо установления медикаментозного и алкогольного анамнеза выполняется и тщательный осмотр стоп. При первом лабораторном исследовании собирается информация об уровне сахара в крови натощак и в течении длительного периода, электролитическом балансе, картине крови, параметрах воспалений и показателях функции почек и печени.
При подробном неврологическом исследовании основное внимание уделяется точной проверке силы мышц, рефлексов, а также поверхностной и глубокой чувствительности. В качестве дальнейших исследований предлагается измерение СНП (скорости нервной проводимости) и ЭМГ (электромиография).
Ориентированная на механизмы болевая терапия
Терапия полинейропатии непроста. После выяснения причины заболевания осуществляется попытка ее устранения или сокращения.
Если в основе полинейропатии лежит неизлечимое заболевание или ее причины неясны, возможно лишь лечение симптомов.
«Обезболивающие медикаменты, применяемые при полинейропатии, отрицательно сказываются на функции почек, поэтому при лечении болевого синдрома важна точная установка», объясняет д-р Кулизев. «Важным преимуществом клиники Пираварт является имеющееся в нашем распоряжении время, необходимое для согласования медикаментов. Четыре недели ‒ оптимальный срок для непрерывного лабораторного контроля индивидуальной установки командой врачей.»
Больше чувствительности
В ходе неврологической реабилитации путем сопровождающей физиотерапии и спортивной терапии осуществляется попытка компенсации отклонений в движениях и увеличения силы мышц.
При выраженной потере чувствительности дополнительно назначается эрготерапия. При нарушениях мелкой моторики рук целесообразны тренировки, обеспечивающие улучшение чувствительности. Устранить нарушения чувствительности помогут и гальванические ванны. Подобный принцип действия имеют терапия с применением сетчатых перчаток. С помощью перчатки возможна электрическая стимуляция соматосенсорных областей мозга рукой с противоположной стороны.
При диабете и невропатии, например, важен стабильный уровень сахара. Собственные ассистенты-диетологи в клинике используют время пребывания гостей для наглядного объяснения связей заболеваний и питания.
И еще одна просьба у д-ра Кулизева к назначающим врачам: «Важно мотивировать пациентов, но слишком много обещать не следует! И мы не способны творить чудеса!» И все же есть положительный пример, о котором часто вспоминает д-р Сузанне Шютценбергер-Зитта: «Одна русская пациентка была направлена в клинику Пираварт из больницы Франца-Иосифа в Вене – с особой формой полинейропатии и в кресле-коляске. Она получила хорошее лечение острой формы в больнице, и ей повезло, поскольку у нее была излечимая форма. Всех нас тогда поразило, что по окончании лечения она ушла в своих туфлях-балетках.»
Дорогие коллеги! Вся команда оценки состояния пациентов клиники Пираварт будет всегда рада ответить на Ваши вопросы, рассмотреть предложения и обмениваться информацией. Если Вы желаете обсудить с нами особые вопросы, касающиеся Ваших пациентов, мы всегда к Вашим услугам.
В настоящее время доказано, что нейропатия не самостоятельная болезнь, а симптом или проявление других соматических заболеваний. Диабетическая полинейропатия (ДПН) – наиболее частое осложнение сахарного диабета. Задачами клинициста являются ранняя диагностика, своевременная профилактика и лечение ДПН. Современный подход к терапии ДПН предполагает использование комбинированных препаратов, в частности препарата Кокарнит.
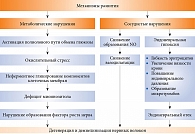 Рисунок. Патогенез ДН
Рисунок. Патогенез ДН  Таблица 1. Состав препарата Кокарнит
Таблица 1. Состав препарата Кокарнит  Таблица 2. Эффекты компонентов препарата Кокарнит
Таблица 2. Эффекты компонентов препарата Кокарнит 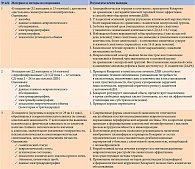 Таблица 3. Результаты трех исследований эффективности комплексного препарата Кокарнит при лечении различных видов нейропатии (диабетической и алкогольной)
Таблица 3. Результаты трех исследований эффективности комплексного препарата Кокарнит при лечении различных видов нейропатии (диабетической и алкогольной)
Распространенность сахарного диабета (СД) приобретает угрожающие масштабы. Особую тревогу вызывают осложнения заболевания, приводящие к ранней инвалидизации и смерти пациентов. При СД типа 2 риск развития сердечно-сосудистых осложнений настолько высок, что в настоящее время заболевание относится к группе сердечно-сосудистых .
Главная причина развития осложнений – хроническая гипергликемия. Метаболизм глюкозы у больных СД нарушается в результате дефицита инсулина или инсулинорезистентности периферических тканей.
Утилизация глюкозы в инсулинзависимых тканях – печени, жировой ткани, мышцах осуществляется при участии инсулина . Связываясь со специфическим рецептором на поверхности клеточной мембраны, инсулин способствует экспрессии глюкозного транспортера 4 в мышечной и жировой тканях и поступлению глюкозы внутрь клетки.
Инсулиннезависимые ткани (эндотелий, нервная ткань, хрусталик) также используют глюкозу в качестве энергетического материала. Глюкоза в эти ткани поступает беспрепятственно, в частности в нервную ткань – путем диффузии.
Помимо глюкозы нервной клетке необходим кислород .
В клетке глюкоза расщепляется до пирувата, который при прохождении цикла Кребса окисляется с образованием аденозинтрифосфата (АТФ). Собственные запасы глюкозы и кислорода в нервной клетке крайне малы, и для ее удовлетворительного функционирования необходимо их постоянное поступление .
Метаболизм глюкозы осуществляется и в теле нейрона, и в его отростках, шванновских клетках (миелиновой оболочке). Следовательно, все структуры нервной ткани способны синтезировать АТФ.
Функция нервной клетки заключается в проведении нервного импульса, который зависит от градиента концентрации ионов K+ и Nа+ внутри и вне клетки. АТФ необходима для поддержания активности Nа+/K+-АТФазы – фермента, участвующего в генерации нервного импульса и транспорте ионов против градиента концентрации .
Диабетическая нейропатия
Диабетическая нейропатия (ДН) – наиболее частое осложнение СД.
Первая монография, посвященная неврологическим осложнениям СД, вышла в 1864 г. (автор Ш.-Я. Маршал де Кальви) , однако клинические описания пациентов с СД и болевым синдромом и парестезиями в нижних конечностях появились уже в 1798 г. .
Впервые клиническую классификацию ДН предложил В.М. Прихожан (1981 г.). Он описал центральную и периферическую ДН, острые и хронические нарушения со стороны центральной и периферической нервной системы . В 1998 г. была принята классификация, подразделяющая ДН на доклиническую и клиническую .
У пациентов с СД типа 1 клинические проявления диабетической полинейропатии (ДПН) обычно выявляются через пять лет после манифестации заболевания . У больных СД типа 2 – одновременно с диагностированием заболевания. Необходимо отметить, что симптомы периферической ДН наблюдаются у 50–70% пациентов. Однако результаты электромиографического исследования свидетельствуют о наличии заболевания у всех страдающих СД.
Признаками периферической ДН являются жалобы на онемение, боль в ногах, мышечную слабость, зябкость конечностей, парестезии. Симметрично нарушается температурная, тактильная и болевая чувствительность, развивается гипо- и арефлексия. Кроме того, отмечаются трофические нарушения вплоть до язвенных дефектов тканей, нарушение потоотделения, изменение цвета кожных покровов .
Большой проблемой для врача и пациента является автономная (висцеральная) ДН .
В 1986 г. D.J. Ewing выделил две группы расстройств вегетативной регуляции у больных СД: клинически явные и бессимптомные. Он также показал зависимость продолжительности жизни больных от наличия или отсутствия автономной ДН . Клинические проявления заболевания настолько разнообразны, что часто маскируют истинную причину плохого самочувствия больного.
Наиболее опасная форма автономной ДН – кардиоваскулярная. Для нее характерна синусовая тахикардия, ригидный сердечный ритм, ортостатическая гипотония, безболевые стенокардия и инфаркт миокарда, изменения на электрокардиограмме: депрессия ST, удлинение интервала QT, инверсия зубца Т.
Поздняя диагностика и отсутствие терапии на ранних стадиях становятся причиной инвалидизации и высокой смертности больных СД . Автономная ДН характеризуется множественными дисфункциями желудочно-кишечного тракта: рефлюкс-эзофагитами, дисфагиями, тошнотой, рвотой, атонией желудка и гастропарезом, энтеропатией с усилением моторики кишечника с профузными поносами или стойкими, не поддающимися терапии запорами.
К нарушениям мочеполовой системы при автономной ДН относятся эректильная дисфункция, мочевой рефлюкс, атония мочевого пузыря.
У больных с длительным течением СД на фоне автономной ДН нарушается адреналин-опосредованная клиника гипогликемического состояния: внезапное развитием эпизодов тяжелой гипогликемии .
Патогенез
Морфологические изменения нервной ткани у больных СД достаточно специфичны и отмечаются во всех отделах центральной, периферической и вегетативной нервной системы. Они характеризуются уменьшением числа аксонов в нервных стволах. Сначала поражаются более тонкие, безмиелиновые волокна, в дальнейшем происходят истончение и демиелинизация нервных волокон, повреждение шванновских клеток вплоть до полной их дегенерации. Все это приводит к денервации тканей. При этом дегенеративные изменения происходят и в нервных ганглиях, в результате чего уменьшается число клеточных структур .
Для адекватного терапевтического воздействия необходимо учитывать механизмы, лежащие в основе указанных изменений. Наиболее доказанными на сегодняшний день являются метаболический и сосудистый (см. рисунок).
В условиях относительного или абсолютного дефицита инсулина и, как следствие, гипергликемии происходит активация полиолового пути – пути утилизации глюкозы в инсулиннезависимых тканях, в том числе нервной. В условиях нормогликемии посредством него утилизируется около 1% глюкозы. При хронической гипергликемии вследствие активации полиолового пути происходит частичное истощение ферментных систем (альдозоредуктазы и сорбитолдегидрогеназы). В результате в нервных клетках накапливается сорбитол, а также происходит каскад метаболических изменений: истощение эндогенного антиоксиданта таурина, усиление аутоокисления глюкозы и накопление кислородосодержащих свободных радикалов.
Нарушение утилизации глюкозы через полиоловый путь, снижение образования АТФ и активности Nа+/K+-АТФазы приводят к накоплению внутриклеточного Nа+ и структурным изменениям нейронов, снижению скорости проведения импульса по миелиновым волокнам.
Вследствие накопления сорбитола снижается поступление миоинозитола в клетку, из которого синтезируется фосфоинозитол – основной регулятор Nа+/K+-АТФазы .
Еще одно метаболическое нарушение в условиях гипергликемии –гликирование белков, в частности белковых структур нервного волокна. Гликирование – процесс соединения альдегидной группы углеводной молекулы (глюкозы, фруктозы) и аминогруппы белковой молекулы без участия ферментов.
Гликирование миелина приводит к нарушению проводимости нервного волокна. Гликирование ферментов (альдозоредуктазы, сорбитолдегидрогеназы) – к увеличению энергетического дефицита в нервной клетке.
Помимо метаболических нарушений на развитие нейропатии влияют и изменения эндоневральных капилляров – vasa nervorum. Гипергликемия вызывает эндотелиальную дисфункцию. Механизм – избыточная продукция вазоконстрикторных факторов (эндотелина 1, ангиотензина), подавление синтеза простациклина, оксида азота (NО) – сосудорасширяющих и антиагрегантных факторов.
Роль NО не ограничивается расширением локального участка сосудистого русла. Это вещество способно подавлять пролиферативный ответ гладкомышечных клеток сосудистой стенки, блокировать агрегацию тромбоцитов, окисление липопротеинов низкой плотности, адгезию молекул воспаления на эндотелиальных клетках, продукцию эндотелина и др.
У больных СД отмечается эндотелиальная дисфункция с отложением фибрина, утолщением и фиброзом медии, избыточной продукцией коллагена, фибронектина, ламенина. Указанные изменения приводят к развитию ишемической гипоксии нервов, усилению анаэробного гликолиза с избыточным образованием лактата и сниженным синтезом АТФ.
Современная фундаментальная наука ключевую роль в инициации повреждения эндоневрального кровотока отводит окислительному стрессу. Причинами избыточного образования свободных радикалов считаются гипоксия, снижение антиоксидантной защиты, аутоокисление глюкозы, активация полиолового пути.
Избыточная продукция кислородосодержащих свободных радикалов способствует окислению мембранных липидов в нервных клетках. Мишенью свободных радикалов является и молекула NО, при окислении которой образуется высокотоксичное вещество пироксинитрит (ONOO). Деградация NO усиливается и вследствие повышенного образования супероксидного аниона – продукта окислительного стресса.
При активации полиолового пути у больных СД резко снижается функция эндотелиальной NO-синтазы – фермента, ответственного за синтез NO из L-аргинина.
У здорового человека активность окислительного стресса ограничивается супероксиддисмутазой, каталазой, глутатионпероксидазой, витаминами Е, С, А и восстановленным глутатионом. При гипергликемии снижается активность гликированных ферментов, поэтому превалируют прооксидантные факторы.
В экспериментальной эндокринологии доказана возможность влияния изосорбита нитрата (источник NO) на скорость проведения возбуждения по нервному волокну и улучшение эндоневрального кровотока .
Терапия
Результаты исследований UKPDS и DCCT доказали зависимость развития осложнений СД от длительности заболевания и компенсации углеводного обмена . Так, в исследовании DCCT благодаря поддержанию адекватного контроля гликемии прогрессирование ретинопатии снизилось на 54%, риск развития ретинопатии – на 76%, микроальбуминурии – на 39%, нейропатии – на 60%. В исследовании UKPDS снижение гликированного гемоглобина на 1% способствовало уменьшению смертности от СД на 21%, частоты острого коронарного синдрома – на 14%, риска развития микроангиопатии – на 37%, нарушения периферического кровообращения – на 43%. Следовательно, основным условием профилактики и лечения осложнений СД является стойкая компенсация углеводного обмена. Однако при ДПН этого бывает недостаточно.
В терапии ДПН выделяют два направления:
патогенетическое – для восстановления пораженных нервов и улучшения проведения возбуждения в нервных клетках;
симптоматическое – для уменьшения боли.
Кокарнит
Принимая во внимание четыре составляющих успешной терапии – эффективность, безопасность, комплаентность и удобство в применении, разрабатываются и модернизируются лекарственные препараты, в состав которых входит несколько компонентов. К таким препаратам относится Кокарнит компании World Medcine (ЛП 002839 от 23.01.2015) (табл. 1).
Согласно исследованиям, проведенным в Германии (2015 г.), плазменная концентрация пиридоксальфосфата (активная форма витамина В6) у пациентов с СД достоверно ниже по сравнению с пациентами контрольной группы. При наличии микроальбуминурии этот показатель снижается еще более выраженно.
Дефицит витамина В12 по результатам измерения концентрации голотранскобаламина и метилмалоновой кислоты в плазме крови отмечался реже, чем дефицит витаминов В1 и В6. Он выявлялся у 6,8% пациентов с СД, при наличии микроальбуминурии – у 8,7%.
По данным других исследований (2000, 2003, 2007 гг.), распространенность дефицита витамина В12 среди лиц пожилого возраста составляет от 5 до 40%. У пациентов с СД, особенно пожилого возраста, отмечается высокая частота атрофического гастрита и ассоциированной с ним мальабсорбции кобаламина. Высокий уровень гомоцистеина, обусловленный дефицитом витамина В12, приводит к прогрессированию атеросклероза. В то же время низкий уровень цианокобаламина в сыворотке крови связан с повышением риска когнитивного дефицита в два – четыре раза, особенно у пациентов с частыми гипогликемическими состояниями и неудовлетворительной компенсацией СД.
Согласно результатам многоцентрового рандомизированного плацебоконтролируемого исследования (2012), длительное лечение СД типа 2 метформином ведет к дефициту витамина В12. При этом снижение уровня витамина В12 носит прогрессирующий характер.
Установлено также снижение фолиевой кислоты у пациентов, длительно получавших метформин.
В ряде исследований доказано, что аспирин может уменьшить всасывание витамина В12 в желудочно-кишечном тракте на 55%. Получены данные о развитии мегалобластной анемии на фоне приема ацетилсалициловой кислоты. Именно поэтому уровень витамина В12 необходимо контролировать у всех больных, получающих аспирин более месяца .
Таким образом, применение препаратов, содержащих витамины В6 и В12, является обоснованным и целесообразным у пациентов с СД.
В табл. 2 перечислены эффекты компонентов препарата Кокарнит.
Боль является частой жалобой при полинейропатии. Она может быть жгучей или ноющей, хронической или развиться стремительно в течение нескольких недель и даже дней (острая форма). Лидокаин, входящий в состав Кокарнита, помогает купировать болевой синдром.
Эффективность и безопасность Кокарнита доказаны во многих клинических исследованиях, результаты трех из них представлены в табл. 3 .
Важно отметить, что при применении препарата Кокарнит не наблюдается покраснения кожных покровов и чувства жара, тахикардии, головокружения, выраженного снижения артериального давления.
Заключение
Лечение ДПН должно быть комплексным. Пациентам показаны сахароснижающие препараты для оптимального контроля гликемии, а также препараты, в состав которых входят компоненты, действующие на разные мишени метаболизма. Речь, в частности, идет о кокарбоксилазе, которая улучшает усвоение глюкозы, трофику нервной ткани, способствует нормализации функции сердечно-сосудистой системы; никотинамиде, который участвует в метаболизме жиров, протеинов, аминокислот, пуринов, тканевом дыхании, гликогенолизе и в отличие от никотиновой кислоты не оказывает выраженного сосудорасширяющего действия, препятствует демиелинизации нерва; цианокобаламине; АТФ, который регулирует энергетический обмен. Все указанные вещества содержатся в препарате Кокарнит.
Все разновидности невро- и плексопатий объединяет общий характер возникающих при них двигательных нарушений — вялый парез или паралич. В то же время разнообразие этиологических факторов, приводящих к поражению периферической нервной системы, определяет и существенные различия в подходах к восстановительному лечению этих больных.
Дифференцированность реабилитационных мероприятий определяется в первую очередь этиологией и распространенностью поражения нервов. В связи с этим среди больных, нуждающихся в восстановительном лечении в условиях специализированного реабилитационного учреждения, можно выделить три основных клинико-реабилитационных группы:
I — больные с острым травматическим повреждением периферического нерва или сплетения;
II — больные с компрессионно-ишемическими (туннельными) мононевропатиями и плексопатиями;
III — больные с полиневропатиями различной этиологии.
Такое разделение весьма условно, поскольку в реабилитационное учреждение могут поступать и больные с токсическими, инфекционными и прочими мононевропатиями и плексопатиями. Однако процент таких больных обычно весьма невелик.
Травматические невро и плексопатии.
К этой группе относятся больные с острым травматическим повреждением нервов (акцент на острой травме сделан не случайно: в патогенезе туннельных невропатий также существенная роль отводится травме, но не острой, а хронической). Первоочередной задачей при лечении этих больных становится решение вопроса о показаниях к нейрохирургическому вмешательству. При открытых травматических повреждениях нерва или сплетения, сопровождающихся утратой функции нервных стволов, обычно выявляется их анатомический перерыв. Возможность самопроизвольного восстановления при этом, как правило, исключена. В этих случаях необходимо оперативное вмешательство на нерве во время первичной обработки раны или вскоре после ее заживления. Исключения иногда составляют огнестрельные ранения, когда паралич нервных стволов может быть обусловлен их сотрясением (нейрапраксия). Поэтому при отсутствии очевидных признаков анатомического перерыва показания к оперативному лечению огнестрельных повреждений определяют не ранее чем через 2–3 недели после травмы (когда в значительной степени регрессируют явления сотрясения нервного ствола) при отсутствии признаков восстановления функции. При закрытых травматических поражениях нервных стволов нередко наблюдается сохранность оболочек нерва (аксонотмезис), что предопределяет возможность его самопроизвольного восстановления. Поэтому вопрос о хирургическом решении решается чаше не ранее чем через 1.5–2 месяца после травмы при условии проведения за это время интенсивного курса консервативного лечения и динамического нейрофизиологического контроля. При ишемических плексо- и невропатиях, развивающихся при массивных кровоизлияниях в мягкие ткани, показано раннее (в первые часы после травмы) оперативное вмешательство, направленное на удаление внутритканевой гематомы и окончательную остановку кровотечения. Необходимо отметить также, что оперативное вмешательство в форме ревизии поврежденного нерва должно широко практиковаться во всех сомнительных и неясных случаях. Операции, выполняемые при травматических повреждениях нервов, можно разделить на две группы:
1) операции на нервных структурах;
2) ортопедические операции на сухожильно-мышечном аппарате, костях и суставах.
Операции на нервных структурах подразделяют на первичные реконструктивные вмешательства (выполняемые при открытых травмах в процессе первичной хирургической обработки), ранние отсроченные (выполняемые в первые недели после повреждения) и поздние отсроченные (выполняемые по прошествии нескольких месяцев и лет). Основные требования к оперативным вмешательствам на нервах включают:
оперативные вмешательства на нервах должны проводить врачи-нейрохирурги, прошедшие подготовку по хирургии периферической нервной системы;
оперативные вмешательства следует проводить с использованием микрохирургической техники;
при отсутствии соответствующих условий (диагностической аппаратуры, хирургического инструментария и квалифицированных специалистов) первичный шов нерва дает плохие результаты; в связи с этим следует рекомендовать шире применять в нейрохирургических стационарах раннее отсроченное вмешательство.
Таким образом, первичные реконструктивные вмешательства выполняются не так часто, при этом к основным условиям для наложения первичного шва, помимо вышеуказанных, относится отсутствие воспаления в ране. Отсроченное восстановление выполняется тем больным с открытой травмой, которым не было показано первичное восстановление (желательно осуществить у них эту операцию как можно в более ранние сроки), а также больным с закрытыми повреждениями. При закрытых повреждениях оптимальным для операции считают срок 8–12 недель после травмы, так как к этому времени обычно уже можно определить степень повреждения нервных структур и вероятность их спонтанного восстановления. У оперированных в более поздние сроки результаты восстановления функций существенно ниже. Однако в литературе имеются указания на весьма успешные результаты при операциях на поврежденном нерве через 2–3 года и даже 10 и более лет после ранения. Тем не менее критическим сроком между травмой и наложением шва считают: для восстановления чувствительности — 2–3 года, для восстановления двигательных функций — 3–4 года при сохранении электровозбудимости мышц.
Техника восстановительных операций на нервных стволах (невролиз, шов нерва, аутопластика невральными трансплантатами, перемещение нервов и т. д.) описаны в статье: «Нарушение проводимости нервных волокон при травмах»
Ортопедические операции на сухожильно-мышечном аппарате, костях и суставах выполняются, как правило, в поздние сроки после повреждения (спустя год и позже) и направлены на коррекцию вторичных изменений и улучшение функции поврежденной конечности. К этим операциям приходится прибегать и при корешковых повреждениях (отрыв корешка), при которых восстановление целостности нервного проводника технически невозможно. Ортопедические вмешательства направлены на устранение контрактур, восстановление стабильности суставов, заместительное восстановление отдельных движений. К числу таких операций относятся перемещение сухожилий и лоскутов мышц, артродез, тенодез, резекция кости и др. Консервативное лечение проводится при отсутствии данных за полное нарушение проводимости нервных стволов, а также в качестве предоперационной подготовки и в комплексе послеоперационных реабилитационных мероприятий. Оно направлено на восстановление проводимости нервных стволов, улучшение процессов тканевого метаболизма, ликвидацию ишемических и воспалительных явлений, предупреждение и лечение осложнений (контрактур, болевого синдрома, атрофии мышц, растяжений связочного аппарата). Наиболее оптимальный срок для начала консервативной терапии — первые 5–8 дней после травмы. Лечение, начатое спустя 15 и более дней после травмы, считается уже поздним. Желательным является раннее стационарное лечение с последующим продлением реабилитационных мероприятий амбулаторно.
При консервативном лечении неоперированных повреждений нервов используют медикаментозную терапию, физиотерапию и массаж, кинезотерапию и ортезирование, рефлексотерапию, трудотерапию.
Среди лекарственных средств применяют следующие группы препаратов:
болеутоляющие и противовоспалительные средства (при болевом синдроме): чаще всего используют нестероидные противовоспалительные препараты (индометацин, ибупрофен, сургам и пр.) в общепринятых дозировках. При вегетативной окраске боли применяются вегетотропные средства и препараты фенотиазиновогорядатизерцин, этаперазин.
витамины группы В: витамин В1 (раствор тиамина хлорида 2,5 % либо 5 % или тиамина бромида 3 % либо 6 % по 1 мл внутримышечно ежедневно 1 раз в сутки, курс 30 инъекций, повторный курс через 3 недели); витамин В12 (по 400 мкг 1 раз в 2 суток в течение 40–45 дней внутримышечно, можно одновременно с витамином В1, но не в одном шприце);
при сопутствующих ишемических и трофических нарушениях — вазоактивные средства: трентал (в драже, по 0,1г три раза в сутки в течение З-х-4-x недель, либо внутривенно капельно по 5 мл один раз в сутки; в 1 мл содержится 0,02 г активного вещества); солкосерил (от 80 до 200 мг внутримышечно или внутривенно капельно ежедневно, курс 15–30 инъекций);
препараты, улучшающие синоптическую передачу за счет ингибирования антихолинэстеразы: точка зрения отечественных и зарубежных авторов относительно целесообразности применения этих препаратов расходится. В практике отечественной неврологии широко применяют оксазил (в таблетках по 0.005 г три раза в сутки после еды в течении 3-х недель, повторный курс через 2- 3 месяца), прозерин (0.05 % раствор по 1 мл подкожно один раз в сутки в течение 30 дней, повторный курс через 3–4 недели); к противопоказаниям относятся эпилепсия, бронхиальная астма, стенокардия. За рубежом антихолинэстеразные препараты в реабилитации больных с невропатиями не применяют.
Массаж назначается в возможно более ранние сроки. В первые дни применяется легкий релаксирующий массаж мышц шеи, сегментарной зоны и пораженной конечности, на этапе реиннервации нервных стволов показан массаж по стимулирующей методике. Однако при этом массаж поврежденной конечности не следует производить с большой силой. Массаж должен быть умеренным и недлительным, но производиться в течение многих месяцев (между курсами делаются короткие перерывы). Полезно обучить самого больного осторожному легкому непродолжительному массированию пораженной конечности 2–3 раз в день. Ортезирование применяется с целью предупреждения и устранения контрактур и растяжений сухожильно-связочного аппарата. Используют гипсовые лонгеты и ортезы. Их применению должны предшествовать мероприятия, направленные на устранение реактивной отечности конечности. Ортезы должны быть легкими, не стеснять сохранившихся движений, не сдавливать подлежащие ткани, в особенности на местах с нарушенной чувствительностью, не нарушать кровообращение в конечностях. Для профилактики контрактур сегмент конечности обычно удерживается с помощью ортеза в функционально выгодном положении: например, при повреждении лучевого нерва — разгибательное положение кисти и пальцев; при повреждении малоберцового нерва — удержание стопы в среднем положении; при поражении плечевого сплетения — отведение и ротация кнаружи плеча, супинация предплечья и разгибание кисти. Лечебная гимнастика: вначале, при отсутствии активных движений, применяют лечение положением; упражнения для мышц плечевого или тазового пояса с целью улучшения лимфо- и кровооттока; пассивные движения во всех суставах паретичного сегмента или конечности с одновременным использованием мысленных волевых упражнений. При появлении самопроизвольных движений, даже минимальных, особое внимание уделяется активным упражнениям со строго индивидуальным дозированием постепенно увеличиваемых физических нагрузок. Вначале активные движения выполняют в облегченных условиях (исключение силы тяжести конечности и силы трения о рабочую поверхность) в сочетании с одновременной тренировкой здоровой конечности. Оптимальны занятия гимнастикой в ванне с температурой воды 35–45 градусов. Следует подчеркнуть недопустимость интенсивных продолжительных физических нагрузок, поскольку паретичные мышцы характеризуются быстрой утомляемостью, а передозировка упражнений приводит к нарастанию мышечной слабости. Резкие сильные движения могут приводить также к смещению концов прерванного нерва. Во всех тех случаях, где не исключается возможность полного анатомического перерыва нервного ствола, в раннем периоде после повреждения рекомендуется воздержаться от механотерапии.
Физиотерапевтические процедуры: выбираются с учетом срока заболевания, возраста, сопутствующей патологии, эффективности предшествующего лечения. В первые 3–4 дня местно на область повреждения назначают УФ облучение интенсивностью 2–3 биодозы, тепловые дозы электрического поля УВЧ по 5–10 минут (при каузалгии э. п.УВЧ используется в олиготермической дозировке, т. е. без ощущения тепла).
Затем переходят к одной из следующих методик либо их чередованию:
электрофорез различных комбинаций лекарственных веществ (0,5 % дибазол либо 0,1 % прозерин с анода и 2 % калия йодид с катода, 2 % кальция хлорид или 5 % новокаин с анода и 2 % никотиновая кислота с катода) на проекцию соответствующего сегмента спинного мозга и по ходу поврежденных стволов, сила тока 10 мА, 15–20 минут. 12–15 сеансов на курс;
синусоидальные модулированные токи III и IV род работ, глубина модуляции 75 %, частота 80- 30 гц, 10 минут, 10–12 сеансов;
ультразвук по ходу нервных стволов мощностью 0,8 вт/см кв. в импульсном режиме, 6–10 минут, 10–12 сеансов;
Как на стационарном, так и на амбулаторном этапах лечения ключевым моментом восстановительной терапии служит использование электростимуляции мышц. Электрогимнастика мышц восполняет функциональный дефицит нервной импульсации, улучшая трофику и микроциркуляцию в мышечной ткани и нервных стволах, сохраняя синаптический аппарат денервированной мышцы и предотвращая ее атрофию. Электростимуляция мышц проводится в подпороговом режиме в течение многих месяцев. Важно, однако, не вызвать переутомление мышц, что приводит к нарастанию пареза. В связи с этим сила тока не должна превышать силы, вызывающей пороговые сокращения, получаемые при исследовании (гальванический ток должен применяться не выше 10–15 мА), длительность процедуры 10–15 мин. с отдыхом через 2–3 мин. Параллельно с электростимуляцией целесообразно назначение препаратов, улучшающих трофику мышц — АТФ, рибоксин, цитомак, витамин Е.
Трудотерапия: назначается по мере появления активных движений с учетом характера и степени двигательных расстройств. Профессиональная ориентация проводится с учетом характера двигательного дефекта (при повреждении нервов верхней конечности особое внимание обращают на сохранность функции схвата и удерживания предметов, при поражении нервов нижней конечности — на степень нарушения ходьбы).
Литература: