Преднизолон от астмы
В последние годы отмечен значительный прогресс в лечении бронхиальной астмы (БА). По–видимому, это связано с определением БА, как хронического воспалительного заболевания дыхательных путей, и вследствие этого – с широким применением ингаляционных глюкокортикостероидов (ГКС) в качестве базисных противовоспалительных препаратов. Однако несмотря на достигнутые успехи, уровень контроля над течением заболевания нельзя считать удовлетворительным. Так, например, почти каждый третий больной БА, как минимум, 1 раз в месяц просыпается ночью в связи с симптомами болезни. Более половины больных имеют ограничения физической активности, более трети вынуждены пропускать занятия в школе или отсутствовать на работе. Более 40% больных вынуждены обращаться за неотложной помощью вследствие обострения заболевания. Причины подобной ситуации многообразны, и не последнюю роль в этом играет недостаточная осведомленность врача в патогенезе БА и, соответственно, выбор неправильной тактики лечения.
Определение и классификация БА
Бронхиальная астма – хроническое заболевание дыхательных путей, в котором принимают участие многие клетки: тучные клетки, эозинофилы и Т–лимфоциты. У предрасположенных лиц это воспаление приводит к повторным эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и/или ранним утром. Эти симптомы сопровождаются распространенной, но вариабельной обструкцией бронхиального дерева, которая, по крайней мере, частично обратима, спонтанно или под влиянием лечения. Воспаление также вызывает увеличение ответа дыхательных путей на различные стимулы (гиперреактивность).
Ключевыми положениями определения следует считать следующие:
1. БА – хроническое персистирующее воспалительное заболевание дыхательных путей вне зависимости от тяжести течения.
2. Воспалительный процесс приводит к гиперреактивности бронхов, обструкции и появлению респираторных симптомов.
3. Обструкция дыхательных путей обратима, по крайней мере, частично.
4. Атопия – генетическая предрасположенность к продукции иммуноглобулинов класса Е (может присутствовать не всегда).
Бронхиальную астму можно классифицировать на основе этиологии, тяжести течения и особенностей проявления бронхиальной обструкции.
Однако в настоящее время бронхиальную астму в первую очередь следует классифицировать по степени тяжести, т. к. именно это отражает степень выраженности воспалительного процесса в дыхательных путях и определяет тактику противовоспалительной терапии.
Степень тяжести определяется по следующим показателям:
- Количество ночных симптомов в неделю.
- Количество дневных симптомов в день и в неделю.
- Кратность применения b2–агонистов короткого действия.
- Выраженность нарушений физической активности и сна.
- Значения пиковой скорости выдоха (ПСВ) и ее процентное соотношение с должным или наилучшим значением.
- Суточные колебания ПСВ.
- Объем проводимой терапии.
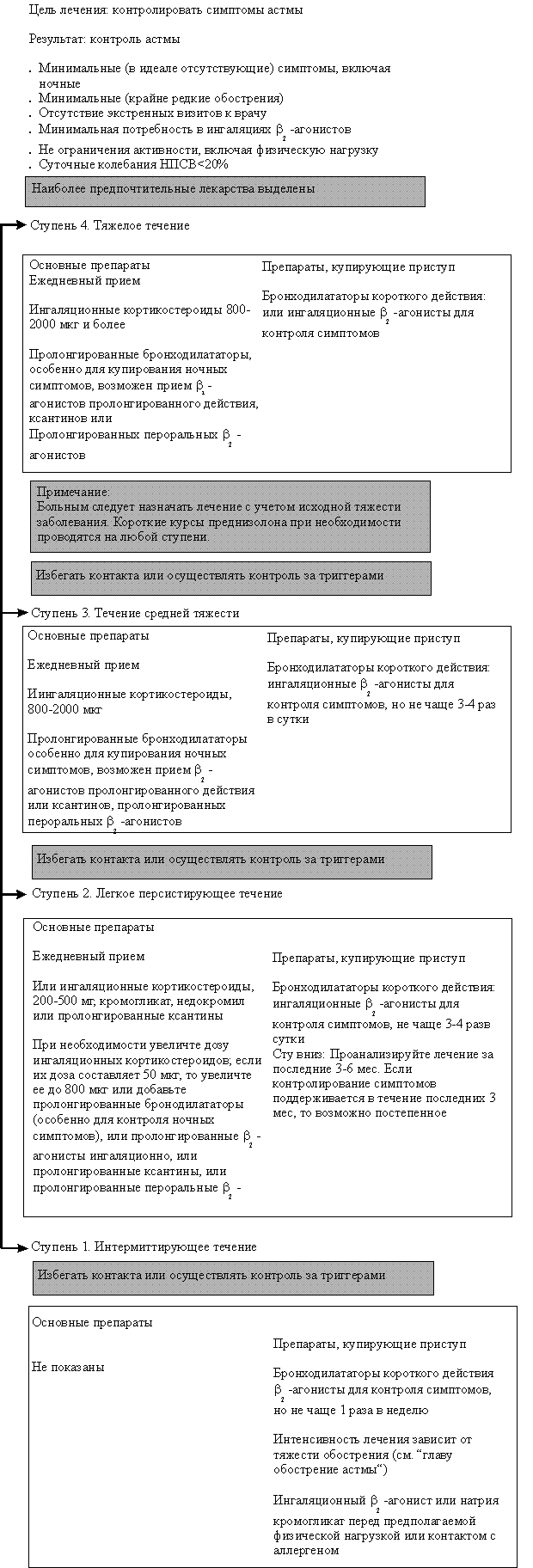
Существует 5 степеней тяжести течения БА: легкая интермиттирующая; легкая персистирующая; средней тяжести персистирующая; тяжелая персистирующая; тяжелая персистирующая стероидозависимая (табл. 1).

БА интермиттирующего течения: симптомы астмы реже 1 раза в неделю; короткие обострения (от нескольких часов до нескольких дней). Ночные симптомы 2 раза в месяц или реже; отсутствие симптомов и нормальная функция легких между обострениями: пиковая скорость выдоха (ПСВ) > 80% от должного и колебания ПСВ менее 20%.
БА легкого персистирующего течения. Симптомы 1 раз в неделю или чаще, но реже 1 раза в день. Обострения заболевания могут нарушать активность и сон. Ночные симптомы возникают чаще 2 раз в месяц. ПСВ более 80% от должного; колебания ПСВ 20–30%.
БА средней тяжести. Ежедневные симптомы. Обострения нарушают активность и сон. Ночные симптомы возникают более 1 раза в неделю. Ежедневный прием b2–агонистов короткого действия. ПСВ 60–80% от должного. Колебания ПСВ более 30%.
БА тяжелого течения: постоянные симптомы, частые обострения, частые ночные симптомы, физическая активность ограничена проявлениями астмы. ПСВ менее 60% от должного; колебания более 30%.
Необходимо отметить, что определение степени тяжести астмы по этим показателям возможно только перед началом лечения. Если больной уже получает необходимую терапию, то ее объем также должен учитываться. Таким образом, если у пациента по клинической картине определяется легкая персистирующая астма, но при этом он получает медикаментозное лечение, соответствующее тяжелой персистирующей астме, то у данного пациента диагностируется БА тяжелого течения.
БА тяжелого течения стероидозависимая: независимо от клинической картины пациент, получающий длительное лечение системными кортикостероидами, должен быть расценен, как страдающий БА тяжелого течения.
Ингаляционные ГКС
Рекомендован ступенчатый подход к терапии БА в зависимости от тяжести ее течения (табл. 1). Все препараты для лечения БА разделены на две основные группы: для длительного контроля воспалительного процесса и средства для купирования острых симптомов астмы. Основой терапии для длительного контроля воспалительного процесса являются ингаляционные глюкокортикостероиды (ИГКС), которые следует применять, начиная со второй ступени (легкое персистирующее течение) до пятой (тяжелое стероидозависимое течение). Поэтому в настоящее время ИГКС рассматриваются в качестве средств первой линии для терапии БА. Чем выше степень тяжести течения БА, тем большие дозы ИГКС следует применять. По данным ряда исследований, у пациентов, начавших лечение ИГКС не позже двух лет от начала заболевания, отмечены существенные преимущества в улучшении контроля над симптомами астмы по сравнению с группой, начавшей лечение ИГКС по прошествии более чем 5 лет от дебюта заболевания.
Механизмы действия и фармакокинетика
ИГКС способны связываться со специфическими рецепторами в цитоплазме, активируют их и образуют с ними комплекс, который затем димеризуется и перемещается в ядро клетки, где связывается с ДНК и взаимодействует с механизмами транскрипции ключевых ферментов, рецепторов и других сложных белков. Это приводит к проявлению фармакологического и терапевтического действия.
Противовоспалительный эффект ИГКС связан с их ингибирующим действием на клетки воспаления и их медиаторы, включая продукцию цитокинов, вмешательство в метаболизм арахидоновой кислоты и синтез лейкотриенов и простагландинов, предотвращение миграции и активации клеток воспаления. ИГКС увеличивают синтез противовоспалительных белков (липокортина–1), увеличивают апоптоз и снижают количество эозинофилов путем ингибирования интерлейкина–5. Таким образом, ИГКС приводят к стабилизации клеточных мембран, уменьшают проницаемость сосудов, улучшают функцию b–рецепторов как путем синтеза новых, так и повышая их чувствительность, стимулируют эпителиальные клетки.
ИГКС отличаются от системных глюкокортикостероидов своими фармакологическими свойствами: липофильностью, быстротой инактивации, коротким периодом полувыведения из плазмы крови. Важно учитывать, что лечение ИГКС является местным (топическим), что обеспечивает выраженные противовоспалительные эффекты непосредственно в бронхиальном дереве при минимальных системных проявлениях. Количество ИГКС, доставляемое в дыхательные пути, зависит от номинальной дозы препарата, типа ингалятора, наличия или отсутствия пропеллента, а также техники выполнения ингаляции. До 80% пациентов испытывают сложности при использовании дозированных аэрозолей.
Наиболее важной характеристикой для проявления селективности и времени задержки препарата в тканях является липофильность. Благодаря липофильности ИГКС накапливаются в дыхательных путях, замедляется их высвобождение из тканей и увеличивается их сродство к глюкокортикоидному рецептору. Высоколипофильные ИГКС быстрее и лучше захватываются из просвета бронхов и длительно задерживаются в тканях дыхательных путей. ИГКС отличает от системных препаратов их топическое (местное) действие. Поэтому бесполезно назначать ингаляции системных ГКС (гидрокортизона, преднизолона и дексаметазона): эти препараты вне зависимости от способа применения обладают только системным действием.
В многочисленных рандомизированных плацебо-контролируемых исследованиях у больных БА показана эффективность всех доз ИГКС в сравнении с плацебо.
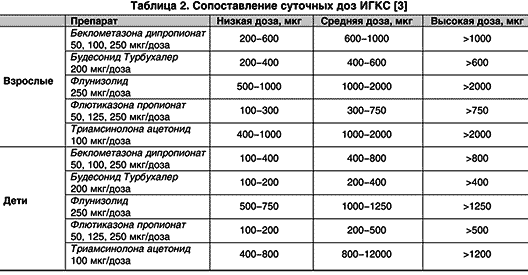
Системная биодоступность складывается из пероральной и ингаляционной. От 20 до 40% от ингалируемой дозы препарата попадает в дыхательные пути (это величина значительно варьирует в зависимости от средства доставки и от ингаляционной техники пациента). Легочная биодоступность зависит от процента попадания препарата в легкие, наличия или отсутствия носителя (лучшие показатели имеют ингаляторы, не содержащие фреон) и от абсорбции препарата в дыхательных путях. 60–80% ингаляционной дозы оседает в ротоглотке и проглатывается, подвергаясь затем полному или частичному метаболизму в желудочно–кишечном тракте и печени. Пероральная доступность зависит от абсорбции в желудочно–кишечном тракте и от выраженности эффекта «первого прохождения» через печень, благодаря чему в системный кровоток поступают уже неактивные метаболиты (за исключением беклометазона 17–монопропионата – активного метаболита беклометазона дипропионата). Дозы ИГКС до 1000 мкг/сутки (для флютиказона до 500 мкг/сут) обладают незначительным системным действием.
Все ИГКС имеют быстрый системный клиренс, сравнимый с величиной печеночного кровотока. Это один из факторов, снижающих системное действие ИГКС.
Характеристика наиболее часто используемых препаратов
К ИГКС относятся беклометазона дипропионат, будесонид, флютиказона пропионат, флунизолид, триамсинолона ацетонид, мометазона фуроат. Они выпускаются в виде дозированных аэрозолей, порошковых ингаляторов, а также в виде растворов для ингаляции через небулайзер (будесонид).
Беклометазона дипропионат. Применяется в клинической практике более 20 лет и остается одним из самых эффективных и часто используемых препаратов. Разрешено применение препарата у беременных. Выпускается в виде дозированного аэрозольного ингалятора (Бекотид 50 мкг, Беклофорте 250 мкг, Альдецин 50 мкг, Беклокорт 50 и 250 мкг, Бекломет 50 и 250 мкг/доза), дозированного ингалятора, активируемого вдохом (Беклазон Легкое Дыхание 100 и 250 мкг/доза), порошкового ингалятора (Бекодиск 100 и 250 мкг/доза ингалятор Дискхалер; мультидозовый ингалятор Изихейлер, Бекломет 200 мкг/доза). Для ингаляторов Бекотид и Беклофорте производятся специальные спейсеры – «Волюматик» (клапанный спейсер большого объема для взрослых) и «Бэбихалер» (2–клапанный спейсер малого объема с силиконовой лицевой маской для детей раннего возраста).
Будесонид. Современный высокоактивный препарат. Используется в виде дозированного аэрозольного ингалятора (Будесонид-мите 50 мкг/доза; Будесонид–форте 200 мкг/доза), порошкового ингалятора (Пульмикорт Турбухалер 200 мкг/доза; Бенакорт Циклохалер 200 мкг/доза) и суспензии для небулайзера (Пульмикорт 0,5 и 0,25 мг/доза). Пульмикорт Турбухалер – единственная лекарственная форма ИГКС, не содержащая носителя. Для дозированных ингаляторов Будесонид мите и Будесонид форте производится спейсер. Будесонид является составной частью комбинированного препарата Симбикорт.
Будесонид имеет наиболее благоприятный терапевтический индекс, что связано с его высоким сродством к глюкокортикоидным рецепторам, и ускоренным метаболизмом после системной абсорбции в легких и кишечнике. Будесонид является единственным ИГКС, для которого доказана возможность однократного применения. Фактор, обеспечивающий эффективность применения будесонида один раз в день, – ретенция будесонида в дыхательных путях в виде внутриклеточного депо благодаря обратимой эстерификации (образованию эфиров жирных кислот). При снижении концентрации свободного будесонида в клетке активируются внутриклеточные липазы, высвобождающийся из эфиров будесонид вновь связывается с рецептором. Подобный механизм не свойственен другим ГКС и позволяет пролонгировать противовоспалительный эффект. В ряде исследований показано, что внутриклеточное депонирование может оказаться более важным в плане активности препарата, чем сродство к рецептору.
Исследования последних лет по препарату Пульмикорт Турбухалер доказали, что он не влияет на конечный рост при длительном применении у детей, на минерализацию кости, не вызывает ангиопатию и катаракту. Пульмикорт также рекомендован к применению у беременных: установлено, что его применение не вызывает увеличения числа аномалий плода. Пульмикорт Турбухалер является первым и единственным ИГКС, которому FDA (организация по контролю за лекарственными средствами в США) присвоила категорию «В» в рейтинге лекарств, назначаемых при беременности. В эту категорию включаются лекарства, прием которых в период беременности является безопасным. Остальные ИГКС относятся к категории «С» (прием их во время беременности не рекомендуется).
Флютиказона пропионат. Самый высокоактивный препарат на сегодняшний день. Обладает минимальной пероральной биодоступностью (<1%). Эквивалентные терапевтические дозы флютиказона почти в два раза меньше, чем у беклометазона и будесонида в аэрозольном ингаляторе и сопоставимы с дозами будесонида в Турбухалере (табл. 2). По данным ряда исследований, флютиказона пропионат больше угнетает надпочечники, но в эквивалентных дозах имеет сходную с другими ИГКС активность в отношении надпочечников.
Представлен в виде дозированного аэрозольного ингалятора (Фликсотид 50, 125 и 250 мкг/доза) и порошкового ингалятора (Фликсотид Дискхалер – ротадиски 50, 100, 250 и 500 мкг/доза; Фликсотид Мультидиск 250 мкг/доза). Для аэрозольных ингаляторов производятся специальные спейсеры – «Волюматик» (клапанный спейсер большого объема для взрослых) и «Бэбихалер» (2–клапанный спейсер малого объема с силиконовой лицевой маской для детей раннего возраста). Флютиказон является составной частью комбинированного препарата Серетид Мультидиск.
Флунизолид. Препарат с низкой глюкокортикоидной активностью. На отечественном рынке представлен торговой маркой Ингакорт (дозированный ингалятор 250 мкг/доза, со спейсером). Несмотря на высокие терапевтические дозы, практически не имеет системных эффектов в связи с тем, что уже при первом прохождении через печень на 95% превращается в неактивное вещество. В настоящее время в клинической практике используется достаточно редко.
Триамсинолона ацетонид. Препарат с низкой гормональной активностью. Дозированный ингалятор 100 мкг/доза. Торговая марка Азмакорт, на российском рынке не представлен.
Мометазона фуроат. Препарат с высокой глюкокортикоидной активностью. На российском рынке представлен только в виде назального спрея Назонекс.
Клинические испытания, сравнивавшие эффективность ИГКС в виде улучшения симптомов и показателей функции внешнего дыхания, показывают, что:
- Будесонид и беклометазона дипропионат в аэрозольных ингаляторах при одинаковых дозах практически не отличаются по эффективности.
- Флютиказона пропионат обеспечивает такое же действие, как удвоенная доза беклометазона или будесонида в дозированном аэрозоле.
- Будесонид, применяемый через Турбухалер, оказывает такое же действие, как удвоенная доза будесонида в дозированном аэрозоле.
Нежелательные эффекты
Современные ИГКС относятся к препаратам с высоким терапевтическим индексом и имеют высокий профиль безопасности даже при длительном применении. Выделяют системные и местные нежелательные эффекты. Системные нежелательные эффекты могут стать клинически значимыми только при использовании высоких доз. Они зависят от сродства препаратов к рецептору, липофильности, объема распределения, периода полувыведения, биодоступности и других факторов. Риск возникновения системных нежелательных для всех имеющихся в настоящее время ИГКС коррелирует с желательными эффектами в дыхательных путях. Применение ИГКС в среднетерапевтических дозах снижает риск возникновения системных эффектов.
В основном побочные эффекты ИГКС связаны с их путем применения и сводятся к кандидозу полости рта, осиплости голоса, раздражению слизистой и кашлю. Чтобы избежать этих явлений, необходима правильная техника ингаляции и индивидуальный подбор ИГКС.
Комбинированные препараты
Несмотря на то, что ИГКС являются основой терапии БА, они не всегда позволяют полностью контролировать воспалительный процесс в бронхиальном дереве и, соответственно, проявления БА. В связи с этим возникала необходимость в назначении b2–агонистов короткого действия по потребности или регулярно. Таким образом появилась острая потребность в новом классе препаратов, свободных от недостатков, которые присущи b2–агонистам короткого действия, и обладающих доказанным длительным протективным и противовоспалительным действием на дыхательные пути.
Были созданы и в настоящее время широко применяются b2–агонисты длительного действия, которые на фармацевтическом рынке представлены двумя препаратами: формотерола фумаратом и сальметерола ксинафоатом. В современных руководствах по терапии астмы рекомендовано добавление b2–агонистов длительного действия при недостаточном контроле БА монотерапией ингаляционными ГКС (начиная со второй ступени). В ряде исследований было показано, что комбинация ингаляционного ГКС с b2–агонистом длительного действия более эффективна, чем удвоение дозы ингаляционных ГКС, и приводит к более значимому улучшению функции легких и лучшему контролю над симптомами астмы. Было показано также снижение количества обострений и значимое улучшение качества жизни у пациентов, получающих комбинированную терапию. Таким образом, появление комбинированных препаратов, содержащих ингаляционный ГКС и b2–агонист длительного действия, – отражение эволюции взглядов на терапию БА.
Главным преимуществом комбинированной терапии является повышение эффективности лечения при использовании более низких доз ИГКС. Кроме того, соединение двух препаратов в одном ингаляторе облегчает пациенту выполнение назначений врача и потенциально улучшает комплайнс.
Серетид Мультидиск. Составными компонентами являются сальметерола ксинафоат и флютиказона пропионат. Обеспечивает высокий уровень контроля над симптомами БА. Используется только в качестве базисной терапии, может назначаться, начиная со второй ступени. Препарат представлен в различных дозировках: 50/100, 50/250, 50/500 мкг сальметерола/флютиказона в 1 дозе. Мультидиск относится к ингаляционным устройствам малого сопротивления, что позволяет использовать его и у пациентов со сниженной скоростью вдоха.
Симбикорт Турбухалер. Составными компонентами являются будесонид и формотерола фумарат. На российском рынке представлен в дозировке 160/4,5 мкг в 1 дозе (дозы препаратов указаны как доза на выходе). Важная особенность Симбикорта – возможность использовать его как для базисной терапии (для контроля воспалительного процесса), так и для немедленного облегчения симптомов астмы. Это обусловлено прежде всего свойствами формотерола (быстрое начало действия) и способностью будесонида активно действовать в течение 24 часов на слизистую бронхиального дерева.
Симбикорт дает возможность индивидуального гибкого дозирования (1–4 ингаляционные дозы в сутки). Симбикорт можно использовать, начиная со 2 ступени, но особенно он показан пациентам с нестабильной астмой, для которой характерны внезапные тяжелые приступы затрудненного дыхания.
Системные ГКС
Системные ГКС применяются в основном для купирования обострения БА. Наиболее эффективны пероральные ГКС. Внутривенно кортикостероиды назначают при обострении БА, если более желателен внутривенный доступ, или при нарушении всасывания из желудочно–кишечного тракта, используя высокие дозы (до 1 г преднизолона, метилпреднизолона и гидрокортизона). Кортикостероиды приводят к клинически значимому улучшению спустя 4 часа после их введения.
При обострении БА показан короткий курс пероральных ГКС (7–14 дней), причем начинают с высоких доз (30–60 мг преднизолона). В последних публикациях рекомендуют следующий короткий курс системных ГКС при не угрожающих жизни обострениях: 6 таблеток преднизолона утром (30 мг) в течение 10 дней с последующим прекращением приема. Хотя схемы лечения системными ГКС могут быть различными, основополагающими принципами являются назначение их в высоких дозах для быстрого достижения эффекта и последующая быстрая отмена. Следует помнить, что как только пациент оказывается готовым к приему ингаляционных ГКС, они должны быть ему назначены с соблюдением ступенчатого подхода.
Системные глюкокортикоиды следует назначить, если:
- Обострение средней тяжести или тяжелое.
- Назначение ингаляционных b2–агонистов короткого действия в начале лечения к улучшению не привело.
- Обострение развилось, несмотря на то, что больной находился на длительном лечении пероральными кортикостероидами.
- Для купирования предыдущих обострений требовались пероральные кортикостероиды.
- 3 и более раз в год проводились курсы глюкокортикоидов.
- Больной находится на ИВЛ.
- Ранее были угрожающие жизни обострения.
Нежелательно использование пролонгированных форм системных стероидов для купирования обострений и проведения поддерживающей терапии БА.
Для длительной терапии при тяжелом течении БА системные ГКС (метилпреднизолон, преднизолон, триамсинолон, бетаметазон) следует назначать в наименьшей эффективной дозе. При длительном лечении альтернирующая схема назначения и прием в первой половине дня (для уменьшения влияния на циркадные ритмы секреции кортизола) вызывают наименьшее количество побочных эффектов. Следует подчеркнуть, что во всех случаях назначения системных стероидов больному должны быть назначены высокие дозы ингаляционных ГКС. Из пероральных ГКС предпочтение отдается тем, у которых отмечается минимальная минералокортикоидная активность, относительно короткий период полураспада и ограниченное действие на поперечно–полосатую мускулатуру (преднизолон, метилпреднизолон).
Стероидозависимость
Пациентам, которые вынуждены постоянно принимать системные ГКС, следует уделять особое внимание. Существует несколько вариантов формирования стероидозависимости у пациентов с БА и другими заболеваниями, сопровождающимися бронхообструкцией:
- Отсутствие комплайенса (взаимодействия) врача и пациента.
- Неназначение ингаляционных ГКС пациентам. Многие врачи считают, что нет необходимости назначать ингаляционные ГКС больным, получающим системные стероиды. Если пациент с БА получает системные стероиды, его следует расценивать, как больного с тяжелой формой БА, имеющего прямые показания к назначению высоких доз ингаляционных ГКС.
- У больных системными заболеваниями (включая легочные васкулиты, например, синдром Чардж–Стросса) бронхиальная обструкция может быть расценена, как БА. Отмена системных стероидов у этих больных может сопровождаться тяжелыми проявлениями системного заболевания.
- В 5% случаев встречается стероидорезистентность, для которой характерна резистентность стероидных рецепторов к стероидным препаратам. В настоящее время различают две подгруппы: больные с истинной стероидной резистентностью (тип II), не имеющие побочных эффектов при длительном приеме высоких доз системных ГКС, и пациенты с приобретенной резистентностью (тип I) – имеющие побочные эффекты системных ГКС. В последней подгруппе резистентность можно преодолеть, скорее всего, повышением дозы ГКС и назначением препаратов, имеющих аддитивный эффект.
Необходима разработка диагностических программ для пациентов, которые получают адекватную терапию, чувствительны к кортикостероидам, имеют высокий комплайнс, но несмотря на все это, испытывают симптомы астмы. Эти пациенты являются самыми «непонятными» с точки зрения терапии и с точки зрения патофизиологии. У них следует проводить тщательную дифференциальную диагностику для исключения других заболеваний, имитирующих клиническую картину БА.
1. Бронхиальная астма. Глобальная стратегия: совместный доклад Национального института Сердце, Легкие, Кровь и Всемирной организации здравоохранения. Пульмонология, 1996.
2. Бронхиальная астма. Руководство для врачей России (формулярная система). «Пульмонология», приложение–99.
3. Ведущие направления в диагностике и лечении бронхиальной астмы. Основные положения отчета группы экспертов EPR–2. National Institute of Health. National Heart, Lung and Blood Institute. NIH publication–97. Перевод под ред. Проф. Цой А.Н., М, Грантъ,1998.
5. Огородова Л.М. Системы ингаляционной доставки препаратов в дыхательные пути. Пульмонология, 1999; №1, 84–87
6. Формулярная система: лечение бронхиальной астмы. Астма. ru ,0. 2001, 6–9
7. Чучалин А.Г. Бронхиальная астма. Москва, 1997.
8. Цой А.Н. Ингаляционные глюкокортикоиды: эффективность и безопасность. РМЖ 2001; 9: 182–185
9. Цой А.Н. Сравнительная фармакокинетика ингаляционных глюкокортикоидов. Аллергология 1999; 3: 25–33
12. Barnes P.J. Inhaled glucocorticoides for asthma. N. Engl. Med. 1995; 332: 868–75
13. Beclomethasone Dipropionate and Budesonide. The clinical evidence Reviewed. Respir Med 1998; 92 (Suppl B)
14. The British Guidelines on Asthma Management. Thorax, 1997; 52 (Suppl. 1) 1–20.
16. Crisholm S et al. Once–daily budesonide in mild asthma. Respir Med 1998; 421–5
21. Pauwels RA et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma. N Engl J Med 1997; 337: 1405–11
Согласно рекомендациям современных руководств по бронхиальной астме (БА), основной группой препаратов, использующихся для превентивного лечения больных БА (за исключением легкой/интермиттирующей формы заболевания), являются ингаляционные глюкокортикоиды (ИГК) . Первый из них — беклометазона дипропионат был внедрен в клиническую практику в 1972 г. и до сих пор находит широкое применение благодаря низкой стоимости и безопасности.
В настоящее время в лечении БА используют еще четыре препарата из группы ИГК: флютиказона пропионат, будесонид, триамцинолона ацетонид, флунизолид.
Несмотря на довольно длительную историю клинического применения глюкокортикоидов (ГК), терапия БА по-прежнему вызывает немало вопросов, в том числе:
- когда и в какой дозе следует назначать ИГК больным БА;
- как долго их принимать;
- как снизить риск развития побочных эффектов ГК-терапии;
- что такое стероидная резистентность (стероидная нечувствительность) и каковы механизмы ее развития?
В настоящем обзоре мы попытаемся провести анализ литературных данных и основных рекомендаций по назначению ГК больным БА.
В начале коротко о том, каковы современные представления о механизмах действия ГК при БА. Доказано, что ГК влияют на иммунные и воспалительные процессы дыхательных путей посредством индукции экспрессии различных генов. ГК также снижают количество и/или активность клеток воспаления (лимфоцитов, макрофагов, тучных клеток, эозинофилов), влияют на сосудистую проницаемость, отек слизистой оболочки, субэпителиальный фиброз, уменьшают продукцию слизи в бронхах, способствуют восстановлению поврежденного эпителия и т. д.
Маловероятно, чтобы при остром приступе БА эффект ГК был связан с супрессией образовавшихся цитокинов и клеток воспаления, инфильтрирующих дыхательные пути, поскольку для проявления таких механизмов действия требуется как минимум 6–72 ч . Скорее всего, высокая терапевтическая эффективность стероидов связана с восстановлением чувствительности β-адренорецепторов дыхательных путей, количество которых снижается в результате приема β2-агонистов и развития самого процесса воспаления . Показано, что однократное введение преднизолона в/в и даже ингалирование беклометазона предотвращает десенситизацию β2-адренорецепторов , хотя следует учесть также протективный эффект самих β-агонистов на тучные клетки и плазменную экссудацию сосудов .
Комплементарность действия при комбинации ГК и b2-агонистов доказана на экспериментальном («эффект Эйкелберга»: β2-агонисты активируют глюкокортикоидные рецепторы, а стероиды повышают экспрессию гена β2-адренорецептора) , а также клиническом уровнях (при приеме комбинированного препарата симбикорта отмечено более быстрое наступление бронходилатации и улучшение шкалы симптомов БА, по сравнению с терапией будесонидом и формотеролом через отдельные ингаляторы) .
Содержание
Показания к назначению ГК при бронхиальной астме
Назначение ГК показано в тех случаях, когда пациент испытывает потребность в ингаляционном β2-агонисте короткого действия один раз в день (Британское руководство по БА) или 3 раза в нед (GINA) . Терапию целесообразнее начинать с высоких доз ИГК, чтобы достичь адекватного контроля над астмой (минимум приступов, снижение тяжести заболевания, достижение нормальных/почти нормальных показателей функции легких с минимумом побочных эффектов лекарственных средств), с последующим снижением их дозы (принцип «step down») .
Доказано, что раннее начало лечения ГК более эффективно предотвращает развитие воспалительного процесса и структурных изменений дыхательных путей, особенно у детей . При приеме даже малых доз будесонида (100 мкг 2 раза в сут) у детей заметно улучшались показатели пикфлоуметрии, клиническая симптоматика, снижалась потребность в β-агонистах короткого действия, хотя для предотвращения постнагрузочного бронхоспазма им требовалась более высокая доза ИГК (400 мкг в сут) . По последним данным, флютиказон способен приостанавливать воспалительный процесс, но при этом не влияет на структурные изменения дыхательных путей, т. е. на ремоделирование .
Важную роль при тяжелой форме БА играют не только подбор адекватной дозы необходимых антиастматических средств, но и правильное назначение системных ГК.
Назначение ГК per os показано:
- пациентам с частыми неконтролируемыми симптомами и обострениями БА;
- больным с интермиттирующей БА, не контролируемой приемом высоких доз ИГК;
- больным, ранее принимавшим таблетированный ГК, которым для поддержания контроля над астмой или терапии;
- обострения заболевания требуется более высокая доза стероида .
Больным БА преднизолон следует назначать из расчета 1–2 мг/кг веса в сут сроком не более 10 дней, с постепенным снижением суточной дозы на фоне приема ИГК .
По мнению американских экспертов (EPR-2), пероральный преднизолон в дозе 50 мг целесообразно назначать взрослым больным БА однократно в течение 15 ч: тем самым количество эозинофилов в бронхолегочной лаважной жидкости супрессируется более эффективно, чем при приеме препарата в другие часы (в 8 или 20 ч) .
При купировании тяжелого приступа БА доказана эквивалентность терапевтического действия ГК, назначаемых больным в/в и перорально . Установлено, кроме того, что различий в изменении ОФВ1 у больных с острым тяжелым приступом БА, которым вводили метилпреднизолон в/в в дозах 60, 160 и 500 мг в сут, не существует; не удалось выявить также влияния на уровень ОФВ1 низких и высоких доз преднизолона (1 и 6 мг/кг веса), вводимых в/в каждые 6 ч больным БА, поступившим в отделение неотложной медицины .
По данным Nana и соавт. , через 1 нед после лечения тяжелых астматиков ингаляционным будесонидом в дозе 1600 мкг 2 раза в день (I группа) и таблетированным преднизолоном 40 мг (II группа) уровень ОФВ1 повысился в обеих группах в одинаковой степени — в среднем на 17%. Однако в группе пациентов, которым ГК назначали перорально, обострения болезни наблюдались в два раза чаще. В то же время лечение больного БА таблетированным преднизолоном обходится в 70 раз дешевле терапии таким современным ИГК, как флютиказон.
Показана эквивалентность терапевтической эффективности 1600 мкг будесонида и 5 мг таблетированного преднизолона у пациентов с БА .
Хотя при БА может быть достигнут доза-ответ на лечение ИГК, наращивание дозы стероида, как правило, не приводит к дальнейшему улучшению функции легких . Более того, парадоксальным кажется полученное доказательство равной эффективности высоких и низких доз флютиказона (1000 и 100 мкг в сут) при 8-недельном лечении больных со впервые диагностированной легкой и средней степенью БА . Тяжелая форма БА, как правило, требует применения высоких доз ИГК с самого начала терапии .
Недопустимо использование в лечении больных БА депонированных ГК (дексаметазон, кеналог, полькортолон) из-за вызываемой ими выраженной супрессии надпочечниковой функции и невозможности назначения этих препаратов по альтернирующей схеме.
В англоязычной литературе последних лет появился термин «brittle asthma», при которой более выраженный, по сравнению с применением ГК, терапевтический эффект отмечается после подкожного введения таким больным тербуталина .
Продолжительность приема ГК
У больных БА такие проявления, как кашель, свистящее и затрудненное дыхание, уменьшаются через несколько дней после приема ИГК ; значительное облегчение течения заболевания наблюдается спустя недели , но для максимального улучшения бронхиальной гиперреактивности ИГК требуется принимать регулярно на протяжении нескольких месяцев и лет .
У большинства пациентов с БА снижение дозы ИГК через несколько месяцев терапии, как правило, не приводит к ухудшению течения заболевания . Однако уже спустя несколько недель после полной отмены ИГК могут появиться симптомы неконтролируемой БА . Поскольку улучшение бронхиальной гиперреактивности может быть достигнуто примерно через 6–8 нед после начала приема беклометазона (в суточной дозе 400–2000 мкг), чтобы избежать возникновения побочных эффектов, дозу ИГК в дальнейшем следует снижать .
Стероид-резистентность
Стероид-резистентная астма (СРА) — это астма, при которой после 1–2-недельного приема преднизолона в дозе
40 мг в сут объем форсированного выдоха за 1 сек (ОФВ1) не повышается более чем на 15% в ответ на вдыхание β2-агониста .
Как правило, СРА страдают пациенты с тяжелой формой заболевания. Этиопатогенез СРА обусловлен различными факторами: снижение количества глюкокортикоидных рецепторов дыхательных путей и/или повышение концентрации альтернативной им формы типа β, изменение супрессии транскрипционных факторов, преобладание относительно резистентных к ГК нейтрофилов в бронхиальном пространстве, резко выраженные структурные изменения дыхательных путей и т. д. . Возможно, играет также роль инфицирование таких больных Chlamidia pneumoniae или вирусами .
Прежде чем БА считать стероид-резистентной, следует:
- выяснить, действительно ли больной страдает БА (исследовать функцию легких, определить индекс Тиффно);
- определить коэффициент бронходилатации после вдыхания 200 мкг сальбутамола;
- оценить результаты бронхопровокационного теста метахолином или гистамином;
- оценить правильность вдыхания ингаляционных препаратов, комплаентность (другие факторы);
- оценить данные бронхоскопии (характер пролабирования голосовых связок, уровень эозинофилов в бронхоальвеолярной лаважной жидкости, данные цитологии, биопсии для уточнения толщины базальной мембраны и исключения эндобронхиальной опухоли);
- оценить эффективность терапии преднизолоном в дозе 0,5 мг/кг веса больного в течение 2 нед с повторным исследованием функции внешнего дыхания, бронхиальной гиперчувствительности и комплаентности;
- исключить другие заболевания (исследование сна по выявлению индекса частоты апноэ и гипопноэ, 24-часовой рН-мониторинг, гипервентиляционный тест, психологическое тестирование и т. д.) .
Альтернатива глюкокостероидной терапии
На фоне приема ряда препаратов возможно снижение дозы системных и ингаляционных форм ГК. Не доказан стероидсберегающий эффект кромонов и кетотифена.
Назначение ингаляционных глюкокортикоидов довольно часто (~78%) позволяет уменьшить дозу системных стероидов и даже полностью отменить их прием. Исследование Meijer et al. показало, что высокая доза флютиказона более эффективна в отношении улучшения бронхиальной гиперчувствительности, чем преднизолон, принимаемый перорально . Стероидсберегающий эффект пульмикорта-турбухалера был подтвержден в ходе проведенного нами исследования : у детей, находящихся в отделение интенсивной терапии, более ранний клинический и бронходилатирующий эффект (в течение первых 4 ч) был выявлен в случае использования будесонида в дозе 1600 мкг и тербуталина, по сравнению с группой больных, получавших лечение таблетированным преднизолоном в дозе 2 мг/кг веса и β2-агонистом.
У больных СРА уменьшение дозы или полное прекращение приема пероральных ГК становится возможным также благодаря назначению суспензии пульмикорта, вдыхаемого через небулайзер. Небулизированный пульмикорт — уникальный стероид, влияющий на функциональные показатели легких значительно быстрее других ГК, вводимых парентерально или перорально . В многоцентровом исследовании T. Higgenbottam и соавт. у 23 больных из 43 после 12 нед терапии небулизированным пульмикортом в дозе 2 мг в сут удалось снизить дозу таблетированного преднизолона на 59% от исходной дозы (p < 0,0001), что не сопровождалось ухудшением спирометрических показателей легких .
Снижение доз ИГК возможно также при их сочетании с длительно действующими β2-агонистами (формотерол, сальметерол) и теофиллином , антилейкотриеновыми препаратами (монтелукаст, зафирлукаст) , а кроме того, с некоторыми иммуномодуляторами .
Особую осторожность следует соблюдать при переводе тяжелых астматиков с системных ГК на ИГК, особенно если эти пациенты ранее длительно получали пероральный или депонированный стероид. Обострение БА у таких больных, а также стрессовые ситуации (оперативное вмешательство, инфекции, травмы и т. д.) являются показаниями к назначению им повторного курса системных ГК.
Модификаторы лейкотриенов обладают противовоспалительным действием. Доказано отсутствие ингибирующего влияния ГК (в частности, флютиказона и перорального преднизолона) на продукцию лейкотриенов у больных БА . Более выраженное снижение уровня эозинофилов и смягчение симптоматики у астматиков было достигнуто при лечении комбинацией монтелукаста и беклометазона . Считается, что ингибиторы лейкотриенов, в отличие от ГК, способны влиять на мышечную гипертрофию у больных БА.
В ряде случаев у пациентов с тяжелой формой БА ухудшение состояния после полной отмены ГК на фоне приема антилейкотриеновых препаратов может быть связано с наличием у них ранее недиагностированного синдрома Чардж–Стросса.
Клиническую эффективность ингибиторов лейкотриеновой активности при тяжелой форме БА еще предстоит определить.
β2-агонисты пролонгированного действия рекомендуют назначать в сочетании с ИГК больным со средней и тяжелой формами БА, у которых заболевание не поддается контролю низкими дозами стероидов. Чаще всего такой подход оказывается более эффективным, чем повышение (удвоение) дозы ИГК . В исследовании M. Aubier и соавт. лечение больных СРА комбинированным препаратом cеретидом (сальметерол/флютиказон 50/500 мкг) позволило лучше контролировать течение БА, по сравнению с больными, ингалировавшими только флютиказон в дозе 1000 мкг в сут .
Теофиллин пролонгированного действия обладает меньшей бронходилатирующей способностью, чем β2-агонисты, но превосходит их по иммуномодулирующему и противовоспалительному действию. Так, у больных с тяжелой формой БА, принимавших высокие дозы ИГК, препараты теофиллина в концентрации ниже терапевтической (< 10 мг/л) значительно улучшают функциональные показатели легких и снижают содержание CD4+, CD8+ клеток в слизистой оболочке бронхов . Показано, что добавление теофиллина к средним дозам будесонида способствует достижению лучшего контроля над астмой, чем удвоение дозы ИГК (до 1600 мкг в сут) .
Иммунологический подход к терапии стероидрезистентной БА
В последние годы разработан целый ряд новых препаратов, способных влиять на иммунологические механизмы развития БА. Такой подход к терапии БА включает попытку воздействия на активацию Т-клеток, баланс Th-популяции с целью превенции или ингибирования экспрессии цитокинов, производных Th2-лимфоцитов, и блокирования эффекта этих цитокинов на синтез IgE и активность эозинофилов .
Остановимся на некоторых результатах иммунологического подхода к терапии тяжелой формы БА.
Не доказана терапевтическая эффективность некоторых цитокинов, особенно у больных тяжелой формой БА: IFNg, анти-CD4-моноклональных антител и анти-IL-5-моноклональных антител . Эффективность рекомбинантных человеческих анти-IgE-антител — rhuMAb-E25 препарата (xolair, omalizumab) была выше в группе пациентов со средней и тяжелой формами БА, у которых на его фоне удавалось значительно снизить дозу ГК . Интересно отметить, что после анти-IgE-терапии у таких больных не было выявлено улучшения функциональных показателей легких и порога бронхиальной гиперреактивности, несмотря на клинически позитивную динамику течения БА .
Лишь один представитель ингибиторов активности Тh2-клеток — суплатаст тозилат — уже прошел клинические испытания в Японии, в том числе у больных СРА . Как селективный Th2-ингибитор, он оказывает супрессирующее действие на уровень IL-4 и IL-5, за счет чего у больных снижается уровень эозинофилов в бронхах и уменьшается бронхиальная гиперчувствительность. В исследовании Tamaoki и соавт. проводилась оценка терапевтической эффективности суплатаста тозилата в дозе 100 мг три раза в сут per os у 85 больных со средней и тяжелой формами БА, принимавших беклометазон в дозе более 1500 мкг в сут . Через 4 нед после приема препарата у таких пациентов удавалось вдвое снизить дозу ИГК и улучшить функциональные показатели легких; отмечено также значительное уменьшение уровней эозинофильного катионного протеина и общего IgE в сыворотке крови.
Возможность снижения дозы пероральных ГК на фоне иммуносупрессирующих препаратов (метотрексат, циклоспорин А, золото) показанa во многих исследованиях, но широкого применения в клинической практике они не нашли из-за высокой токсичности и большого количества побочных явлений . На фоне иммуносупрессантов действительно удается снизить дозу пероральных ГК, однако противовоспалительный эффект этих препаратов не был связан с торможением активности клеток воспаления или изменением бронхиальной гиперреактивности. Прием метотрексата позволяет снизить дозу таблетированного преднизолона у взрослых больных СРА на 35%, а у детей — на 50% по сравнению с плацебо , однако для проявления стероидсберегающего эффекта метотрексат следует принимать не менее 3 мес.
Другой иммуносупрессант — тролеандомицин эффективен только в сочетании с метилпреднизолоном (но не преднизолоном), однако он также не влияет на бронхиальную гиперчувствительность у больных БА .
Небулизированный лигнокаин, внутривенный иммуноглобулин использовались в лечении больных СРА, однако для доказательства их безопасности и эффективности необходимо проведение дальнейших плацебоконтролируемых исследований .
Макролиды стали назначать больным БА после того, как в некоторых исследованиях была подтверждена роль инфицирования Cl. pneumoniae в патогенезе тяжелой формы астмы. Считается, что течение заболевания у таких больных характеризуется плохим ответом на бронходилатирующую терапию и эпизодами тяжелых обострений астмы, несмотря на прием ГК. Hahn и соавт. описали клинические случаи стероидрезистентного течения БА у трех больных в возрасте от 13 до 65 лет, инфицированных Cl. pneumoniae, что подтверждалось серологическими тестами (повышением титра IgM- или IgG-антител к антигенам хламидий) . Включение в терапевтический комплекс макролидов — азитромицина в дозе 1000 мг 1 раз в нед или кларитромицина 500 мг два раза в день в течение 6–16 нед — позволило полностью отменить терапию ГК у этих больных и стабилизировать течение болезни на длительный период.
Генная терапия — трансфер глюкокортикоидных рецепторов эпителиальных клеток — может, по всей вероятности, привести к супрессии транскрипционных факторов, опосредующих экспрессию генов, и тем самым повысить эффективность ГК-терапии .
Снижение риска побочных эффектов ГК
Считается, что лечение детей беклометазоном в суточной дозе ё 400 мкг, а взрослых — в дозе ё 800 мкг не приводит к возникновению побочных явлений .
Несомненно, риск развития побочных эффектов системных и ингаляционных форм ГК в значительной степени снижается за счет того, что с самого начала они применяются в невысоких дозах, чего нередко удается достичь, назначая ГК в сочетании с препаратами, обладающими другими механизмами действия (пролонгированные бронходилататоры, ингибиторы лейкотриенов).
Длительное лечение таблетированным преднизолоном сопровождается такими побочными явлениями, как увеличение веса, атрофия кожи, остеопороз, катаракта, адреналовая супрессия, острый психоз.
ГК в ингаляционной форме также могут оказывать системный эффект через прямую абсорбцию из легких (например, флютиказон и будесонид), ротоглотки и желудочно-кишечного тракта (беклометазон). Описаны также случаи развития синдрома Иценко–Кушинга в результате терапии больных БА ИГК .
Не следует также забывать о том, что существует непереносимость самих ГК-препаратов: описаны случаи развития у больных БА аллергических реакций после парентерального введения им преднизолона гидрохлорида, дексаметазона фосфата.
Считается, что у больных аспириновой формой БА возможно развитие перекрестной реакции ацетилсалициловой кислоты и гидрокортизона ацетата.
Местные побочные эффекты ИГК — кандидоз ротоглотки, рефлекторный кашель и бронхоспазм — в значительной степени можно уменьшить за счет использования спейсеров, полоскания полости рта после ингаляции, а также уменьшения кратности приема препарата.
Применение ГК в педиатрии
В новом документе Британской торакальной ассоциации для долговременного лечения детей с БА в возрасте до 5 лет рекомендуют использовать сочетание кромогликата натрия и ИГК .
Аналогичная рекомендация дана экспертами Национального института заболеваний сердца, легких и крови во втором переработанном проекте по лечению БА .
В Российской национальной программе по БА у детей (1997 г.) повторяются рекомендации Третьего международного педиатрического согласительного документа, касающиеся применения «шаговой терапии» по принципу «ступень вверх»: при недостаточном эффекте кромогликата натрия в течение 6 нед детям показано назначение ИГК .
Применение ГК у беременных с БА
Пульмикорт-турбухалер (будесонид) является оригинальным препаратом, обладающим присущими только ему важными фармако-клиническими характеристиками. О высокой безопасности профиля препарата свидетельствует тот факт, что Американский колледж аллергии, астмы и иммунологии (ACAAI), а также Американский колледж акушеров и гинекологов (ACOG) рекомендуют назначать пульмикорт-турбухалер с целью терапии БА у беременных женщин . По ретроспективным данным шведских авторов, не выявлено тератогенного эффекта препарата у 2438 новорожденных детей, чьи мамы во время беременности принимали различные дозы пульмикорта .
Согласно заключению экспертов Национального института заболеваний сердца, легких и крови США, обоснованным считается продолжение использования при беременности и других препаратов (беклометазон, флютиказон, будесонид), если они позволяли эффективно контролировать течение БА до беременности; применение системных или ИГК не является противопоказанием к грудному вскармливанию .
По вопросам литературы обращайтесь в редакцию.
Д. Ш. Мачарадзе, доктор медицинских наук
Детская городская поликлиника № 102, Москва
Гормоны коры надпочечников играют важную роль в жизни человека и животных. Острая недостаточность надпочечников сопровождается гемоконцентрацией, снижением артериального давления, нарушениями со стороны пищеварительного тракта, астенией, понижением температуры тела и нарушением основного обмена; наблюдаются также потеря натрия и задержка калия в организме, гипогликемия, задержка в крови азотистых веществ. Введение животным после адреналэктомии кортикостероидов (особенно при одновременном введении натрия хлорида и воды) приводит к исчезновению патологических явлений, позволяет сохранить жизнь. Они активно влияют на углеводный и белковый обмен, способствуют накоплению гликогена в печени, повышают содержание глюкозы в крови и способствуют выделению азота с мочой; вызывают эозино-, лимфо- и нейтропению.

Глюкокортикостероиды обладают противовоспалительным, десенсибилизирующим и противоаллергическим эффектом, оказывают иммунодепрессивное, противошоковое и антитоксическое действие. Иммунодепрессивные свойства обусловлены подавлением иммуногенеза на разных этапах: воздействие на стволовые клетки костного мозга, миграцию В-лимфоцитов и взаимодействие Т- и В-лимфоцитов.
Глюкокортикостероиды тормозят высвобождение цитокинов (интерлейкинов 1 и 2 и g-интерферона) из лимфоцитов и макрофагов, угнетают высвобождение эозинофильными гранулоцитами медиаторов воспаления, замедляют метаболизм арахидоновой кислоты. Стимулируя стероидные рецепторы, они индуцируют образование белков липокортинов, обладающих противоотечной активностью.
Глюкокортикостероиды в относительно высоких дозах тормозят пролиферацию лимфоидной, соединительной и ретикулоэндотелиальной ткани; уменьшают количество тучных клеток, образующих гиалуроновую кислоту; подавляют активность гиалуронидазы и способствуют уменьшению проницаемости капилляров. Под влиянием глюкокортикостероидов замедляется синтез и ускоряется катаболизм белков .
После проникновения в ткани глюкокортикоиды диффундируют или транспортируются через клеточные мембраны и связываются с цитоплазматическим комплексом, состоящим из глюкокортикоидного рецептора и белка теплового шока. Белок теплового шока высвобождается и комплекс гормон—рецептор транспортируется в ядро, где взаимодействует с хроматином и регуляторными белками, специфичными для разных клеток. Последние индуцируют экспрессию генов . В отсутствие гормона связывание рецепторного белка с ДНК не происходит. Таким образом, гормон вызывает активацию всей указанной системы .
Глюкокортикостероиды проявляют множество биологических эффектов, так как влияют на большинство клеток организма. Основные метаболические эффекты обусловлены прямым действием гормонов на клетку. Некоторые важные эффекты глюкокортикостероидов являются результатом гомеостатических реакций, опосредованных инсулином и глюкагоном. Многие из этих эффектов дозозависимы. Чувствительность сосудов и бронхов к катехоламинам снижена при отсутствии кортизола и восстанавливается при введении этого глюкокортикостероида.
Противовоспалительное действие обусловлено стабилизирующим влиянием глюкокортикостероидов на биологические мембраны, уменьшением капиллярной проницаемости. Этим можно объяснить их выраженный антиэкссудативный эффект. Глюкокортикостероиды стабилизируют лизосомальные мембраны, тем самым способствуя уменьшению высвобождения лизосомальных протеолитических ферментов лизосом, предотвращая развитие деструктивных процессов в тканях и уменьшая выраженность воспалительной реакции. Глюкокортикостероиды угнетают пролиферацию фибробластов и синтез ими коллагена.
Наиболее известным из синтетических глюкокортикоидов является преднизолон — водорастворимый дегидрированный аналог гидрокортизона .
Препарат ПРЕДНИЗОЛОН, который поставляет на украинский рынок фирма «Шрея Хелскер» (Индия), оказывает противовоспалительное, противоаллергическое, противошоковое действие. При кратковременном парентеральном применении эти эффекты реализуются за счет общих для всех глюкокортикостероидов механизмов: путем стабилизации клеточных мембран, мембран органелл клеток, торможением высвобождения ферментов, повреждающих клетки, замедлением миграции тучных клеток и выделения медиаторов воспаления, уменьшения проницаемости капилляров и др. Угнетает синтез и секрецию адренокортикотропного гормона гипофиза и вследствие этого — глюкокортикостероидов в надпочечниках.
При приеме внутрь хорошо всасывается в пищеварительном тракте. Максимальная концентрация в плазме крови достигается через 90 мин. Метаболизируется преднизолон преимущественно в печени. Период полувыведения — около 3,3 ч; 20% препарата выводится в неизмененном виде с мочой .
При внутримышечном и внутривенном введении глюкокортикостероидов их действие более кратковременно, чем при приеме внутрь .
Наиболее часто в ревматологии в начале курса лечения применяют глюкокортикостероидные гормоны в достаточно высоких дозах, соответствующих степени активности заболевания, с последующим постепенным снижением.
Необходимо отметить, что эффективность глюкокортикостероидов наиболее выражена при высокой активности воспалительного процесса. Таким образом, при активности ревматизма I степени применение ацетилсалициловой кислоты более оправдано, чем применение преднизолона; при активности болезни II–III степени преднизолон значительно эффективнее ацетилсалициловой кислоты .
Показаниями к применению препарата ПРЕДНИЗОЛОН являются ревматоидный артрит, острая ревматическая лихорадка, болезнь Аддисона, острая недостаточность коры надпочечников, адреногенитальный синдром, бронхиальная астма (в том числе для устранения астматического статуса), острые и хронические аллергические заболевания (лекарственная аллергия, сывороточная болезнь, крапивница, аллергический ринит, повышенная чувствительность к различным химическим веществам, отек Квинке), гепатит, печеночная кома, гипогликемические состояния, липоидный нефроз, заболевания системы крови (агранулоцитоз, разные формы лейкозов, тромбоцитопеническая пурпура, гемолитическая анемия), болезнь Ходжкина, диффузные заболевания соединительной ткани (системная красная волчанка, дерматомиозит, полиомиозит, узелковый периартериит и другие системные васкулиты), тяжелые кожные заболевания (пузырчатка, экзема, эксфолиативный дерматит, псориаз), заболевания глаз иридоциклит, увеит, хориоидит); в педиатрии — при острой ревматической лихорадке, малой хорее, обструктивном бронхите, нефротическом синдроме, для подавления реакции отторжения при трансплантации органов и тканей.
ПРЕДНИЗОЛОН выпускают в форме таблеток по 5 мг и в форме р-ра для инъекций в ампулах по 1 мл (30 мг/мл).
Дозу препарата устанавливают индивидуально. Внутрь в острых случаях взрослым назначают в начальной дозе 20–30 мг/сут. При необходимости начальную дозу можно повысить до 15–100 мг/сут, поддерживающая доза — 5–10 мг/сут. При парентеральном введении (внутримышечно и внутривеннно) дозу, кратность и продолжительность введения препарата определяют индивидуально. Обычно внутривенно медленно вводят 30–45 мг преднизолона. По показаниям вводят повторно в дозе 30–60 мг.
Препарат ПРЕДНИЗОЛОН фирмы «Шрея Хелскер Пвт. Лтд.» изготовлен из высококачественной субстанции и обладает высокой терапевтической эффективностью.
Д.Л. Кирик, доктор медицинских наук
И.Ф. Полякова, кандидат медицинских наук