Пневмоторакс у новорожденных
Пневмоторакс — это присутствие воздуха в плевральной полости, куда оно попадает вследствие повреждения легкого или стенки грудной клетки. Воздух в плевральной полости сдавливает легкое, что приводит к ухудшению газообмена.
Классификация пневмоторакса:
1) по этиологии:
а) спонтанный — возникает вследствие разрыва эмфизематозной буллы или альвеол, расположенных субплеврально; может быть первичный (у здоровых лиц, т. е. без синдромов легочной патологии) или вторичный (осложнение легочных и бронхиальных заболеваний, таких как ХОБЛ, муковисцидоз, гистиоцитоз из клеток Лангерганса, лимфангиолейомиоматоз);
б) травматический — вследствие травмы грудной клетки, с нарушением или без нарушения целостности тканей (травма острым предметом, падение с высоты, сдавление, транспортное происшествие);
в) ятрогенный — вследствие прокола плевры, биопсии легкого (трансторакальной или трансбронхиальной), катетеризации центральных вен (подключичной, реже внутренней яремной вены), механической вентиляции легких, торакохирургических процедур.
2) по механизму возникновения:
а) закрытый — в плевральную полость проникает однократно определенное количество воздуха, которое может спонтанно рассосаться в течение нескольких дней (напр. ятрогенный пневмоторакс вследствие прокола плевры);
б) открытый — воздух свободно поступает в плевральную полость через отверстие в стенке грудной клетки или бронхе и тем же путем уходит; последствием бывают «колебательные движения средостения», что может привести к рефлекторной остановке сердечной деятельности;
в) напряженный (клапанный) — в отверстии, через которое в плевральную полость поступает воздух, образуется клапан и во время каждого вдоха воздух проникает в плевральную полость, но не может покинуть ее во время выдоха. В последствии внутриплевральное давление превышает атмосферное и постоянно растет, что вызывает не только сдавление легкого со стороны повреждения, но и перемещение средостения в неповрежденную сторону, сдавление другого легкого и больших венозных сосудов, снижение венозного возврата и сердечного выброса. Эффектом этих изменений является внезапная гипотензия и гипоксемия; может произойти внезапная остановка кровообращения. Напряженный пневмоторакс представляет непосредственную угрозу жизни и требует экстренного вмешательства.
3) по объему (ширина газового пузыря, то есть расстояние между стенкой грудной клетки и висцеральной плеврой на уровне ворот легкого на РГ грудной клетки в прямой проекции) — малый (<2 см) или большой (≥2 см).
КЛИНИЧЕСКАЯ КАРТИНА И ЕСТЕСТВЕННОЕ ТЕЧЕНИЕ наверх
Наиболее частые субъективные симптомы пневмоторакса: боль в грудной клетке плеврального характера, одышка (особенно у пожилых) и кашель; у части больных без субъективных симптомов. Спонтанный пневмоторакс обычно возникает в покое. Объективные симптомы (→табл. 1.31-1) могут быть слабо выражены, напр. только ослабление везикулярного дыхания на стороне пневмоторакса. Напряженному пневмотораксу обычно сопутствует очень быстрое усиление одышки, гипотензия и симптомы гипоксемии — цианоз, тахипноэ, тахикардия, а в случае дальнейшего нарастания пневмоторакса — остановка кровообращения. Пневмотораксу может сопутствовать подкожная →разд. 3.22 и медиастинальная эмфизема →разд. 3.21.
ДИАГНОЗ наверх
Диагноз основывается на субъективном и объективном обследовании, а также визуализирующих методах исследования. На основании субъективных и объективных симптомов невозможно достоверно оценить величину пневмоторакса.
Дополнительные методы исследования
1. Визуализирующие методы исследования
1) РГ грудной клетки показывает спадение легкого →рис. 3.20-1;
2) КТ грудной клетки помогает при дифференциации пневмоторакса и эмфизематозной буллы легких, подтверждении пневмоторакса, когда оценку РГ грудной клетки в прямой проекции усложняет подкожная эмфизема, и определении положения катетера в грудной клетке;
3) УЗИ (датчиком 5–10 МГц в среднеключичной и передней подмышечной линии) — скольжение бляшек плевры согласно дыхательным движениям и симптом «хвоста кометы» (артефакт, образующийся на границе правильно прилегающих плевральных бляшек — рис. 3.20-2) позволяют исключить пневмоторакс.
2. Пульсоксиметрия и анализ газов артериальной крови: уменьшение SpO2 и гипоксемия (особенно при напряженном и большом пневмотораксе), иногда гиперкапния и дыхательный ацидоз (особенно при вторичном пневмотораксе).
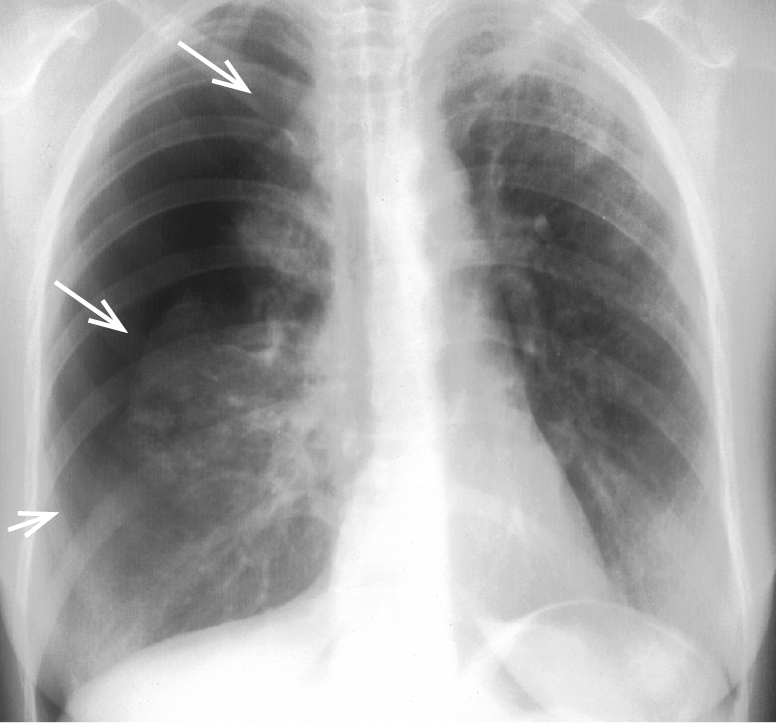
Рисунок 3.20-1. Большой (≥2 см) пневмоторакс (стрелки указывают край легкого)
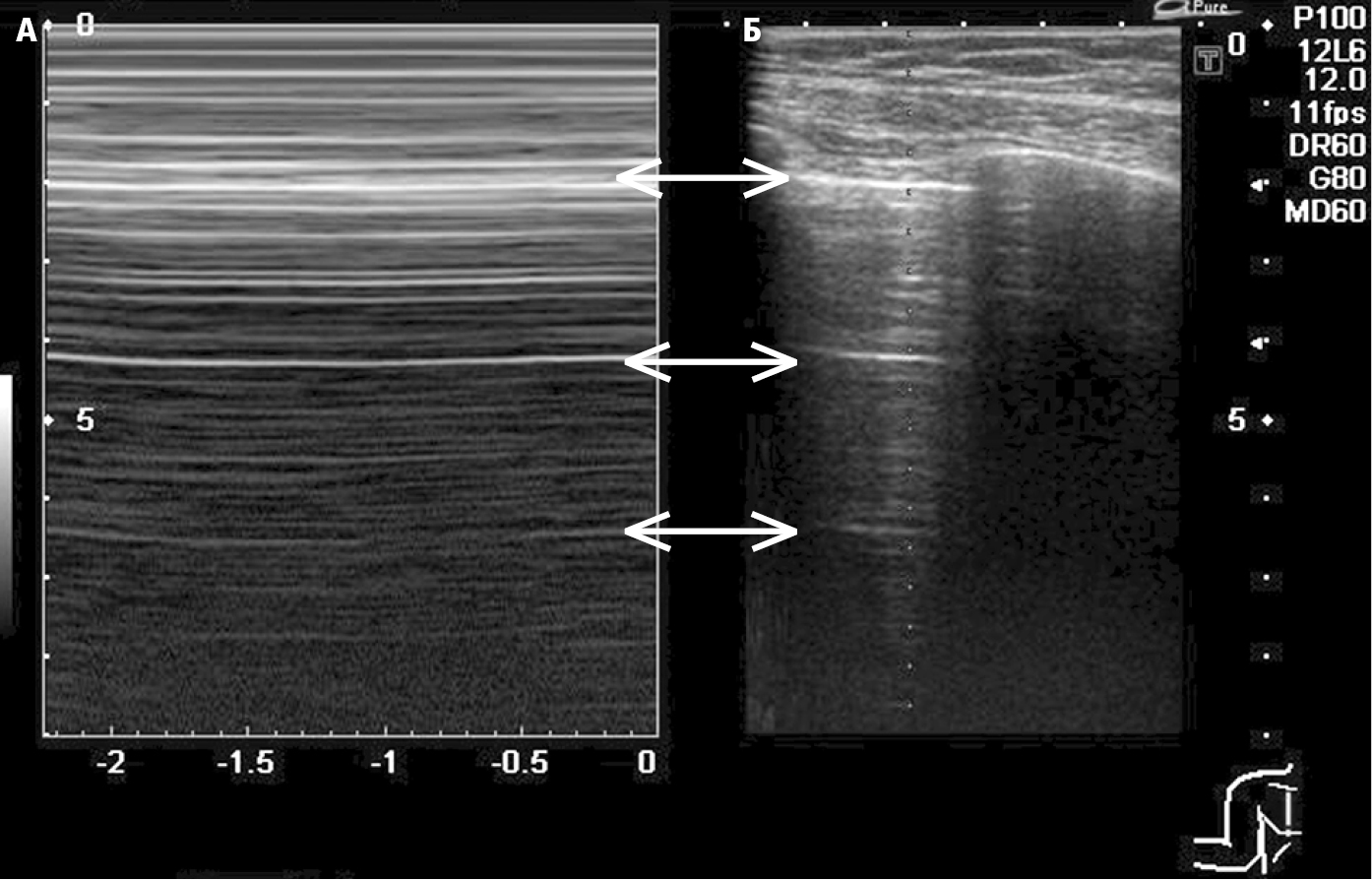
Рисунок 3.20-2. УЗИ больного пневмотораксом. A — в одномерном исследовании (M-режим) видны четкие границы параллельных линий (так называемая стратосфера или штрих-код). Б — в двумерном исследовании (B-режим) видны горизонтальные линии A (стрелки).
ЛЕЧЕНИЕ наверх
Алгоритм действий в ситуациях непосредственной угрозы жизни
В каждом случае используйте кислород.
1. Напряженный пневмоторакс: немедленно введите катетер (применяемый для катетеризации периферических вен), длиной 4–5 см и диаметром 2,0 мм (14 G) или 1,7 мм (16 G), в плевральную полость на уровне II межреберья по среднеключичной линии (по верхнему краю III ребра), и не извлекайте до момента постановки дренажа.
2. Двусторонний пневмоторакс: в зависимости от его величины наблюдайте за больным в ОИТ и повторяйте РГ грудной клетки или начинайте дренирование плевральных полостей (начиная со стороны большего пневмоторакса).
3. Гемопневмоторакс: требует срочного дренирования или хирургического вмешательства.
Алгоритм действия в ситуациях, не угрожающих жизни
Алгоритм действий при первичном спонтанном пневмотораксе
→рис. 3.20-3.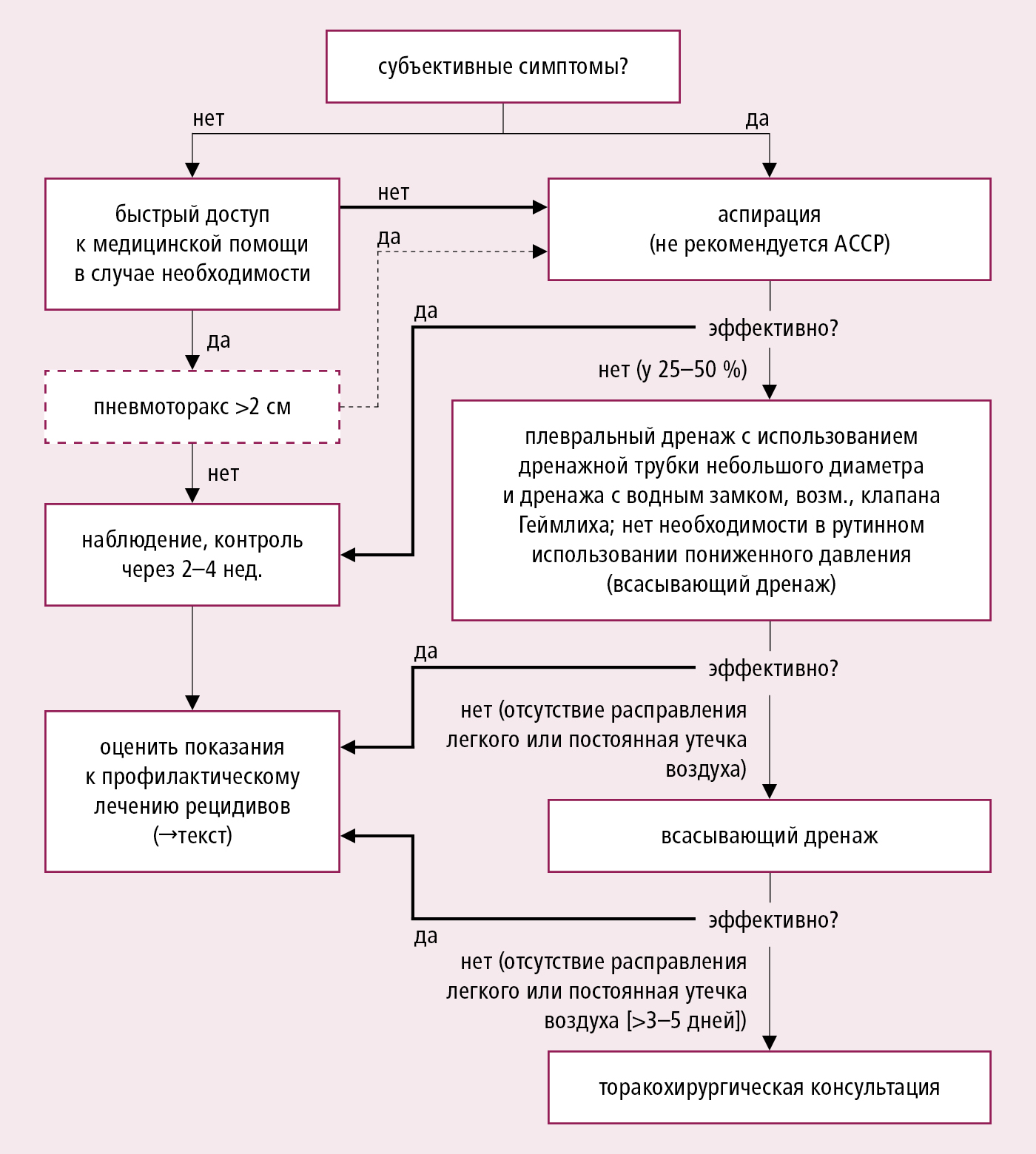
Рисунок 3.20-3. Алгоритм лечения первичного спонтанного пневмоторакса (на основе рекомендаций BTS и ACCP, модифицированных)
1. Наблюдение, отдых и кислородотерапия: основные методы действий у больных с малым закрытым ятрогенным пневмотораксом или спонтанным первичным пневмотораксом и с небольшими субъективными симптомами (в том числе у некоторых больных с большим спонтанным первичным пневмотораксом без субъективных симптомов). Если на контрольной РГ по истечении 3–6 ч пневмоторакс не увеличивается, можете рассмотреть амбулаторное лечение. Больного проинформируйте о необходимости немедленного обращения в больницу в случае усиления симптоматики и о риске рецидива пневмоторакса. Остальные больные нуждаются в госпитализации. Если нет противопоказаний (напр. хроническая дыхательная недостаточность с гипоксемическим респираторным драйвом →разд. 3.1), используйте кислород 10 л/мин (→разд. 24.21), что способствует рассасыванию воздуха в плевральной полости. По истечении 3–7 дней сделайте контрольную РГ грудной клетки. Если воздух рассосался, можете выписать больного из больницы.
2. Аспирация с помощью шприца через катетер: при спонтанном первичном и ятрогенном пневмотораксе выполните пункцию плевральной полости и введите катетер (как для аспирации плевральной жидкости →разд. 24.8), удалите воздух (макс. 2,5 л) из плевральной полости с помощью шприца, присоединенного к катетеру трехходовым краником. В случае неэффективности аспирации используйте дренирование плевральной полости. При спонтанном вторичном пневмотораксе можете применить этот метод только у больных с небольшой одышкой и малым пневмотораксом. Не рекомендуется использовать аспирацию через катетер у больных с рецидивирующим пневмотораксом.
3. Дренирование плевральной полости через межреберье: дренажную трубку, введенную в плевральную полость, присоедините к трехкамерной дренажной системе и оставьте до полного расправления легкого или до прекращения утечки воздуха. Если, несмотря на дренирование, легкое не расправляется, используйте активное дренирование.
4. Хирургическое лечение:
1) показания: второй эпизод пневмоторакса с той же стороны грудной клетки; рецидив пневмоторакса c противоположной стороны грудной клетки; двусторонний спонтанный пневмоторакс; продолжающееся поступление воздуха или неполное расправление легкого по истечении >5 дней дренирования плевральной полости; гемопневмоторакс; работа по профессии с повышенным риском пневмоторакса (водолаз, летчик, профессиональный водитель, машинист, моряк, рыбак морского лова, работник стекольного завода, трубач); муковисцидоз (взвесьте хирургическое вмешательство после первого эпизода пневмоторакса).
2) виды процедур: плевродез (обычно с помощью талька, который вызывает облитерацию плевральной полости), лучше видеоторакоскопическим способом; плеврэктомия — удаление париетальной плевры приводит к окончательной облитерации плевральной полости и почти полностью предохраняет от рецидивов пневмоторакса.
5. Указания для лиц, перенесших пневмоторакс: авиакомпании рекомендуют 6-недельный перерыв между эпизодом пневмоторакса и путешествием самолетом. После перенесенного пневмоторакса противопоказано ныряние (за исключением лиц после плеврэктомии). Риск рецидива пневмоторакса уменьшается после прекращения курения.
× Закрыть
детской хирургии, анестезиологии и реаниматологии
Миткинов О.Э., Голуб И.Е.
СИНДРОМ УТЕЧКИ ВОЗДУХА ПРИ РЕСПИРАТОРНОЙ ТЕРАПИИ У НОВОРОЖДЕННЫХ С ЭКСТРЕМАЛЬНО НИЗКОЙ МАССОЙ ТЕЛА
Бурятский государственный университет, г. Улан-Удэ
Mitkinov O.E., Golub I.E.
AIR LEAK SYNDROM IN THE RESPIRATORY THERAPY IN INFANTS WITH EXTREMELY LOW BIRTH WEIGHT
Buryat State University
Резюме
Синдром утечки воздуха — грозное осложнение респираторной терапии, особенно у недоношенных новорожденных. Проведено исследование 50 детей с весом тела при рождении менее 1000 г с использованием методик вентиляции с двойным контролем и неинвазивной вентиляции в режиме BiPhasic. Использование данных методов позволяет снизить вероятность возникновения вентилятор-индуцированного повреждения легких, в частности синдрома утечки воздуха.
Ключевые слова: вентиляция с двойным контролем, неинвазивная вентиляция, синдром утечки воздуха
Key words: dual controlled ventilation, noninvasive ventilation, air leak syndrome
К синдромам утечки воздуха из легких относятся осложнения, возникающие при разрыве альвеол и накоплении воздуха в окружающих пространствах и тканях. Эти осложнения могут развиться у новорожденных спонтанно (вне связи с терапевтическими процедурами), но чаще они возникают при искусственной или вспомогательной вентиляции легких, а также при использовании методики СРАР .
Патогенез этих осложнений достаточно хорошо изучен. Введение или задержка в легких избыточных объемов воздуха приводят к повышению внутриальвеолярного давления и разрыву основания альвеол. Воздух просачивается через ячейки капиллярной сети и распространяется по перива-скулярным пространствам по направлению к корню легкого. И хотя периваскулярные пространства в значительной степени могут растягиваться, накапливающийся воздух неизбежно сдавливает окружающие сосуды, создавая предпосылки для гипо-перфузии легких .
Далее воздух может проникнуть в средостение (пневмомедиастинум), плевральную полость (пневмоторакс), а иногда и в перикардиальное пространство (пневмоперикардиум). В редких случаях воздух из средостения распространяется вниз через отверстия в диафрагме и скапливается в ретроперитонеальном пространстве, а оттуда прорывается в брюшную полость (пневмоперито-неум).
Материал и методы исследования
50 новорожденных, родившихся на сроке ге-стации менее 28 недель с массой тела при рождении менее 1000 г были разделены на 2 группы: 1-ю группу составили 25 детей, которым проводили традиционную искусственную вентиляцию легких (ИВЛ), 2-ю группу — 25 детей, которым проводили неинвазивную вентиляцию легких назальную CPAP. По итогам анализа общего материала установлено, что группы достоверно не различались
детской хирургии, анестезиологии и реаниматологии
Таблица 1. Характеристика новорожденных
Показатель 1-я группа 2-я группа
Гестационный срок, недели 27,04±0,97 27,04±1,04
Масса тела, г 873,5±87,6 848,5±74,9
по анамнестическим данным, гестационному возрасту и массе тела при рождении. Экзогенный сур-фактант (Куросурф) применяли у всех пациентов в исследуемых группах.
Все дети потребовали проведения респираторной терапии в связи с респираторным дистресс-синдромом (РДС). В исследуемых группах анализировали продолжительность респираторной терапии и частоту осложнений, в частности синдрома утечки воздуха (СУВ).
Из исследования исключены дети, умершие в неонатальный период.
Методика искусственной вентиляции легких
Стандартом проведения ИВЛ у новорожденных до сих пор считается вентиляция, управляемая по давлению и времени (рге88иге-Птйе^ time-cycled, continuous flow ventilation). Однако в последние годы опубликован ряд исследований, доказывающих преимущества вентиляции, контролируемой по объему, в том числе у недоношенных новорожденных .
В 1-й группе традиционную ИВЛ проводили в режиме двойного контроля — способы ИВЛ с переключением вентилятора, при необходимости, с ИВЛ по давлению на ИВЛ по объему. При использовании двойных режимов анестезиологи пытаются совместить преимущества вентиляции по объему (надежность оксигенации и выведения углекислоты) и достоинства вентиляции по давлению (предупреждение баротравмы, хорошее соответствие дыхательного паттерна больного и работы аппарата ИВЛ, оптимальное распределение воздушно-кислородной смеси в легких).
Steven Donn и Sunil Sinha считают предпочтительным использование данных режимов вентиляции у недоношенных новорожденных для снижения частоты вентилятор-индуцированных повреждений легких (VILI, ventilator-induced lung injury).
Режим Pressure-regulated volume control (PRVC), реализованный на аппарате AVEA (Viasys Healthcare inc. CA), создан на основе Pressure control ventilation (PCV). Его особенность состоит в том, что уровень давления вдоха (inspiratory pressure) устанавливает не врач. Это делает аппарат ИВЛ на основе заданного врачом целевого дыхательного объема (target tidal volume), то есть аппарат ИВЛ задает уровень давления вдоха для доставки целевого дыхательного объема. При этом управляемыми параметрами являются объем и давление, иначе этот режим называется Dual controlled ventilation.
В ряде исследований отмечена меньшая продолжительность ИВЛ и VILI у недоношенных детей при использовании PRVC по сравнению с традиционно применяемой PCV .
При вентиляции применяли целевой дыхательный объем до 4-5 мл/кг с обязательной установкой предела объема 10 мл/кг. Стартовое пиковое давление в большинстве случаев устанавливали 16-20 см вод. ст., Реер — 4 см вод. ст. Время вдоха — от 0,25 до 0,3. При этом основной оценкой эффективности вентиляции в первые сутки является динамика снижения FiO2.
Методика назальной CPAP
Методика назальной СРАР лишь недавно стала приемлемой альтернативой традиционной ИВЛ у новорожденных. Однако данный метод уже считается ведущим в лечении дыхательной недостаточности при РДС у недоношенных новорожденных. Ранний СРАР рекомендован к применению Российской ассоциацией специалистов перинатальной медицины .
В нашем исследовании неинвазивную вентиляцию легких проводили на аппарате Infant Flow Driver TM (Viasys Healthcare inc. CA) в режиме BiPhasic.
детской хирургии, анестезиологии и реаниматологии
Таблица 2. Частота синдрома утечки воздуха
Показатель 1-я группа 2-я группа Р
Пневмоторакс 0 0 —
Интерстициальная легочная эмфизема (ИЛЭ) 7 (28%) 6 (24%) <0,05
Продолжительность респираторной терапии, ч у детей с ИЛЭ 174.4 (±77) 216.5 (±89) 87,3 (±39) 94,7 (±16,9) <0,01 <0,01
Данный режим основан на создании двухфазного положительного давления в дыхательных путях. При этом фаза высокого давления в дыхательных путях чередуется с фазой низкого давления.
В настоящее время существует несколько модификаций режима, однако общим является задание двух уровней (level) постоянного давления: верхнего (CPAP high) и нижнего (CPAP low) и двух временных интервала (фазы) (time high и time low). Другое название временных интервалов -inspiratory time и expiratory time.
Таким образом, аппарат с определенной периодичностью меняет уровень давления СРАР через некий отрезок времени. Спонтанное дыхание возможно на обоих уровнях давления. В зависимости от задачи и клинической ситуации врач меняет длительность и соотношение фаз и уровни давления.
Большое количество публикаций позволяет признать эффективным данный режим неинвазив-ной вентиляции, в том числе у младенцев с экстремально низкой массой тела .
При неинвазивной вентиляции устанавливали верхний уровень СРАР — 6 см вод. ст., нижний уровень — 4 см вод. ст., время вдоха — 1 секунда, время выдоха — 2 секунды. Основным динамическим параметром, определяющим эффективность вентиляции, также является величина FiO2.
Статистический анализ проводили с помощью программы Statistica 6.0 с расчетом критерия Ман-на-Уитни.
Результаты исследования
Пневмоторакс
Частота развития этого грозного осложнения, по данным разных авторов, серьезно различает-
ся — от 2-5 до 20-34% детей с РДС, находящихся на ИВЛ . Однако на современном этапе, используя принципы протективной ИВЛ и метод КСРАР средней, по литературным данным, следует считать частоту 2,1%. Данное исследование было проведено в 2005 г. в университетском центре Бирмингема (США, штат Алабама) у 14 614 младенцев, получавших респираторную поддержку . Однако частота пневмоторакса у детей с экстремально низкой массой тела не изучена.
Летальность у новорожденных с пневмотораксом, осложнившим течение РДС, варьирует от 14 до 31%, причем чем меньше масса тела ребенка, тем выше летальность . Пневмоторакс в 2 раза повышает частоту перивентрикулярных и внутрижелудочковых кровоизлияний у недоношенных детей .
В исследуемых группах не зафиксировано ни одного случая пневмоторакса.
Отметим, что применение ИВЛ с двойным контролем в режиме PRVC соответствует современным представлениям о протективной ИВЛ и может способствовать снижению развития такого грозного осложнения, как пневмоторакс.
Следует отметить, что в ряде ранних публикаций, посвященных применению назальной СРАР, в частности с постоянным потоком, отмечена частота пневмоторакса, даже превышающая таковую у детей на ИВЛ . Однако более поздние исследования показали невысокую (менее 2%) встречаемость пневмоторакса при проведении неинва-зивной вентиляции .
Таким образом, неинвазивная вентиляция назальная CPAP в режиме BiPhasic с двумя уровнями давления также позволяет снизить вероятность возникновения пневмоторакса у недоношенных младенцев.
детской хирургии, анестезиологии и реаниматологии
Интерстициальная легочная эмфизема
Скопление воздуха в интерстициальном пространстве может не иметь никаких клинических проявлений. Однако если выраженная интерстици-альная эмфизема развивается у детей, находящихся на ИВЛ, то, как правило, на первый план выступают вентиляционные расстройства. Прогрессирова-ние интерстициальной легочной эмфиземы (ИЛЭ) примерно в 50% случаев приводит к развитию пневмоторакса.
Популяционные исследования обнаруживают широкий диапазон частоты ИЛЭ — до 2-3% всех новорожденных в отделениях реанимации, а среди недоношенных эта величина достигает 20-30%, причем наибольшая частота встречается среди детей с весом менее 1000 г при рождении . Исследование, распределившее недоношенных по весу, обнаружило, что ИЛЭ встречается у 42% младенцев с массой 500-799 г, у 29% пациентов с весом 800-899 г и у 20% детей, вес которых при рождении составил 900-999 г . Недавно опубликованное проспективное мультицентровое сравнительное исследование ранней высокочастотной осцилляторной и традиционной вентиляции легких у недоношенных (менее 30 недель гестации) показало, что ИЛЭ развилась у 11% детей в обеих группах .
Моп8о1 сообщил о 80%-ной смертности при ИЛЭ у новорожденных с весом при рождении меньше 1600 г и тяжелым РДС. Раннее выявление ИЛЭ (до 48 ч после рождения) еще больше увеличивает смертность, поскольку оно прямо коррелирует с тяжестью паренхиматозного поражения.
Длительность ИВЛ при ИЛЭ может затягиваться до 2-3-х недель, соответственно резко возрастает вероятность бронхолегочной дисплазии. У некоторых детей с ИЛЭ выявляется хроническая лобарная эмфизема, требующая хирургической лобэктомии.
В нашем исследовании отмечена достаточно высокая частота интерстициальной эмфиземы. ИЛЭ диагностируется только рентгенологически. Типичные признаки — кистообразные и линейные просветления. Однако первыми признаками в большинстве случаев было снижение сатурации кислорода и повышение рСО2.
В группе ИВЛ частота ИЛЭ составила 28% (7 новорожденных).
У 6 новорожденных прогрессирование СУВ удалось избежать консервативными мерами — снижением пикового давления и переводом на режим TCPL (time cycled pressure limited) с управлением по давлению и одновременным повышением частоты дыхания и уменьшением времени вдоха. Также применяли терапию положением при односторонней ИЛЭ. У одного ребенка применили высокочастотную осцилляторную ИВЛ. Летальности в связи с СУВ не отметили.
Во 2-й группе частота ИЛЭ составила 24% (6 детей). У всех детей удалось продолжить назальную CPAP на более низких уровнях давления без интубации и перевода на ИВЛ.
Следует отметить, что в исследуемых группах назальная СРАР была предпочтительным методом респираторной поддержки у всех детей с рождения при регулярном самостоятельном дыхании. Дети группы ИВЛ в силу ряда причин (депрессия дыхания, гиповолемия, врожденные инфекционные поражения и др.), несмотря на сопоставимые сроки гестации и вес при рождении, изначально были в менее выгодном положении, и их состояние оценивалось как более тяжелое, в том числе и по шкале Апгар.
Тем не менее проведенный анализ свидетельствует об эффективности назальной СРАР у данного контингента пациентов. Наличие СУВ в виде интерстициальной эмфиземы не помешало проведению дальнейшей респираторной поддержки без ужесточения параметров вентиляции.
Продолжительность вентиляции
Данный показатель сложно оценивать в связи с большим разбросом индивидуальных данных. Для каждого пациента он может сильно различаться.
Тем не менее отметим, что при проведении неинвазивной вентиляции средняя продолжительность респираторной поддержки была достоверно в 2 раза меньше, чем в группе ИВЛ. Наличие СУВ на 20 и 8%, соответственно, увеличивало ее продолжительность в группах.
В ряде исследований было отмечено, что на продолжительность ИВЛ влияют терапия экзогенным сурфактантом, применение назальной СРАР и протективной ИВЛ, наличие инфекционных и других осложнений и многие другие факторы . Однако нет убедительных данных
детской хирургии, анестезиологии и реаниматологии
о влиянии продолжительности ИВЛ на летальность и тяжесть неврологических исходов.
На сегодняшний день актуальны вопросы, касающиеся эффективности респираторной терапии у недоношенных детей с экстремально низкой массой тела. Синдром утечки воздуха — грозное осложнение проводимой терапии, влияющее на летальность и последующее развитие ребенка. Использование неинвазивной вентиляции в режиме Б1РЬа81е, а при ее невозможности применение традиционной ИВЛ с двойным контролем позволяет снизить вероятность возникновения вентилятор-индуцированного повреждения легких, в частности синдрома утечки воздуха.
Выводы
1. Применение традиционной искусственной вентиляции легких с двойным контролем у недоношенных новорожденных позволяет снизить вероятность возникновения такого грозного осложнения, как пневмоторакс.
2. Использование методики неинвазивной вентиляции легких с двумя уровнями давления не вызывает роста числа СУВ и даже позволяет снизить вероятность развития пневмоторакса у недоношенных новорожденных.
3. Продолжительность респираторной поддержки при применении неинвазивной вентиляции легких в 2 раза меньше, чем при традиционной ИВЛ.
Список литературы
5. Cunningham K., Paes B.A., Symington A. Pulmonary interstitial emphysema: a review // Neonatal. Netw. 1992. Vol. 11, № 5. Р. 7-16, 29-31.
9. Greenough A., Dixon A. K., Roberton N.R. Pulmonary interstitial emphysema // Arch.Dis. Child. 1984. Vol. 59, № 11. Р. 1046-1051.
детской хирургии, анестезиологии и реаниматологии
16. Keszler M. Volume-targeted Ventilation// Neoreviews. 2006. № 7. P. 250-257.
21. Plenat F., Vert P., Didier F. Pulmonary interstitial emphysema // Clin Perinatol. 1978. Vol. 5, № 2. P. 351-375.
22. Sinha S.K., Donn S.M. Newer forms of conventional ventilation for preterm newborns // Acta Pœdiatrica. 2008. Vol. 97. P. 1338-1343.
Авторы
ГОЛУБ Игорь Ефимович Доктор медицинских наук, профессор, заведующий кафедрой анестезиологии и реанимации ИГМУ. E-mail: krisko-irk@mail.ru.
ВВЕДЕНИЕ: При напряжённом пневмотораксе коллапс лёгкого приводит к смещению средостения и трахеи и сопутствующему уменьшению венозного возврата с ухудшением сердечной деятельности. Хотя иногда пневмоторакс может оставаться бессимптомным, он вызывает острое ухудшение состояния новорожденного. Сроки выявления и лечения патологического состояния очень важны. Пневмоторакс обычно вызывает беспокойство ребёнка, затрудненное дыхание, тахипноэ, цианоз кожных покровов, тахикардию, а также отсутствие дыхательных шумов на стороне поражения. Выявляются перкуторный коробочный оттенок звука, смещение границ сердца и средостения. Обнаружение пневмоторакса у новорожденного зависит от степени подготовки врача и знания предрасполагающих факторов при различном гестационном возрасте.
МЕТОДЫ: В Университетской больнице Ага Хана с января по декабрь 2010 года было проведено ретроспективное исследование, в котором определялись причины и оценивался исход пневмоторакса новорожденных. Оценивались такие переменные, как пол, масса при рождении, гестационный возраст, признаки травмы и клинические симптомы, способ родоразрешения, средняя продолжительность болезни, лечение и исход. Данные были проанализированы с помощью SPSS 17.0.
РЕЗУЛЬТАТЫ: В изучаемую группу вошло 10 новорожденных, соотношение мальчики и девочки как 1:2,3. При рождении вес колебался от 1750 до 3600 г, в среднем — около 2100 г. Пять детей были доношенными, 4 недоношенными и 1 переношенным.
Чаще всего в 50% случаев наблюдался левосторонний пневмоторакс, правосторонний — 20%, а в 30% случаев — двусторонний.
Клиническая картина: 46% тахипноэ, 21% цианоз, 13% раздражительность, 8% втяжение участков грудной клетки и 8% апноэ.
Средний возраст новорожденных на момент постановки диагноза составил 96 часов, для недоношенных — 68 часов и для доношенных — 105.5 часа. При возникновении пневмоторакса 5 детей были на искусственной вентиляции лёгких.
Первичными причинами пневмоторакса были: пневмония и сепсис – 3 ребёнка, болезнь гиалиновых мембран — 2, синдром аспирации мекония — 2, врожденная диафрагмальная грыжа -1, спонтанный пневмоторакс был в 2 случаях. В 40% случаев диагноз был установлен только при лучевой диагностике, клиническая картина не вызывала каких-либо подозрений на пневмоторакс.
Двум младенцам проводилась только кислородная терапия, остальным восьми выполнена закрытая торакотомия с установкой дренажа. Средняя продолжительность аспирации составляла 9.7 час, в среднем дренаж устанавливался на 1.3 дня.
В текущем исследовании заболеваемость новорожденных пневмотораксом составила 2.5/1000 новорожденных по сравнению с 10-15/1000 в Дании, 10-20/1000 в Турции. Рождённые путём рекомендованного, но не обязательного кесарева сечения, показали более высокую частоту пневмоторакса (2.9 на 1000 родившихся), чем дети после экстренного кесарево сечения (1.53) или вагинальных родов (0.39).
Смертность составила 60%, что в основном определялось первичной этиологической причиной и сопутствующими заболеваниями. Уровень осложнений составил 46%. Осложнениями были метаболический ацидоз, ателектаз, плеврит, лёгочное кровотечение и воспаление лёгких.
ЗАКЛЮЧЕНИЕ: Адекватная подготовка врачей к возможному развитию состояния должна уменьшить вероятность пневмоторакса.
Вопрос обзора: Приводит ли использование иглы для аспирации пневмоторакса к уменьшению смертности у новорожденных по сравнению с использованием межреберной трубки (трубки, которую вводят между ребрами)?
Актуальность: Пневмоторакс — это наличие воздуха в плевральном пространстве (пространство между легкими и грудной стенкой). Это серьезное состояние у новорожденного, которое можно лечить с помощью игольной аспирации или установки трубки в грудной клетке. Первый метод является менее инвазивным и позволяет избежать необходимости установки трубки в грудной клетке, что сокращает продолжительность госпитализации. Однако неудачная игольная аспирация может впоследствии привести к необходимости установки дренажной трубки, что является дополнительной инвазивной процедурой. Этот систематический обзор оценивает имеющиеся доказательства эффективности этих двух методов лечения пневмоторакса у новорожденных.
Характеристика исследований: Мы включили одно исследование (с участием 70 новорожденных), в котором игольную аспирацию с последующим немедленным удалением иглы сравнивали с установкой дренажной трубки в грудной клетке при лечении пневмоторакса, и еще одно исследование (72 новорожденных), в котором игольную аспирацию с оставленным на месте сосудистым катетером сравнивали с установкой дренажной трубки в грудной клетке при лечении пневмоторакса. Доказательства актуальны по состоянию на июнь 2018 года.
Основные результаты: Использование игольной аспирации по сравнению с установкой дренажной трубки в в грудной клетке не привело к снижению смертности или каких-либо осложнений, связанных с процедурой. Около 30% младенцев с пневмотораксом, которых лечили при помощи игольной аспирации с последующим немедленным удалением иглы, не нуждались в установке дренажной трубки в межреберном пространстве; ни один из младенцев с пневмотораксом, которых лечили при помощи игольной аспирации с оставленной на месте иглой (сосудистым катетером) не нуждались в установке дренажной трубки в межреберном пространстве. Однако множество факторов могли бы объяснить эти результаты.
Качество доказательств Два небольших выявленных испытания не дают достаточной информации, чтобы определить, какой из двух методов лучше для лечения пневмоторакса у новорожденных. Однако, игольная аспирация может снизить потребность в установке дренажной трубки в межреберном пространстве у соответствующей доли новорожденных.




