Периферической нейропатии
Нервная система человека представлена головным и спинным мозгом, периферическими нервами и нервными сплетениями. Периферические нервы имеют тонкую сложную структуру и легко подвергаются воздействию вредных факторов внешнего и внутреннего происхождения. Возникают невоспалительные поражения нервов, которые называются нейропатиями. Нейропатия требует только комплексного лечения и тщательной профилактики. Необходимым звеном ее лечения и предупреждения является санаторно-курортное лечение в здравницах, специализирующихся заболеваниях периферической нервной системы.
Симптоматика нейропатии определяется характером повреждения нервов и их расположением. Чаще всего оно возникает при общих заболеваниях, различных интоксикациях, иногда — вследствие различных травм.
Наиболее часто встречающиеся формы нейропатии: диабетическая, токсическая и посттравматическая.
Содержание
Особенности и клиника диабетической нейропатии
Самая типичная форма нейропатии возникает при сахарном диабете. При диабете страдают, в первую очередь, самые мелкие сосуды, в том числе и те, которые снабжают кровью нервные волокна. Основной отличительной особенностью этой формы нейропатии является снижение чувствительности в областях поражения. Вследствие этого возрастает риск травматизации и инфицирования кожных покровов в области заболевания. При диабете такая картина наиболее типична для нижних конечностей.
Большая часть пациентов с диагнозом сахарного диабета имеют ту или иную форму нейропатии:
- Периферическую: в этом случае при поражении нервов, отвечающих за иннервацию верхних или нижних конечностей, возникает чувство онемения или покалывания на стороне пораженного нерва; больные отмечают нарушение чувствительности пальцев ног или рук, а также чувство онемения.
- Проксимальную: отмечается нарушение чувствительности в области голени, бедер и ягодиц.
- Автономную: нарушается деятельность органов пищеварения, мочевыделения или половых органов.
Общая слабость в мышцах также часто сопровождает любую форму диабетической нейропатии. При этом мышцы постепенно атрофируются, развиваются нарушения покровов.
Клиника токсических нейропатий
Причиной данной формы заболевания являются различного рода интоксикации. Поражение нерва может наблюдаться как при инфекционных заболеваниях (дифтерия, ВИЧ, герпетическая инфекция), так и при отравлениях химическими веществами (алкоголь, свинец, мышьяк), а также при неправильном приеме некоторых лекарств.
Алкогольная нейропатия представляет собой тяжелое поражение периферического отдела нервной системы, являющееся наиболее частым осложнением неумеренного употребления алкоголя и его суррогатов. Бессимптомные формы алкогольной нейропатии обнаруживаются практически у всех злоупотребляющих алкоголем.
На данный момент известно, что и воздействие самого отравляющего вещества на нервное волокно, и нарушение обменных процессов вследствие отравления организма способствуют развитию нейропатии.
Чаще страдают нервы конечностей. Независимо от причины отравления, нейропатия проявляется нарушением чувствительности в стопах и кистях, появлением чувства жжения и покалывания на коже, гиперемией кожи конечностей. Также на более поздних стадиях заболевания может появиться отечность тканей нижних конечностей. Эта болезнь имеет затяжное течение, требующее профилактических мер, в частности, санаторно-курортного лечения.
Клиника посттравматической нейропатии
Причиной посттравматического поражения нервных волокон является сдавление их в результате переломов, отека тканей, неправильного образования посттравматических рубцов, и других новообразований. Более частыми формами данного заболевания является поражение локтевого, седалищного и лучевого нерва. При этом развивается атрофия мышц, нарушение их сократительной способности и снижение рефлексов. Также отмечается снижение чувствительности к болевым раздражителям.
Причины развития нейропатии
Причины данного заболевания определяются исходя из его форм:
- Поражению нервных ветвей при сахарном диабете способствует повышенный уровень сахара и липидов в крови, и первоначальное поражение вследствие этого мельчайших сосудов, питающих нервные волокна.
- Посттравматическая нейропатия развивается в результате сдавления и нарушения питания нервных волокон. Нередко проводимость нерва нарушается вследствие острой травмы, например, сильного удара, который приводит к нарушению целостности оболочек нерва.
Помимо этого вклад в развитие нейропатии могут вносить артриты, почечная и печеночная недостаточность, гипотиреоз, опухоли и другие заболевания.
Лечение и профилактика нейропатии
Лечение данного заболевания подбирается индивидуально и зависит от степени, вида и причины нарушения проводимости нервных волокон. Все мероприятия должны быть направлены на восстановление функции нерва.
При токсическом поражении необходимо прекратить токсическое воздействие (отменить лекарственный препарат, исключить прием отравляющих веществ). Лечение диабетической формы заболевания сводится, прежде всего, к поддержанию нормального уровня сахара крови. При посттравматических поражениях нервных волокон необходимо оптимальным способом избавиться от последствий травмирующего фактора.
Независимо от формы заболевания, больному назначаются обезболивающие препараты, специальные группы витаминов, другие препараты, улучшающие обменные процессы и стимулирующие регенерацию. Позже по назначению врача проводится физиотерапевтического лечение.
Немаловажную роль имеет профилактика нейропатий. Она сводится к нормализации обменных процессов, своевременному лечению системных и инфекционных заболеваний, а также важна своевременная стимуляция мышц в ходе ортопедического лечения.
Учитывая то, что данное заболевание часто переходит в хроническую форму, необходимо принять все меры для предотвращения обострения. Для этого больные с нейропатией направляются на санаторно-курортное лечение. Пациентов с данным заболеванием часто принимают санатории Кавказских Минеральных Вод и Белоруссии. В санаториях для лечения нейропатии применяются следующие процедуры:
- Психотерапия;
- Иглорефлексотерапия;
- ЛФК и массаж с приемами акупунктуры;
- Магнитотерапия;
- Светолечение;
- Лазеротерапия;
- Аромафитотерапия.
Во время санаторно-курортного лечения больным также рекомендуется диетотерапия с богатым содержанием витаминов групп В, С и Е. При этом следует помнить, что лечению в санаториях подлежат только заболевания в стадии ремиссии при хроническом процессе.
Санаторно-курортные учреждения КавМинВод и Беларуси, в которых производится профилактика и лечение нейропатии:
Профиль автора:
Inj
М1ЖНАРОДНИЙ НЕВРОЛОГ1ЧНИЙ ЖУРНАЛ
INTERNATIONAL NEUROLOGICAL JOURNAL |
МЕЖДУНАРОДНЫЙ НЕВРОЛОГИЧЕСКИЙ ЖУРНАЛ ПРАКТИКУЮЧОМУ НЕВРОЛОГУ /TO PRACTICING NEUROLOGIST/
УДК 616.8-07-08
КУШНИР Г.М.1, ИОШИНА Н.Н.1, САМОХВАЛОВА В.В.1, КУЗИНА О.С.2, КРЫЛОВА А.Н.1,
СИДОРЕНКО НА.3, ИБРАГИМОВА Л.Р.2
1 ГУ «Крымский государственный медицинский университет имени С.И, Георгиевского»
2 7-я городская клиническая больница
3 КРУ КТМО «Университетская клиника», г, Симферополь, АР Крым
МОТОРНАЯ МУЛЫИФОКАЛЬНАЯ НЕЙРОПАТИЯ С БЛОКАМИ ПРОВЕДЕНИЯ (ОБЗОР ЛИТЕРАТУРЫ И ОПИСАНИЕ ДВУХ КЛИНИЧЕСКИХ СЛУЧАЕВ)
Резюме. Моторная мультифокальная нейропатия с блоками проведения относится к числу редких демиелинизирующих нейропатий. Статья посвящена вопросам клиники, диагностики, дифференциальной диагностики и лечению данной патологии. Описаны два клинических случая моторной мультифокальной нейропатии.
Ключевые слова: моторная мультифокальная нейропатия, блоки проведения.
Моторная мультифокальная нейропатия (ММН) впервые была описана Льюисом и Самнером (Lewis R.A., Sumner A.J.) в 1982 г. как редкая форма нейропатии со своеобразной клинической картиной: слабость и гипотрофия дистальных групп мышц по типу множественной мононейропатии при отсутствии тоннельного синдрома .
ММН — редкое заболевание, частота встречаемости которого составляет 1—2 случая на 100 000 населения. Мужчины болеют чаще, чем женщины, в среднем 3 : 1. Средний возраст дебюта заболевания составляет 40 лет (до 80 % больных находятся в возрасте 20—50 лет) .
ММН имеет доказанную аутоиммунную природу. R. Kaji с соавторами показали участие анти-ОМ1-ганглиозидов в формировании стойких иммунных комплексов с последующей их фиксацией в миелино-вой оболочке периферических нервов, нарушающих их целостность и препятствующих ремиелинизации . В
сыворотке крови больных ММН выявляются высокие титры IgM (анти-ОМ1-ганглиозидов), обнаруженные A. Pestronk с соавторами в 1988 г. . Их наличием большинство авторов объясняют локальную и стойкую демиелинизацию периферических нервов, так называемых блоков проведения возбуждения (БПВ) . Персистирующая локальная демиелинизация приводит к вторичным аксональным нарушениям и нейротрофи-ческим расстройствам, которые клинически проявляют-
Адрес для переписки с авторами:
Иошина Наталья Николаевна
297000, АР Крым, г. Симферополь, б-р Ленина, 5/7
ГУ «Крымский государственный медицинский университет
имени С.И. Георгиевского»
E-mail: NATALYAIOSHINA@yandex.ru
© Кушнир Г.М., Иошина Н.Н., Самохвалова В.В., Кузина О.С.,
Крылова А.Н., Сидоренко Н.А., Ибрагимова Л.Р., 2014 © «Международный неврологический журнал», 2014 © Заславский А.Ю., 2014
ся формированием локальных амиотрофий в мышцах, иннервируемых пораженными нервами .
Симптомы болезни возникают остро у большинства пациентов, хотя подострое течение также встречается. Асимметричное поражение в начале болезни проявляется у более 90 % пациентов и может сохраняться на протяжении всей болезни. Слабость в дистальных отделах верхних конечностей встречается гораздо чаще, чем в нижних, и выявляется по меньшей мере у 95 % пациентов с ММН. Зачастую поражаются локтевой, срединный, лучевой, малоберцовый и большеберцовый нервы. Слабость разгибания отдельных пальцев является распространенным ранним симптомом. У одной трети пациентов наблюдаются фасцикуляции и судороги. Пациенты могут жаловаться на усталость в пораженной конечности, которая может усугубляться при воздействии холода. Амиотрофия может быть умеренной или даже отсутствовать в некоторых случаях, особенно в первые годы болезни.
Сухожильные рефлексы часто снижены, в частности в пораженных конечностях, но могут быть нормальными или даже оживленными. Чувствительные расстройства, как правило, отсутствуют или минимальны, но могут иметь место парестезии. Поражение вегетативной нервной системы не характерно. Вовлечение черепно-мозговых нервов, а также нервов, иннервирующих дыхательные мышцы, в том числе диафрагмального нерва, наблюдается редко. Степень инвалидизации в целом коррелирует с продолжительностью заболевания .
Клинические критерии и критерии исключения диагноза МНН
Обязательные критерии
1. Медленно или ступенчато прогрессирующая, фокальная, асимметричная (отличие в 1 балл, если мышечная сила больше 3 баллов; отличие в 2 балла, если мышечная сила меньше или равна 3 баллам) слабость конечностей. Двигательные расстройства выявляются не менее чем в двух двигательных нервах на протяжении более 1 месяца (обычно 6 месяцев). Если симптомы распространяются только на 1 двигательный нерв, то ставится вероятный диагноз.
2. Незначительные чувствительные расстройства в дебюте заболевания (но могут развиваться с течением времени).
Вспомогательные клинические критерии
3. Преобладает поражение верхних конечностей (преобладание поражения нижних конечностей встречается в 10 % случаев).
4. Снижение или отсутствие сухожильных рефлексов в пораженной конечности (редко — повышение).
5. Редкое вовлечение черепно-мозговых нервов в процесс.
6. Крампи и фасцикуляции в пораженной конечности.
7. Положительный ответ на иммуномодулирующее лечение.
Критерии исключения
8. Признаки поражения верхнего мотонейрона.
9. Бульбарные расстройства.
10. Значимые сенсорные нарушения в дебюте заболевания.
11. Диффузная симметричная слабость в течение первых недель.
Ключевое значение в диагностике ММН имеет электронейромиография (ЭНМГ), в частности стимуля-ционная. J. Kimura для информативности поиска блоков проведения предложил использовать методику пошагового исследования нерва (метод inching), которая на данный момент является золотым стандартом диагностики заболевания. Данная методика заключается в исследовании 1 или 2 см участка нерва вместо обычных 10 см, что позволяет более точно локализовать участок поражения .
Б.М. Гехт с соавторами выделяют блоки проведения 1-й степени — снижение площади последующего М-ответа по отношению к предыдущему в диапазоне от 25 до 49 % при увеличении длительности М-ответа не более 15 % и блоки проведения 2-й степени — снижение площади последующего М-ответа по отношению к предыдущему на 50 % и более по отношению к предыдущему ответу при увеличении длительности М-ответа не более 15 % .
Электрофизиологические критерии блоков проведения (7)
1. Достоверный блок проведения
— Отсутствует участок снижения потенциала действия двигательной единицы (ПДДЕ) в проксимальном отделе в отличие от дистального отдела при стимуляции не менее 50 % длины нерва (лучевого, локтевого, малоберцового).
— Отрицательная амплитуда ПДДЕ при стимуляции дистального отдела нерва с моторным блоком проведения должна быть > 20 % от нижней границы нормы и > 1 mV.
— Увеличение отрицательного пика ПДДЕ от проксимального до дистального участка протяженностью < 30 %.
2. Вероятный моторный блок проведения*
— Отрицательный пик сокращения площади ПДДЕ по крайней мере на 30 % на протяжении длинного сегмента (например, от запястья до локтя или от локтя до подмышечной впадины) нервов верхней конечности с увеличением длительности отрицательного пика ПДДЕ < 30 % от проксимального до дистального отдела, или:
— Отрицательный пик сокращения площади ПДДЕ по меньшей мере 50 % (так же как достоверный с увеличением проксимальной отрицательной продолжительности ПДДЕ > 30 %).
3. Нормальное проведение по чувствительной порции нерва в сегменте верхней конечности с блоком проведения.
*Блок проведения должен быть выявлен вне мест сдав-ления нервов.
В случае наличия у пациентов клинических и электрофизиологических критериев, соответствующих диагнозу ММН, проведение дальнейших диагностических мероприятий, как правило, не требуется. При сомнительных результатах следует применить вспомогательные методы диагностики, которые представлены ниже.
Вспомогательные критерии диагностики ММН
1. Повышенный титр IgM анти^М1-ганглиозида.
2. Лабораторная диагностика: повышение белка в спинномозговой жидкости (не более 1 г/л).
3. Магнитно-резонансная томография выявляет повышенный сигнал интенсивности в Т2-взвешенных изображениях, связанный с диффузным отеком плечевого сплетения.
4. Объективное клиническое улучшение после лечения иммуноглобулинами.
Следует отметить, что высокие титры ^М анти^М1 сывороточных антител являются наиболее распространенным лабораторным исследованием при ММН. Эти антитела, однако, не являются диагностическим маркером для ММН, так как они могут определяться у больных с другими иммуноопосредованными нейропатиями.
Такие исследования, как биопсия нерва (рис. 1), определение парапротеина в сыворотке крови и моче, определение креатинкиназы, исследование функции щитовидной железы, обычно не рекомендуются пациентам с целью верификации ММН, однако эти тесты могут помочь исключить другие причины нейропатии или выявить сопутствующие заболевания.
Таким образом, на основании комплексного кли-нико-лабораторного, электрофизиологического обследования может быть установлен диагноз достоверной, вероятной и возможной ММН. Критерии постановки соответствующего диагноза даны ниже .
Рисунок 1. Биопсия локтевого нерва в подмышечной области в месте блока проведения. В центре — участок демиелинизации (указан стрелкой), но подлежащие пучки интактны (окраска гематоксилином и эозином, х 1000)
Диагностические критерии ММН
Достоверная ММН
— Клинические критерии 1, 2 и 8—11 (см. клинические критерии и критерии исключения диагноза МНН) и электрофизиологические критерии 1 и 3 в одном нерве (см. электрофизиологические критерии блоков проведения).
Вероятная ММН
— Клинические критерии 1, 2 и 8—11 и электрофизиологические критерии 2 и 3 в двух нервах.
— Клинические критерии 1, 2 и 8—11 и электрофизиологические критерии 2 и 3 в одном нерве и минимум 2 из вспомогательных критериев (см. вспомогательные критерии диагностики ММН).
Возможная ММН
— Клинические критерии 1, 2 и 8—11, нормальное проведение чувствительности и вспомогательный критерий 4.
— Клинические критерии 1 с клиническими проявлениями в одном нерве, 2 и 8—11 и электрофизиологические критерии 1 или 2 и 3 в одном нерве.
Лечение МНН включает внутривенное введение иммуноглобулинов (общая кумулятивная доза — 2 г/кг в течение 2—5 дней).
Если начальное лечение иммуноглобулином является эффективным, то повторное лечение также следует проводить иммуноглобулином. Частота поддерживающей терапии должна определяться ответом на лечение. Типичные схемы лечения иммуноглобулином: 1 г/кг каждые 2—4 недели или 2 г/кг каждые 1—2 месяца.
Если терапия иммуноглобулином недостаточно эффективна или неэффективна, то может быть рассмотрена возможность иммуносупрессивной терапии, однако нет достоверных данных о ее эффективности. В качестве препарата используют циклофосфамид 1 г/м2 в течение 6 месяцев в сочетании с двумя процедурами плазмафереза. Однако токсичность делает циклофос-фамид менее желательным вариантом.
Применение кортикостероидной терапии не рекомендуется .
Приводим два собственных наблюдения.
Больная Ц., 48 лет, поступила в неврологическое отделение ГБ № 7 г. Симферополя с жалобами на онемение IV пальца правой кисти, затруднение сгибания пальцев правой руки в кулак, невозможность их сведения и разведения, ограничение активных движений правой кистью (не может удержать чашку, ложку правой рукой), похудение правой кисти.
Из анамнеза заболевания: считает себя больной в течение двух последних лет, когда возникло ощущение постоянного дрожания в правой кисти, постепенное похудение правой кисти, которые больная связала с профессиональной деятельностью (5 лет работала зачист-чицей деталей на заводе; труд был сопряжен с упором кистей в лучезапястном суставе о стол). В течение после-
дующих 6 месяцев дрожание кисти регрессировало, но постепенно нарастала мышечная слабость, в результате чего больной пришлось оставить работу.
В сентябре 2011 года больная находилась на стационарном лечении в эндокринологическом отделении КРУ КБ им. Семашко по поводу аутоиммунного тиреоидита, где в связи с вышеописанными жалобами была осмотрена невропатологом. Дополнительно была проведена МРТ шейного отдела позвоночника и диагностированы: цервикальная миелопатия в виде вялого пареза, преимущественно дистальных отделов верхних конечностей, больше справа, и пирамидной недостаточности нижних конечностей; остеохондроз шейного отдела позвоночника; протрузия диска С6-С7; нестабильность сегмента QII-IV.
Проведенное лечение (сосудистые, антихолинэсте-разные препараты, витамины группы В, физиотерапия) — без эффекта.
Амбулаторное лечение в марте — июне 2012 года по месту жительства в связи с прогрессирующей мышечной слабостью в правой кисти было также без эффекта.
Из анамнеза жизни: в возрасте 15 лет был выставлен диагноз аутоиммунного тиреоидита, гипотиреоза средней степени тяжести. Также страдает дисметаболической кардиомиопатией, симптоматической артериальной гипертензией, сердечной недостаточностью I ст., хроническим гастритом.
Неврологический статус: общемозговой симптоматики и патологии со стороны черепно-мозговых нервов не выявлено.
Атрофия межкостных мышц, тенара, гипотенара правой кисти. Деформация правой кисти по типу «когтистой лапы». Незначительная мышечная гипотрофия левой кисти. Снижение мышечной силы в сгибателях правой кисти и пальцев, абдукторах и аддукторах пальцев до 3 баллов. Мышечная сила в левой кисти снижена до 4 баллов. Снижены сухожильные рефлексы с двуглавой, трехглавой мышцы, карпорадиальный справа.
Единичные фасцикуляции мышц правого плеча при поколачивании. Гипестезия в зоне иннервации правого локтевого нерва.
Сухожильные рефлексы на нижних конечностях: коленные живые, равномерные; ахилловы снижены. Патологичесих знаков нет. Координаторные пробы выполняет удовлетворительно. Функция тазовых органов не нарушена.
Данные дополнительных методов обследования: общеклинические анализы в норме.
МРТ шейного отдела позвоночника (27.09.2011 г.): остеохондроз шейного отдела позвоночника, протрузия диска С6-С7. Спинной мозг не изменен.
ЭНМГ (04.12.2012 г.): при стимуляции локтевого и срединного нервов справа амплитуда мышечного ответа значительно снижена, резидуальная латентность повышена, моторная скорость проведения возбуждения снижена. При стимуляции лучевого нерва справа амплитуда мышечного ответа, резидуальная латентность и моторная скорость проведения возбуждения в норме. При стимуляции кожно-мышечного и подмышечного нервов справа мышечные ответы с m.biceps brachii и m.deltoideus в пределах нормальных амплитудных значений. При стимуляции срединного нерва слева амплитуда мышечного ответа и резидуальная латентность в норме, скорость проведения возбуждения снижена. При стимуляции локтевого нерва слева амплитуда мышечного ответа, резидуальная латентность и моторная скорость проведения возбуждения в норме. При исследовании F-волны: гигантских и повторных волн нет, по срединному нерву слева и локтевому нерву справа отмечается значительное количество блоков проведения (практически полное отсутствие реализации F-волны). Нарушения проведения возбуждения по чувствительным волокнам не выявлено.
На основании жалоб больной на снижение мышечной силы в правой кисти, хронического прогредиент-ного течения заболевания, наличия асимметричных
Больная Ц., 48 лет
Пациент К., 74 лет
парезов и атрофий дистальных отделов верхних конечностей, а также наличия значительного количества блоков проведения по срединному нерву слева и локтевому нерву справа, по данным ЭНМГ, у пациентки диагностированы: моторная мультифокальная нейропатия с блоками проведения; умеренный парез правой кисти.
Дифференциальная диагностика проводилась с заболеваниями, имеющими похожую клиническую картину, а именно с тоннельной нейропатией, цервикальной миелопатией, боковым амиотрофическим склерозом (БАС), хронической воспалительной демиелинизиру-ющей полинейропатией (ХВДП).
Тоннельные синдромы чаще дебютируют с развития чувствительных расстройств с присоединением в дальнейшем и двигательных, тогда как атрофия возникает на поздних стадиях. У нашей пациентки наблюдался прежде всего двигательный дефицит с мышечными атро-фиями, явно выходящий за рамки мононейропатии при отсутствии значимых сенсорных нарушений в дебюте заболевания. Наличие фасцикуляций и множественных парциальных блоков проведения возбуждения на ЭНМГ также не характерно для капканных синдромов .
Для цервикальной миелопатии характерно сочетание симметричных амиотрофий и пирамидных нарушений. Диагноз уточняется с помощью нейровизуализации (выявление признаков сдавления дурального мешка на шейном уровне) и ЭНМГ .
При наличии БАС у пациентов слабость не ограничивается зонами иннервации нервов и нарастает агрессивнее, интенсивнее формируются амиотрофии, отсутствуют чувствительные расстройства и блоки проведения. Наличие бульбарных расстройств, мышечных фасцикуляций и четких пирамидных знаков, а также быстрое прогрессирование заболевания подтверждают очевидность диагноза БАС .
При ХВДП парезы имеют симметричный характер и зачастую распространяются на проксимальные отделы, кроме того, отмечаются более выраженные нарушения чувствительности. Клинически патологические фас-
цикуляции и начало заболевания с рук позволили исключить ХВДП, которая начинается, как правило, с ног. При ХВДП выявляется выраженное снижение скорости проведения ЭНМГ с увеличением дистальной латенции, отражающее более диффузную демиелинизацию.
Высказывается мнение, что ХВДП и мультифокальная невропатия представляют собой крайние состояния спектра хронических демиелинизирующих полинейропатий, между которыми возможны переходные формы .
Пациент К., 74 лет, находился на стационарном лечении в неврологическом отделении КРУ КТМО «Университетская клиника» с жалобами на слабость, онемение, похудение кистей, затруднение самообслуживания, слабость ног.
Из анамнеза заболевания: болен около 5 лет, когда появились слабость и онемение правой кисти, в дальнейшем присоединилась слабость левой кисти. В течение последних 6 месяцев беспокоит слабость в ногах.
Неврологический статус: общемозговой симптоматики не выявлено. Положительные симптомы орального автоматизма.
Черепно-мозговые нервы: выражена атрофия левой половины языка, фибрилляции левой половины языка. Глотание и фонация не нарушены. Легкая дизартрия. Рефлекс с мягкого неба сохранен. Снижение мышечной силы в сгибателях кистей и пальцев с обеих сторон, больше справа. Гипотрофия межкостных мышц, атрофия гипотенаров больше справа. Гипестезия в зоне иннервации локтевых нервов. Гипотрофия мышц стоп. Сухожильная арефлексия. Походка не нарушена.
МРТ шейного отдела позвоночника: остеохондроз шейного отдела позвоночника. Протрузии дисков С3-С4, С6-С7. Спинной мозг интактен.
ЭНМГ: признаков поражения мотонейронов не выявлено. Отмечаются ЭНМГ-признаки грубого, преимущественно аксонального поражения моторных и сенсорных волокон всех исследуемых нервов верхних и нижних конечностей. При игольчатой ЭМГ в исследуемых мышцах отмечаются изменения, в большей
степени характерные для хронического нейрогенного поражения. Выявлены множественные блоки проведения в моторных волокнах нервов верхних конечностей.
Наличие в клинической картине пациента асимметричных парезов и атрофий дистальных отделов верхних конечностей, гипотрофии стоп, поражения подъязычного нерва (выраженная атрофия половины языка с фасцикуляциями); ЭНМГ, свидетельствующая о грубом, преимущественно аксональном поражении моторных и сенсорных волокон всех исследуемых нервов верхних и нижних конечностей с множественными блоками проведения, указывают на атипичный вариант мультифокальной моторной нейропатии с вовлечением подъязычного нерва.
В заключение следует отметить, что моторная мультифокальная нейропатия с блоками проведения является редкой формой аутоиммунной демиелинизи-рующей нейропатии со своеобразной клинической и электронейромиографической картиной.
Знание критериев диагностики данной патологии и обязательное проведение ЭНМГ необходимы для постановки правильного диагноза и назначения соответствующей терапии. Вместе с тем собственные наблюдения и данные литературы указывают на разнородность больных с ММН, что, в свою очередь, находит подтверждение в анализе патогенетических механизмов, лежащих в основе данной нозологической формы.
Список литературы
2. Хроническая воспалительная демиелинизирующая полиневропатия с острым началом и дыхательной недостаточно-
2 7-ма мська клЫчна лкарня
3 КРУ КТМО «У^верситетська l<лиiнil<а», м. Омферополь, АР Крим
МОТОРНА МУЛЫИФОКАЛЬНА НЕЙРОПАНЯ 3 БЛОКАМИ ПРОВЕДЕННЯ (ОГЛЯД ЛПЕРАТУРИ ТА ОПИС ДВОХ КЛ!Н!ЧНИХ ВИПАДЮВ)
Резюме. Моторна мультифокальна нейропа™ з блоками проведення вщноситься до числа рщшсних дем1елшзуючих нейропатш. Стаття присвячена питанням клшки, д1агностики, диференцшно! д1агностики та лжуванню дано! патологи. Описано два ктшчш випадки моторно! мультифокально! нейропатп.
K™40Bi слова: мультифокальна моторна нейропапя, блоки проведення.
стью / Н.А. Супонева, С.С. Никитин, М.А. Пирадов // Атмосфера. Нервные болезни. — 2007. — № 1. — С. 40-44.
6. Donaghy A.M. Multifocal MotorNeuropathy/A.M. Donaghy// Neurology India. — 2002. — № 50. — P. 408-416.
10. Motor disorders/Edited by David S. Younger. — Philadelphia: Lippincott Williams & Wilkins, 1999. — 548pages.
13. http://www.mif-ua.com/archive/article/29721
14. http://www.fesmu.ru/elib/Article.aspx?id=67868
15. http://www.eurolab.ua/encyclopedia/Neurology.pa-tient/6612
Получено 15.05.14 ■
KushnirG.M.1, loshina N.N.1, Samokhvalova V.V.1, Kuzina O.S.2, Krylova A.N.1, Sidorenko N.A.3, Ibragimova L.R.2
1 State Institution «Crimean State Medical University named after S.I. Georgiyevsky»
2 7th City Clinical Hospital
MULTIFOCAL MOTOR NEUROPATHY WITH CONDUCTION BLOCKS (A LITERATURE REVIEW
Т.Г. САКОВЕЦ, Э.И. БОГДАНОВ УДК б1б.83з-озб-ов
Республиканская клиническая больница М3 РТ, г. Казань
Сенсорные нейропатии: этиология, патогенез, классификация, клинические проявления, диагностика
|Саковец Татьяна Геннадьевна
ассистент кафедры неврологии и реабилитации
420087, г. Казань, ул. Карбышева, д. 17, кв. 5, тел. 8-909-307-94-77, е-таН; tsakovets@yandex.ru
Поражение периферической нервной системы, приводящее к развитию полинейропатии, обусловливает ограничение трудоспособности, инвалидизацию у этой категории больных. Для диагностики сенсорных полинейропатий необходимы: сбор анамнеза с тщательным выявлением сопутствующих соматических нозологий, особенностей питания, наследственного анамнеза, предшествующих нейропатическим проявлениям инфекционных заболеваний, работы больного с токсическими веществами, факта приёма лекарственных средств, тщательный неврологический и физикальный осмотр, проведение ЭНМГ, биопсия кожных нервов, исследование ликвора, крови, рентгенография органов грудной клетки, УЗИ внутренних органов.
Ключевые слова: сенсорные нейропатии, диагностика, классификация, клинические проявления.
T.G. SAKOVETS, E.I. BOGDANOV
Republican Clinical Hospital of Ministry of Health Care of the Republic of Tatarstan, Kazan
Sensory neuropathy: the etiology, pathogenesis, clinical manifestations, diagnosis
Keywords: sensory neuropathy, diagnosis, classification, clinical manifestations.
Поражение периферической нервной системы, приводящее к развитию полинейропатии, обусловливает ограничение трудоспособности, инвалидизацию у этой категории больных. При учёте клинической симптоматики у больных с нейропатией оценивается симметричность, распределение нейропатических нарушений, наследственность, повреждение как тонких, так и толстых (А-а и А-Р) нервных волокон, и наличие соответствующей клинической симптоматики .
Важную роль в развитии целого ряда нейропатий играют ганглиозиды. Ганглиозиды образуют семейство кислых сиали-рованных гликолипидов, состоящих из углеводных и липидных компонентов. Они в основном находятся во внешнем слое плазматической мембраны. Внешнее расположение углеводных остатков позволяет предположить, что такие углеводы
действуют как антигенные мишени при аутоиммунных неврологических расстройствах. Молекулярная мимикрия между ганглиозидами и бактериальными углеводными антигенами (особенно с бактериальным липополисахаридом) может быть ключевым фактором развития целого ряда заболеваний (синдром Миллера-Фишера, энцефалит Биккерстаффа, нейропатия с анти-МДОантителами). Антиганглиозидные антитела могут перекрёстно реагировать с другими гликолипидами и гликопротеинами (ИЫК1эпитоп), включая гликопротеин миелина — Р0, РМР-22, гликолипидами с сульфглюкуронил-параглобазидом и с сульфглюкурониллактозаминил параглобазидом. Недавно была описана ассоциация между цитомегаловирусной инфекцией и анти-ОМ2 антителами. Антитела, связывающиеся с углеводными антигенами наподобие анти-ганглиозид или
анти-MAG (миелин ассоциированный гликопротеин), обнаружены при целом ряде периферических нейропатий. У больных с сенсорными нейропатиями могут наблюдаться признаки поражения вегетативных и моторных волокон .
Особенности сенсорных нарушений при нейропатиях.
С позиций патофизиологии в настоящее время выделяют ноцицептивную и нейропатическую боль. Ноцицептивной называют боль, обусловленную действием повреждающего фактора на болевые рецепторы, при интактности других отделов нервной системы. Под нейропатической подразумевается боль, возникающая при органическом поражении или дисфункции различных отделов нервной системы. При оценке и диагностике нейропатической боли у больных с полинейропатией учитывается распределение нейропатической боли (зона иннервации соответствующих нервов, сплетений и корешков), выявляется взаимосвязь между анамнезом заболевания, вызвавшего нейропатическую боль, и локализацией, и нейроанатомическим распределением самой боли и сенсорных расстройств, оценка наличия позитивных и негативных сенсорных симптомов .
При сенсорных нейропатиях выявляются негативные симптомы нарушения чувствительности: гипестезия/гипалгезия в виде перчаток и носков, нижней части живота. Подобные симптомы чаще всего возникают при хронических воспалительных демиелинизирующих полинейропатиях, при дефиците витаминов В12 и Е, интоксикации витамином В6, при паранео-пластических полинейропатиях. Нарушение периферической чувствительности связано с гибелью или прекращением функционирования по меньшей мере половины афферентных волокон. Эти изменения бывают выражены в различной степени в зависимости от того, как быстро наступает поражение чувствительных волокон. Если процесс хронический и происходит медленно, потерю поверхностной чувствительности при осмотре выявить затруднительно при функционировании даже небольшого количества сенсорных нейронов. В случае быстро развивающегося поражения нервных волокон с большей частотой регистрируются положительные симптомы, хорошо распознающиеся пациентами, в сравнении с клиническими нейропатическими проявлениями, которые развиваются в результате медленно прогрессирующей деафферентации. Расстройства чувствительности на доклинической стадии, не выявляемые при осмотре, могут быть обнаружены исследованием проведения по чувствительным нервам или соматосенсорных индуцированных потенциалов.
К позитивным сенсорным симптомам относятся:
а) болевой синдром при диабетической, алкогольной, амилоидной, паранеопластической, токсических полинейропатиях, при васкулитах, нейроборрелиозе, интоксикации метронида-золом;
б) парестезии (чувство онемения или ползания мурашек без нанесения раздражения);
в) ощущение жжения;
г) гиперестезии;
д) гипералгезия;
е) дизестезия;
ж) гиперпатия;
з) аллодиния.
Появление позитивных симптомов связано с регенерацией аксональных отростков. При поражении волокон, проводящих глубокую чувствительность, развивается сенситивная (чувствительная) атаксия, характеризующаяся шаткостью при ходьбе, которая усиливается в темноте и при закрытых глазах. Моторные нарушения характеризуются периферическими парезами,
начинающимися с дистальных отделов нижних конечностей. Иногда в процесс вовлекаются мышцы туловища, шеи, кра-ниобульбарная мускулатура (при порфирийной, свинцовой, амилоидной, ХВДП, паранеопластической полинейропатиях, синдроме Гийена-Барре). Максимальное развитие гипотрофии наблюдается к концу 3-4 месяца. При наличии спонтанной эктопической генерации нервных импульсов вследствие регенерации возникают нейромиотония, миокимии, крампи, синдром беспокойных ног. Вегетативные симптомы, появляющиеся в результате поражения вегетативных волокон, можно разделить на висцеральные, вегетативно-возомоторные и вегетативнотрофические. Висцеральные симптомы появляются вследствие развития автономной полиневропатии (диабетической, порфирийной, амилоидной, алкогольной и других токсической полинейропатиях, а также синдроме Гийена-Барре).
Классификация нейропатий с учётом типов поражённых сенсорных нервных волокон (Левин С., 2005, Mendell J. R., Sahenk Z., 2003).
1. Сенсорные нейропатии с преимущественным поражением толстых нервных волокон:
— Дифтерийная нейропатия;
— Диабетическая нейропатия;
— Острая сенсорная атактическая нейропатия;
— Диспротеинемическая нейропатия;
— Хроническая воспалительная демиелинизирующая поли-радикулонейропатия;
— Нейропатия при билиарном циррозе печени;
— Нейропатия при критических состояниях.
2. Сенсорные нейропатии с преимущественным поражением тонких нервных волокон:
— Идиопатическая нейропатия тонких волокон;
— Диабетическая периферическая нейропатия;
— MGUS-нейропатии;
— Нейропатии при заболеваниях соединительной ткани;
— Нейропатии при васкулитах;
— Наследственные нейропатии;
— Паранеопластические сенсорные нейропатии;
— Наследственная амилоидная нейропатия;
— Приобретённая амилоидная нейропатия;
— Нейропатия при почечной недостаточности;
— Врождённая сенсорная автономная полинейропатия;
— Полинейропатия при саркоидозе;
— Полинейропатия при отравлении мышьяком;
— Полинейропатия при заболевании Фабри;
— Полинейропатия при целиакии;
— Полинейропатия при ВИЧ-инфекции.
Патофизиология болевых проявлений
при полинейропатиях.
Ввиду того, что диабетическая полинейропатия является наиболее частым и труднокурабельным осложнением сахарного диабета, то патогенез нейропатической боли наиболее хорошо изучен при указанной нозологии.
Для исследования патофизиологии нейропатической боли, как правило, используются экспериментальные модели . Повреждение нерва обусловливает запуск патологических изменений поражённых нейронов, однако до сих пор не совсем ясно, какие из выявленных нарушений определяют инициацию и длительное существование нейропатической боли. У больных с полинейропатией в периферическом нерве не все нейроны повреждаются одновременно. Выявлено, что в поддерживании существования нейропатической боли важную роль играют патологические взаимодействия периферических сенсорных
волокон: при дегенерации эфферентных волокон нерва в расположенных рядом интактных С-волокнах отмечается спонтанная эктопическая нейрональная активность, сенситизация нейронов на фоне экспрессии цитокинов и нейротрофических факторов. Всё это может указывать на значимость в патогенезе болевых расстройств повреждения толстых нервных волокон. Важную роль в сенситизации нервных волокон, возникновении термической гипералгезии при нейропатической боли играет серотонин, действие которого опосредованно 5-гидрокситриптаминовыми 3 рецепторами. Проведение боли при этом связывают с четырьмя основными разновидностями натриевых каналов: Nav1.3, Nav1.7, Nav1.8 и Nav1.9 . Увеличение численности Na-каналов создаёт условия развития нейрогенного воспаления и вторичной центральной сенситиза-ции. Показано, каналы Nav1.7, Nav1.8, Nav1.9 экспрессированы на тонких ноцицептивных волокнах и участвуют в проведении болевой афферентации. Повышенная экспрессия каналов как Nav1.3, которые в норме у взрослых лишь в небольшой степени представлены в периферической нервной системе, так и Nav 1.6 может играть важную роль в повышении возбудимости нейронов и развитии нейропатической боли при повреждении периферических нервов и спинного мозга. Указанные изменения наблюдаются на 1-8 нед. после начала механической аллодинии. Кроме того, ослабление проницаемости для калия в миелиновых волокнах может способствовать повышению возбудимости нейрона.
При нейропатической боли выявляется более низкий порог активации Ар и Аб-волокон на механическую стимуляцию. Увеличение спонтанной активности было найдено в С-волокнах. Гипералгезия при болевых стимулах у больных с полинейропатией может быть связана с повышением уровня циклооксигеназы-2, PG2 как в нейронах дорсального ганглия, так и задних рогах спинного мозга, активацией накопления сорбитола, фруктозы, что указывает на важность в формировании и проведении нейропатической боли проводниковых трактов спинного мозга. В спиноталамическом тракте крыс регистрируется высокая спонтанная активность, увеличение рецепторных полей, также как и более низкий порог ответа нейронов в ответ на механическое раздражение. Нейрогенное воспаление при экспериментальной диабетической полинейропатии в случае болевых проявлений выражено в большей степени в сравнении с недиабетическими нейропатическими болевыми нарушениями. Было выявлено, что аллодиния, возникающая при диабетической полинейропатии, является следствием гибели С-волокон с дальнейшей центральной сенсити-зацией, повреждение Аб-волокон, воспринимающих холодовые стимулы, ведёт к холодовой гипералгезии. Вольтажзависимые кальциевые N-каналы, расположенные в заднем роге спинного мозга, участвуют в формировании нейропатической боли.
Имеются данные об увеличении высвобождения нейротрансмиттеров при активации вольтажзависимых кальциевых каналов. Предполагается, что а2Д-1 субъединица, входящая в состав всех вольтажзависимых кальциевых каналов, является мишенью для антиаллодинического действия габапен-тина. Плотность кальциевых каналов с а2Д-1 субъединицей увеличена в случае индуцированного сахарного диабета, но не при винкристиновой полинейропатии, что указывает на различные механизмы аллодинии при различных типах полинейропатий.
ERK (extracellular signal-regulated protein kinase)-зaвисимaя сигнализация выполняет важную роль в реакциях пролиферации, индуцированных факторами роста, клеточной диффе-ренцировки и цитотрансформационных изменений. При сахарном диабете в экспериментальных моделях выявляется быстрая активация как MARK киназы (the mitogen-activated
protein kinase), так и внеклеточной сигнал-зависимой киназы (ERK 1и 2) компонента ERK-каскада, коррелирующая с началом стерптозицин-индуцированной гипералгезии. Было выявлено в экспериментальных моделях, что применение фактора некроза опухоли TNF-a, связанного с активацией MAPK (p38 mitogen-activated protein kinase), при полинейропатии приводит к увеличению гипералгезии не только в пораженных волокнах, но и интактных нейронах, что может определять различные особенности болевых синдромов (табл. 1). При гипералгезии в патогенезе болевого синдрома важную роль играет активация киназы А. Также в патогенезе боли в экспериментальных моделях при диабетической полинейропатии выявлена значимость локальной гипергликемии в индуцировании механической ги-пералгезии.
Таблица 1.
Особенности болевого синдрома при различных механизмах поражения нейронов
Характеристика боли Вероятный механизм
Поверхностное жжение и покалывание Увеличение активности поврежденных или патологически возбудимых ноцицептивных волокон, особенно регенерирующих.
Колющие, стреляющие, напоминающие электрические разряды (ланценирующие) боли 1. Спонтанная активность и увеличенная механосенситивность тел чувствительных нейронов ганглиев задних корешков. 2. Утрата сегментарного ингибирования толстых миелинизированных и тонких немиелинизированных болевых волокон. 3. Эктопическая импульсация из демиелинизированных участков миелинизированных аксонов. 4. Вызванное физиологической стимуляцией увеличение активности окончаний ноцицептивных афферентов оболочек нервных стволов.
Сжимающие, ноющие мышечные боли Поражение моторных нервов. Рефлекторная петля, в которой ноцицептивный вход активирует мотонейроны спинного мозга, приводя к мышечному спазму, активируется мышечными ноцицепторами, и это замыкает дугу, поддерживая спазм.
Наиболее часто встречаются следующие клинические варианты сенсорных полинейропатий (табл. 2): дистальная симметричная полинейропатия (ДСП), дистальная сенсорная полинейропатия тонких волокон (ДСПТВ), сенсорная нейро-нопатия (СН).
Существуют различные методы инструментальной диагностики при сенсорных нейропатиях.
Методы клинической диагностики.
Необходимо тестировать различные сенсорные волокна, так как возможно селективное вовлечение тонких и/или толстых нервных волокон. Необходимо учитывать, что чувствительность снижается с возрастом и зависит от индивидуальных особенностей пациента (способности к концентрации и понимания задачи). Относительно простым и быстрым способом является использование нейлоновых монофиламентов, обычных игл или булавок.
Исследование болевой чувствительности.
Исследования начинают с определения болевой чувствительности. Порог болевой чувствительности (немиелинизиро-ванные С-волокна) определяется прикладыванием предметов с высокой и низкой температурой или использованием обычных игл или взвешенных игл (уколомер). Исследование болевой чувствительности начинают с изучения жалоб. К числу самых частых жалоб относят жалобу на боль, при опросе больного выясняется характер боли (острая, тупая, стреляющая, ноющая, сжимающая, колющая, жгучая и т.д.), ее распространенность, является ли она постоянной или возникает периодически. Исследуются ощущения при нанесении определенных раздражений; выясняется, как больной их воспринимает. Уколы не должны быть слишком сильными и частыми. Сначала выясняют, различает ли больной на исследуемом участке укол или прикосновение. Для этого попеременно, но без правильной последовательности прикасаются к коже тупым или острым предметом, а больному предлагают определить «остро» или «тупо». Уколы должны быть короткими, не вызывающими резкой болезненности. Для уточнения границы зоны измененной чувствительности исследования проводят как от здорового участка, так и в обратном направлении.
Исследование температурной чувствительности.
Нарушение различения теплого и холодного — результат поражения тонких слабо- и немиелинизированных нервов, отвечающих за болевую чувствительность. Для исследования температурной чувствительности в качестве раздражителей используются пробирки с горячей (+40 °С … +50 °С) и холодной (не выше +25 °С) водой. Исследования проводятся раздельно для тепловой (реализуется Аб-волокнами) и холодовой чувствительности (С-волокна), так как они могут нарушаться в разной степени).
Тактильная чувствительность.
Этот вид чувствительности обеспечивается большими мие-линизированными А-а и А-р волокнами. Может быть использован аппарат Фрея (конский волос разной толщины) и его современные модификации.
Исследование глубокой чувствительности.
Оцениваются функции только толстых миелинизированных волокон.
Вибрационная чувствительность: порог вибрационной чувствительности обычно оценивается на кончике большого пальца ноги и на латеральной лодыжке. Используют калиброванный камертон, ножка которого устанавливается на головку первой
тарзальной кости. Больной должен сначала ощутить вибрацию, а затем сказать, когда она прекратится. Исследователь в этот момент считывает по одной из нанесённых на камертон шкал значения 1/8 октавы. Патологическими являются значения менее 1/4 октавы. Тест повторяется не менее трёх раз. Амплитуда вибрации увеличивается постепенно. Обычно используется камертон, рассчитанный на частоту 128 Гц (если камертон некалиброванный, в норме вибрация ощущается в течение 9-11 секунд). Нарушение вибрационной чувствительности свидетельствует о нарушении глубокой чувствительности.
Суставно-мышечное чувство, связанное с активацией в капсуле суставов и сухожильных окончаниях мышечных веретён при локомоции, оценивается при пассивном движении в суставах конечностей. Инструментальные методы исследования сенсорных нейропатий. Электромиография как метод функциональной диагностики сенсорных нейропатий.
Ключевым в диагностике особенностей повреждения нервного волокна является электромиография (ЭМГ), которая изучает функциональное состояние нервов и мышц. Объектом изучения является двигательная единица (ДЕ) как функциональное ключевое звено нервно-мышечной системы. ДЕ — это комплекс, состоящий из двигательной клетки (мотонейрона переднего рога спинного мозга), её аксона и группы иннервируемых этим аксоном мышечных волокон. ДЕ обладает функциональной целостностью, и поражение одного отдела приводит к компенсаторным или патологическим изменениям в остальных отделах ДЕ. Основные задачи, решаемые при проведении ЭМГ: оценка состояния и функционирования мышцы, нервного аппарата, выявление изменений на уровне нервно-мышечной передачи.
Выделяют следующие методики обследования
при проведении ЭМГ:
Игольчатая ЭМГ:
1. Исследование отдельных потенциалов двигательных единиц (ПДЕ) скелетных мышц;
2. Исследование интерференционной кривой с анализом по Виллисону;
3. Суммарная (интерференционная) ЭМГ;
Стимуляционная ЭМГ:
1. Исследование М-ответа и скорости распространения возбуждения по моторным волокнам (СРВм);
2. Исследование потенциала действия нерва и скорости распространения возбуждения по сенсорным волокнам (СРВс);
3. Исследование поздних нейрографических феноменов (Р-волна, Н-рефлекс, А-волна);
4. Ритмическая стимуляция и определение надежности нервно-мышечной передачи.
Диагностическая ценность методик различна и часто окончательная диагностика проводится на основе анализа многих показателей.
Игольчатая ЭМГ. Изучается спонтанная активность и при минимальном напряжении мышцы, когда генерируются и анализируются потенциалы отдельных ДЕ. В состоянии покоя выявляется несколько феноменов спонтанной активности при патологических изменениях в мышцах.
Положительные острые волны (ПОВ) наблюдаются при необратимой дегенерации мышечных волокон, являются индикатором необратимых изменений гибели мышечных волокон. Укрупнённые ПОВ, увеличенной амплитуды и длительности, говорят о гибели целых комплексов мышечных волокон.
Потенциалы фибрилляций (ПФ) — это потенциалы отдельного мышечного волокна, возникающие в результате денерва-
ции при травматическом или ином поражении любого отдела ДЕ. Возникают чаще на 11-18 день от момента денервации. Раннее возникновение ПФ (на 3-4 день) является неблагоприятным прогностическим признаком, свидетельствующим о значительном поражении нервных волокон.
Потенциалы фасцикуляций (ПФц) спонтанная активность всей двигательной единицы. Возникают при различных вариантах поражения ДЕ, ПФц характерны для нейронального процесса. Некоторые феномены спонтанной активности нозо-логически специфичны (миотонические разряды при миото-ниях).
При мышечном напряжении регистрируют потенциалы двигательных единиц (ПДЕ). Основными параметрами ПДЕ являются амплитуда, длительность, степень полифазии, которые изменяются при патологии ДЕ в виде функциональной и гистологической перестройки. Это находит своё отражение в ЭМГ стадиях денервационно-реиннервационного процесса (ДРП). Стадии различаются между собой по характеру распределения гистограмм длительности ПДЕ, изменению средней, минимальной и максимальной длительности ПДЕ относительно норм, указанных в таблицах. Комплексный анализ электрической активности мышцы позволяет выявить характер компенсаторных изменений в мышце в результате патологического процесса.
Перестройка структуры ДЕ точно отражает уровень поражения отделов ДЕ: мышечный, аксональный, нейрональный.
Исследование М-ответа и скорости распространения возбуждения по двигательным нервам.
Позволяет исследовать функционирование двигательных волокон периферического нерва и, косвенно, судить о состоянии мышцы. Метод позволяет определить уровень поражения нервного волокна, характер поражения (аксональный или де-миелинизирующий), степень поражения, распространённость процесса. При непрямой стимуляции периферического нерва возникает электрический ответ (М-ответ) с мышцы, иннервируемой данным нервом. Для аксонального процесса характерно значительное уменьшение (ниже нормальных показателей) амплитуды М-ответа, полученного при дистальной стимуляции (дистального М-ответа), а также в других точках стимуляции, скоростные показатели страдают в меньшей степени.
Для демиелинизирующего поражения характерно снижение СРВм в 2-3 раза (иногда на порядок). Величина амплитуды дистального М-ответа при этом страдает в меньшей степени. Важным при исследовании М-ответа является определение отражающей проводимость по самым терминальным ветвлениям нерва резидуальной латентности (РЛ), увеличение которой указывает на патологию терминальных ветвлений аксонов.
Поздние нейрографические феномены Р-волна
и Н-рефлекс.
Р-волна является ответом мышцы на импульс, посланный мотонейроном в результате возбуждения его антидромной волной, возникающей при дистальной непрямой стимуляции нерва током супрамаксимальной (по отношению к М-ответу) величины. По своей природе Р-волна рефлексом не является, при этом импульс дважды проходит по самым проксимальным отрезкам нерва двигательным корешкам. Следовательно, анализируя параметры временной задержки (латентности) и скорости распространения Р-волны, мы можем судить о проводимости по самым проксимальным отделам. Так как вторичный ответ обусловлен антидромным раздражением мотонейрона, то, анализируя степень вариабельности амплитуды и латентности Р-волны, можно судить о возбудимости и функциональном состоянии мотонейронов.
H-рефлекс является моносинаптическим рефлексом. У взрослых в норме вызывается в мышцах голени при стимуляции большеберцового нерва током субмаксимальной (по отношению к М-ответу) величины. Импульс проходит путь по сенсорным волокнам, далее по задним корешкам, переключается на мотонейроны. Возбуждение мотонейронов приводит к сокращению мышцы. Так как импульс проходит вверх по чувствительным, а вниз по двигательным аксонам, можно провести оценку проводимости по проксимальным отделам сенсорных и двигательных путей. При анализе соотношения амплитуды Н-рефлекса и М-ответа при нарастании силы стимула, изучается степень возбудимости рефлекторной дуги, сохранность её элементов. Рассчитывая латентность Н-рефлекса и F-волны, при стимуляции из одной точки можно достаточно точно определить поражение сенсорного или двигательного отдела рефлекторной дуги.
Исследование потенциала действия нерва и сенсорной проводимости.
Метод позволяет выявить поражения сенсорных волокон, что особенно важно при диссоциированной полинейропатии.
Соматосенсорные вызванные потенциалы (ССВП).
Применяемые в диагностике дистальной нейропатии тонких волокон соматосенсорные вызванные потенциалы (ССВП) являются универсальным методом диагностики афферентных сенсорных систем. Однако поскольку регистрация ССВП осуществляется при неизбирательной стимуляции нервов, регистрируемый ответ отражает возбуждение толстых нервных волокон. Для оценки функции тонких А-б и С-волокон, а также проводящих путей болевой и температурной чувствительности используются методики стимуляции немиелинизированных С-волокон болевым температурным воздействием, слабомие-линизированных А-б волокон — тепловой стимуляцией. В зависимости от типа стимулятора эти методики подразделяются на лазерные и контактные тепловые вызванные потенциалы (Contact Heat-Evoked Potential- CHEP). У больных с нейропатической болью в начальной стадии полинейропатии, несмотря на нормальную плотность эпидермальных нервов, отмечается снижение амплитуды ответа CHEP, что позволяет использовать этот метод для ранней диагностики дистальной сенсорной полинейропатии тонких волокон.
Ограничивает применение этого метода исследования флюктуация результатов на фоне анальгетической терапии, недифференцированная стимуляция центральной или периферической сенсорных систем.
Биопсия нервов, мышц, кожных покровов.
Биопсия нервов и мышц необходима для дифференциальной диагностики аксональных и демиелинизирующих нейропатий (в первом случае определяются аксональная дегенерация нейронов, группировки мышечных волокон I и II типов, во втором — «луковичные головки» при биопсии нервов, при биопсии мышц — группировки мышечных волокон I и II типов. Биопсия кожи проводится при сенсорной нейропатии с преимущественным поражением тонких волокон (выявляется снижение плотности немиелинизированных и слабомиелинизированных нервных клеток в коже).
Конфокальная микроскопия.
Конфокальная микроскопия является современным неинвазивным методом, позволяющим получать информацию о плотности, длине, морфологии немиелинизированных С-волокон в роговице . Её применение целесообразно для мониторинга процесса повреждения тонких волокон при болезни Фабри, диабетической нейропатии, в последнем случае отмечается
корреляция тяжести диабетической полинейропатии, снижения плотности эпидермальных волокон с денервационно-регенерационными процессами роговицы.
Для диагностики сенсорных полинейропатий необходимы : сбор анамнеза с тщательным выявлением сопутствующих соматических нозологий, особенностей питания, наследственного анамнеза, предшествующих нейропатическим проявлениям инфекционных заболеваний, работы больного с токсическими веществами, факта приёма лекарственных средств, тщательный неврологический и физикальный осмотр с выявлением утолщений, характерных для амилоидоза, болезни Рефсума, демиелинизирующего варианта Шарко-Мари-Тута, проведение ЭНМГ, биопсия кожных нервов (для исключения амилоидоза, саркоидоза, ХВДП), исследование ликвора, крови (клинический и биохимические анализы крови), рентгенография органов грудной клетки, УЗИ внутренних органов.
ЛИТЕРАТУРА
1. Botez S.A., Herrmann D.N. Sensory neuropathies, from symptoms to treatment // Curr. Opin. Neuirol. — 2010. — № 23. — P. 502-508.
2. Overell J.R. Periferal neuropathy: pattern recognition for the pragmatist // Pract. Neurol. — 2011. — № 56. — P. 62-70.
3. Zimmermann M. Pathobiology of neuropathic pain // Eur. J. Pharmacol. — 2001. — № 429. — Р 23-37.
Множество нозологических форм полинейропатий объясняется тем, что, по сути, это заболевание – проявление системного страдания периферической нервной системы при различных неблагоприятных условиях. При этом, несмотря на разнообразие клинических проявлений, синдромальная диагностика полинейропатий не вызывает сложностей. Для синдрома полинейропатии характерно наличие:
– слабости и/или атрофии мышц;
– снижения или выпадения сухожильных рефлексов;
– снижения чувствительности по полинейропатическому типу;
– болевого синдрома в дистальных отделах конечностей;
– вегетативных нарушений в виде расстройств деятельности сердечно-сосудистой, мочевыделительной систем, желудочно-кишечного тракта (ЖКТ), потоотделения и сексуальной функции.
Одними из ключевых критериев, позволяющих выделить полинейропатии из всего спектра поражений периферической нервной системы, являются преимущественно дистальное поражение и относительная симметричность патологического процесса.
Но если диагностика полинейропатии как синдрома, по мнению большинства неврологов, не вызывает значительной клинической сложности, то выделение этиологического фактора, послужившего причиной развития этого процесса, напротив, является относительно трудной задачей. В ряде случаев нозологическая принадлежность полинейропатии так и остается невыясненной. Во многих работах утверждается, что в неспециализированных клиниках количество полинейропатий неуточненной этиологии достигает 50%, а в специализированных – 25% случаев.
При этом поиск причины полинейропатии никак нельзя считать избыточным. Неоспоримым фактом является необходимость выделения этиологического фактора как основного определяющего момента для выработки терапевтической стратегии.
Алгоритм диагностики полинейропатий может быть следующим:
1. Сбор анамнеза.
2. Неврологический осмотр.
3. Общий осмотр.
4. Электронейромиография (ЭНМГ).
5. Лабораторные методы исследования.
6. Инструментальные методы исследования.
7. Исследование цереброспинальной жидкости.
8. Биопсия нервов.
При сборе анамнеза в первую очередь необходимо обратить внимание на недавно перенесенные инфекционные заболевания, длительный прием лекарственных средств, условия работы и проживания, в частности, контакт с токсическими веществами. Семейный анамнез, наличие известных соматических заболеваний и особенности питания также являются определяющими факторами диагностического поиска. Ввиду высокой распространенности алкогольной полинейропатии необходимо особое внимание уделить свидетельствам хронической алкогольной интоксикации. Немаловажными диагностическими признаками являются скорость развития симптомов полинейропатии, течение заболевания и их связь с произошедшими жизненными событиями.
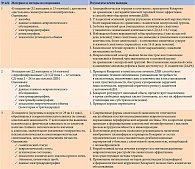
Неврологический осмотр пациента предусматривает как выявление симптомов, характерных для полинейропатий, так и выделение ведущей формы данной патологии. Среди проявлений полинейропатий принято выделять моторные, сенсорные и вегетативные группы признаков. При этом каждая из этих групп может проявляться как негативными, так и позитивными симптомами (табл. 1).
В ходе неврологического осмотра при неясном характере полинейропатии необходима пальпация доступных нервных стволов. Их утолщение может быть свидетельством специфических видов полинейропатий (при лепре, саркоидозе, болезни Рефсума и т.д.). Обследование других систем и функций нервной системы также может дать возможность поставить нозологический диагноз.
Общий осмотр пациента с полинейропатией в условиях неврологического приема по большей части предусматривает осмотр кожных покровов и слизистых, исследование лимфатических узлов, пальпацию живота и измерение АД и пульса. Наличие отклонений в данных осмотра, свидетельствующее о соматической патологии или интоксикации, требует привлечения специалистов соответствующего профиля.
ЭНМГ является одним из наиболее чувствительных методов диагностики полинейропатий и помогает выявить даже субклинические формы. В то же время этот метод исследования определяет неспецифические изменения и не может быть единственным при выставлении нозологического диагноза. Стимуляционная ЭНМГ позволяет оценить скорость и качество проведения импульсов по сенсорным и моторным волокнам периферических нервов, что необходимо для определения уровня и характера (аксонопатии или демиелинизации) поражения.
Лабораторные методы исследования направлены на выявление, в первую очередь, метаболических и токсических нарушений у пациента. Кроме клинического анализа крови целесообразно рекомендовать исследование уровня мочевины, креатинина, гликированного гемоглобина, проведение печеночных проб, ревмопроб. При подозрении на интоксикацию необходимо проведение токсикологического скрининга.
При наличии показаний применяются инструментальные методы исследования соматического статуса, которые включают рентгенографию, ультразвуковое исследование и т.д. Отдельно следует отметить способы исследования вегетативной нервной системы, из которых наиболее доступной и информативной является кардиоинтервалография. Она позволяет судить как о состоянии вегетативной иннервации, так и об эффективности ее регулирующего влияния.
Исследование цереброспинальной жидкости вынесено отдельным пунктом в алгоритме обследования, поскольку ее проведение показано при подозрении на демиелинизирующую полинейропатию, острую или хроническую, а также при поиске инфекционных агентов или неопластического процесса.
Последний пункт предложенного алгоритма – биопсию нервов также нецелесообразно рекомендовать в качестве рутинного метода исследования. Однако она входит в перечень общих клинических критериев диагностики периферических нейропатий и может быть использована при необходимости подтверждения диагноза некоторых форм наследственных полинейропатий, поражения периферической нервной системы при амилоидозе, лепре, саркоидозе и т.д. Инвазивность, количество осложнений и побочных явлений при проведении биопсии служат существенными ограничивающими факторами проведения данной процедуры.
В результате проведенного диагностического процесса, как правило, удается выделить тот или иной вид полинейропатии по одному из предложенных способов классификации. Так, при соматической патологии наиболее часто выделяют следующие виды полинейропатий:
1. Метаболические: уремическая, печеночная, амилоидная.
2. Эндокринные: диабетическая, гипотиреоидная, гипертиреоидная.
3. Токсические: алкогольная, лекарственная, свинцовая, мышьяковая.
4. Инфекционные: дифтерийная, при лепре, СПИДе и т.д.
5. Системные: при системной красной волчанке, узелковом периартериите, склеродермии.
6. Паранеопластические.
Краткая клиническая характеристика наиболее часто встречающихся форм полинейропатий
Уремическая полинейропатия встречается практически у половины больных с хронической почечной недостаточностью. Характерны преимущественно сенсорные или сенсомоторные симметричные дистальные нарушения. Заболевание может дебютировать с крампи (болезненные судороги) и синдрома «беспокойных ног». Затем присоединяются дизестезии, жжение и онемение стоп. Гемодиализ, проводимый при данной патологии, имеет неоднозначное влияние. С одной стороны, отмечается его положительный эффект на течение полинейропатии, с другой – до четверти пациентов отмечают усиление сенсорных симптомов после начала этого вида терапии. Кроме того, формирование артериовенозной фистулы, ассоциированной с диализом, приводит к нарастанию ишемических механизмов повреждения периферических нервов.
Печеночная полинейропатия возникает как при хроническом, так и при остром поражении печени. Наиболее частыми причинами являются первичный билиарный цирроз, алкогольный цирроз, гепатит С. Клиническая картина чаще всего представлена смешанной сенсо-моторной полинейропатией, которая сочетается с энцефалопатией. Признаки вовлечения вегетативной нервной системы – ортостатическая гипотензия, нарушение моторики ЖКТ – приводят к ухудшению прогноза у этой категории пациентов.
Амилоидная полинейропатия развивается у пациентов с первичным наследственным амилоидозом. Проявляется чаще всего болевыми синдромами в сочетании с нарушениями болевой и температурной чувствительности в дистальных отделах конечностей. Моторные и трофические расстройства возникают на поздних стадиях заболевания.
Диабетическая полинейропатия является наиболее распространенной и изученной формой соматических полинейропатий. Чаще всего представлена в виде дистальной симметричной сенсорной формы, которая отличается медленно прогрессирующим течением, начинается с утраты вибрационной чувствительности и выпадения коленных и ахилловых рефлексов. В то же время может проявляться в виде достаточно интенсивного болевого синдрома, с нарастанием алгий в вечернее и ночное время. Многообразие форм поражения периферической нервной системы при сахарном диабете (СД) не позволяет исключить из списка рассматриваемых полинейропатий и преимущественно вегетативную форму с минимальными сенсорными и моторными нарушениями. Она проявляется периферической вегетативной недостаточностью и помимо снижения качества жизни пациентов существенно ухудшает прогноз в связи с развитием вегетативной кардиальной недостаточности. Проксимальная моторная полинейропатия при СД встречается реже и характеризуется амиотрофией, сопровождающейся алгическими нарушениями.
Алкогольная полинейропатия часто развивается подостро. Характерными симптомами являются парестезии в дистальных отделах конечностей, болезненность икроножных мышц во время пальпации, нейропатические боли, явления сенситивной атаксии. В дальнейшем развиваются слабость и парез конечностей, в частности при поражении малоберцового нерва с развитием перонеальной походки. Быстро развиваются гипотония, атрофия парализованных мышц. Сухожильные рефлексы сначала могут быть повышенными, а в дальнейшем снижаются или выпадают. Очень часто наблюдаются вазомоторные, трофические и секреторные расстройства: гипергидроз, отек дистальных отделов конечностей, нарушение их нормальной окраски, изменение температуры кожи. В дифференциальной диагностике этой формы полинейропатии большую роль играет ее сочетание с корсаковским синдромом.
Лекарственная полинейропатия развивается на фоне длительного приема целого ряда медикаментов. Наиболее часто полинейропатия встречается при приеме изониазида, метронидазола, препаратов золота, кардиологических (амиодарон, гидралазин, пергексилин, новокаинамид), онкологических (винкристин, прокарбазин, цисплатин) препаратов. Главными дифференциально-диагностическими признаками данного вида полинейропатий при всем разнообразии клинической картины являются улучшение состояния после отмены препарата и нарастание симптомов после возобновления терапии.
Свинцовая полинейропатия развивается в основном подостро, на протяжении нескольких недель. Заболеванию предшествуют явления общей астенизации, которые проявляются головной болью, головокружением, повышенной утомляемостью, раздражительностью, нарушением сна, снижением памяти. Клинический рисунок нарушения функции периферических нервов при этой форме полинейропатии характеризуется своеобразием: поражение двигательных волокон лучевых нервов предшествует остальным видам расстройств. Если процесс распространяется на нижние конечности, парализуются прежде всего разгибатели стопы. Вместе с параличом дистальных отделов конечностей возникает боль в конечностях и нарушается чувствительность по полиневритическому типу. Течение заболевания обычно длительное – месяцы, а иногда и годы, даже при адекватном лечении, поскольку свинец выводится из организма медленно.
Мышьяковая полинейропатия: при повторных воздействиях небольших количеств мышьяка развивается дистальная симметричная сенсомоторная полинейропатия, при которой доминируют боли и нарушения чувствительности. В случае острого отравления развитие клиники полинейропатии следует за латентным периодом в 2–3 нед. При этом мышечная слабость развивается в основном в нижних конечностях. Имеются выраженные вегетативно-трофические расстройства: гиперкератоз, сухость и нарушение пигментации кожи, вазомоторные расстройства, отеки. На ногтях определяют утолщение в виде белой поперечной полоски (полоска Месса). Наблюдаются выпадение волос, трофические расстройства десен и неба (образуются язвы). Восстановление утраченных функций может продолжаться в течение многих месяцев. Диагностика строится на выявлении мышьяка в моче, волосах и ногтях.
Дифтерийная полинейропатия обусловлена не воспалительным процессом, а токсическим влиянием коринебактерии дифтерии и аутоимунными сдвигами. Разрушение миелина со следующей дегенерацией нервных волокон начинается из конечных разветвлений нервов в мышцах. Генерализированная форма постдифтерийной полинейропатии развивается на 4–7-й нед., в период угасания инфекции. Проявляется периферическим парезом конечностей с арефлексией, затем присоединяются нарушения поверхностной и глубокой чувствительности с развитием сенситивной атаксии.
Полинейропатия при СПИДе встречается почти у 30% больных. Проявляется, как правило, дистальной симметричной, преимущественно сенсорной формой. Обусловлена в основном аксонопатией. Начинается с выпадения вибрационной чувствительности, характеризуется гипералгезией с выраженным болевым компонентом. Данное состояние может усиливаться при лечении инфекционной или неопластической патологии в связи с развитием лекарственной полинейропатии, к которой данная категория пациентов особенно предрасположена.
Полинейропатии при системных заболеваниях могут быть как обусловлены самим патологическим процессом, так и являться результатом поражения печеночной, почечной систем и проведенного вследствие этого лечения (препараты золота и др.). Могут наблюдаться поражения одного нерва, множественная мононейропатия, симметричная сенсорная или сенсомоторная полинейропатия.
Паранеопластические полинейропатии не являются специфичными и встречаются достаточно редко. Проявляются преимущественно моторными, сенсорными или сенсомоторными симптомами. Для этого вида поражения периферической нервной системы характерно подострое развитие выраженного неврологического дефицита с последующей стабилизацией состояния, сопровождающееся воспалительными изменениями в цереброспинальной жидкости.
Принципы терапии полинейропатий при соматической патологии
Лечебные мероприятия при этой патологии должны проводиться с учетом традиционных направлений терапии: этиологического, патогенетического, симптоматического.
Этиологическое лечение, как следует из названия, будет учитывать ведущий этиологический фактор, вызвавший развитие данного вида полинейропатии. Необходимо отметить тот факт, что в ряде случаев устранение причины заболевания является неотъемлемым условием излечения (как при лекарственной полинейропатии). Но, к сожалению, не всегда это достижимо – например, при СД или системном аутоиммунном заболевании возможен только полноценный контроль симптомов. А иногда, как в случае с интоксикацией мышьяком или при дифтерийной полинейропатии, ведущий патологический фактор уже сыграл свою отрицательную роль, и дальнейшее воздействие на него лишено смысла. Не надо также упускать из внимания тот факт, что достаточно большой процент полинейропатий так и остается несистематизированным. Поэтому этиологическое лечение полинейропатий является желаемым, но не обязательным компонентом лечебного процесса, в отличие от патогенетической терапии.
Для патогенетического лечения необходимо воздействие на основной механизм, послуживший причиной развития полинейропатии. В случае демиелинизации и аксонопатии предпочтение отдается витаминотерапии, антиоксидантам и вазоактивным препаратам.
Из широкого спектра антиоксидантов в терапии заболеваний периферических нервов при соматической патологии различного генеза хорошо себя зарекомендовали препараты α-липоевой кислоты. Изучение механизма действия этого вида терапии у больных полинейропатией показало комплексное воздействие на нормализацию эндоневрального кровотока, редукцию оксидативного стресса и улучшение васкулярной дисфункции.
В лечении витаминными комплексами при полинейропатиях предпочтение отдается витаминам группы В. Они оказывают метаболическое влияние на аксональный транспорт и процессы миелинизации в периферических нервных волокнах. Кроме того, воздействие витаминов группы В, в первую очередь тиамина, на центральную нервную систему опосредовано через метаболизм γ-аминомасляной кислоты и серотонина и вызывает анальгетический эффект.
Известно, что тиамин, локализующийся в мембранах нервных клеток, оказывает существенное влияние на процессы регенерации поврежденных нервных волокон, а также участвует в обеспечении энергетических процессов в нервных клетках, нормальной функции аксоплазматического тока. Пиридоксин поддерживает синтез транспортных белков в осевых цилиндрах, кроме того, в последние годы доказано, что витамин В6 имеет антиоксидантное действие. Цианокобаламин влияет на мембранные липиды и участвует в биохимических процессах, обеспечивающих нормальный синтез миелина; необходим для нормального кроветворения и созревания эритроцитов, обладает анальгетическим эффектом. Коферментные формы цианокобаламина – метилкобаламин и аденозилкобаламин – необходимы для репликации и роста клеток. В этой связи данные витамины группы В часто называют нейротропными. Комбинация этих витаминов оказывает положительное действие и на сосудистую систему: так, например, комбинация различных витамеров пиридоксина угнетает агрегацию тромбоцитов, реализуя свой эффект опосредованно через активацию рецепторов к простагландину Е.
Кроме того, недостаток каждого из витаминов группы В может сыграть свою отрицательную роль в формировании клинических проявлений полинейропатий при соматической патологии. При хроническом дефиците тиамина в пище развивается дистальная сенсорно-моторная полинейропатия, напоминающая алкогольную и диабетическую полинейропатии. Дефицит пиридоксина приводит к возникновению дистальной симметричной, преимущественно сенсорной полинейропатии, проявляющейся ощущением онемения и парестезиями в виде «покалывания иголками». Недостаток цианокобаламина проявляется в первую очередь пернициозной анемией. У многих больных с дефицитом витамина В12 развивается подострая дегенерация спинного мозга с поражением задних канатиков, а у относительно небольшого числа больных формируется дистальная сенсорная периферическая полинейропатия, характеризующаяся онемением и выпадением сухожильных рефлексов.
Таким образом, применение комплекса витаминов группы В нашло место во многих клинических рекомендациях по лечению полинейропатий. И одним из представителей грамотно составленных поливитаминных препаратов является Нейромультивит. Сочетанное применение тиамина гидрохлорида в дозе 100 мг, пиридоксина гидрохлорида – 200 мг, цианокобаламина – 200 мкг позволяет достичь значительного нейротропного эффекта, приводящего к благоприятным изменениям в метаболизме нервных волокон. При полинейропатиях различного генеза применение Нейромультивита способно улучшать как структурное, так и функциональное состояние периферической нервной системы.
Определенным преимуществом обладает и лекарственная форма препарата Нейромультивит – таблетка, покрытая пленочной оболочкой. Для пациентов с комплексной соматической патологией применение инъекционных средств зачастую связано с нарастанием постинъекционных осложнений, болевых ощущений и, как следствие, хронического стресса, который значительно понижает их приверженность к терапии. Прием Нейромультивита 2–3 р./сут во время еды является достаточно удобной формой терапии.
Третье направление терапевтической стратегии – симптоматическое лечение полинейропатий. В этом случае из всего комплекса проблем на первый план выходят нарушения вегетативной функции и болевые синдромы. В ряде случаев противоболевая терапия получает поддержку еще на этапе патогенетического лечения. Так, комплексное применение витаминов группы В оказывает доказанное положительное влияние на антиноцицептивную систему, что является крайне важным при лечении нейропатической боли. Коррекция нейропатического болевого синдрома требует применения специфических анальгетиков – антидепрессантов и антиконвульсантов. Но сочетанное влияние витаминов группы В и нестероидных противовоспалительных препаратов способно существенно уменьшить спектр неприятных ощущений. Так, применение препарата Нейродикловит, в котором комплекс витаминов группы В сочетается с диклофенаком (50 мг), успешно приводит к снижению болевых ощущений у пациентов с различными видами полинейропатий.
Наиболее сложной клинической задачей является терапия вегетативных нарушений у пациентов с различными видами полинейропатий. При этом прогноз у них существенно ухудшается вследствие именно нарушения вегетативной регуляции – из-за его негативного влияния на работу сердечно-сосудистой системы. Единых рекомендаций по коррекции данных патологических состояний в настоящее время не разработано. В основном отдается предпочтение немедикаментозным методам терапии ортостатической гипотензии.
Таким образом, диагностика и лечение полинейропатий при соматических заболеваниях являются непосредственной задачей врача-невролога, при решении которой возможно влияние как на состояние периферической нервной системы пациента, так и на прогноз ведущего заболевания и качество жизни этой категории больных в целом.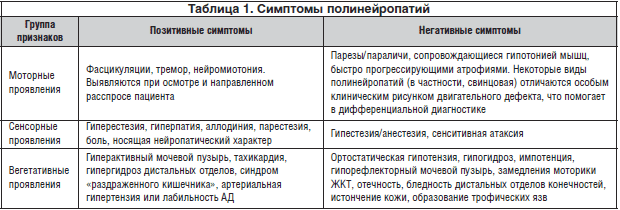
Литература
1. Баранцевич Е.Р., Мельникова Е.В., Скоромец А.А. Патогенетические аспекты неврологических расстройств при сахарном диабете // Ученые записки СПбГМУ им. И.П. Павлова. 1998. Т. 5. № 2. С. 26.
2. Бойко А.Н., Батышева Т.Т., Костенко Е.В., Пивоварчик Е.М., Ганжула П.А., Исмаилов А.М., Лисинкер Л.Н., Хозова А.А., Отческая О.В., Камчатнов П.Р. Нейродикловит: возможность применения у пациентов с болью в спине // Фарматека. 2010. № 7. С. 63–68.
3. Батуева Е.А., Кайгородова Н.Б., Каракулова Ю.В. Влияние нейротрофической терапии не нейропатическую боль и психовегетативный статус больных диабетической нейропатией // Российский журнал боли. 2011. № 2. С. 46.
4. Воробьева О.В. Полинейропатии. Возможности альфа-липоевой кислоты в терапии полинейропатий, ассоциированных с соматическими заболеваниями // Здоровье Украины. 2007. № 6/1. С. 52–53.
5. Курушина О.В., Рыбак В.А., Барулин А.Е., Саранов А.А. Психофизиологические аспекты формирования хронических болевых синдромов // Вестник Волгоградского государственного медицинского университета. 2010. № 02. С. 52–54.
6. Левин О.С. Полинейропатии. М.: МИА, 2005. 496 с.
7. Морозова О.Г. Полинейропатии в соматической практике // Внутренняя медицина. 2007. № 4 (4). С. 37–39.
8. Вгownlee М. Biochemistry and molecular cell biology of diabetic complication // Nature. 2007. Vol. 414 (6865). Р. 613–820.
9. Granados-Soto V., Sanchez-Ramirez G., La-Torre M.R. et al. Effect of diclofenac on the antiallodinic activity of vitamin B12 in a neuropathic pain model in the rat // Proc West Pharmacol Soc. 2004. Vol. 47. P. 92–94.
10. Zambelis T., Karandreas N., Tzavellas E. et al. Large and small fiber neuropathy in chronic alcohol–dependent subject // J Periph Nerv Sys. 2005. Vol. 10. P. 375–338.