Облучение головного мозга последствия
Содержание
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ЛУЧЕВАЯ ТЕРАПИЯ В КОМБИНИРОВАННОМ И КОМПЛЕКСНОМ ЛЕЧЕНИИ МЕТАСТАЗОВ В ГОЛОВНОЙ МОЗГ: ОСНОВНЫЕ ЭТАПЫ, ПЕРСПЕКТИВЫ
Метастатическое поражение головного мозга – серьезное осложнение течения опухолевого процесса, которое отмечается примерно у 50% онкологических больных и чаще всего встречается при раке легкого (34–66%), молочной железы (10–33%), почки, колоректальном раке, меланоме. Пик метастазов приходится на возрастную группу 55-65 лет. В детском возрасте метастазы в мозг возникают чаще при саркоме Юинга, рабдомиосаркоме, нейробластоме и остеогенной саркоме (1, 2).
Характер и серьезность неврологических признаков зависит от размера, числа и расположения метастатических очагов. Приблизительно 80% интракраниальных метастазов локализуются в полушариях мозга, 15-17% находятся в мозжечке, и 3-5% — в базальных ядрах и стволе мозга.
Симптомы и признаки могут быть локальными и/или общими. Клинические проявления развиваются постепенно в течение дней или недель, хотя в некоторых случаях могут возникнуть остро, по типу инсульта или кровоизлияния в мозг. Наиболее общие признаки — головные боли (26-57%), нарушение психики и поведения (22-80%). Могут быть судороги, особенно при метастазах меланомы и хориокарциномы. Реже наблюдаются парестезии, сенсорные дефициты, неустойчивая походка, судорожные подергивания с одной стороны (hemichorea, hemiballismus), диплопия, птоз, атаксия, ортостатическая гипотензия, икота.
При подозрении или выявлении метастазов в головной мозг должно проводиться полное общее обследование, и оно особенно показано пациентам с поражением мозга без выявленной первичной опухоли и больным с известным первичным диагнозом рака, у которых была некоторое время ремиссия. Начальная оценка состояния больного с поражением ЦНС должна проводиться с использованием шкалы Карновского или системы ВОЗ. Обе системы позволяют количественно определить функциональное состояние больного, прогнозировать качество и время жизни, определять объем обследования.
Клинический осмотр больного должен включать тщательную пальпацию всех периферических лимфатических узлов, щитовидной железы, молочных желез, выслушивание легких, обследование брюшной и тазовой области, включая яички, ректальное исследование, осмотр всей кожи для выявления меланомы. Следует выяснить жалобы на боли в костях, потому что метастазы в кости и мозг нередко встречаются вместе.
Тщательная неврологическая оценка часто показывает дефициты, которые пациент не сознавал, особенно локальную слабость и умственные изменения. Следует исследовать зрение, которое отражает кортикальную функцию и внутричерепное давление. До 25% больных с метастазами в мозг имеют отек диска зрительного нерва, изолированный паралич VI (отводящего) нерва может быть неправильно истолкован как локальный симптом, хотя он отражает внутричерепную гипертензию.
Для выявления мозговых метастазов магнитно-резонансная томография (МРТ) является методом выбора. Типичный вид метастаза на МРТ-изображениях — сферическое или близкое к сферической форме образование, хорошо отграниченное от смежного мозга, с окружающим отеком. По данным МРТ, в 65-80% метастазы имеют множественный характер, в то время как компьютерная томография (КТ) мозга почти в 50% определяет метастазы как одиночные. При невозможности провести МРТ следует использовать КТ исследование с контрастированием. Однако при этом могут быть пропущены небольшие очаги, особенно в стволе мозга и мозжечке. В последние годы используются позитронная эмиссионная томография (ПЭТ), эмиссионная однофотонная КТ и недавно внедренная магнитная резонансная спектроскопия, которые позволяют дифференцировать рецидив метастаза от некроза после лучевой терапии. Опыт с указанными методами ограничен и не может быть пока рекомендован в клинику.
При подозрении или установления диагноза метастаза в мозг у онкологического больного следует начать терапию с учетом степени тяжести неврологических симптомов. При выраженном внутричерепном давлении с признаками, предполагающими наличие вклинения мозга, или при эпилептическом состоянии показан маннитол 1 г/кг внутривенно и дексаметазон от 32 до 64 мг внутривенно струйно. Поддерживающие дозы маннитола (0.5-2 г/кг) и дексаметазона (4-10 мг в/в) вводятся, разделенные на 4 дозы. При эпилептическом статусе последовательно вводятся противосудорожные препараты: лоразепам от 1 до 4 мг в/в, далее фосфенитоин 20 мг/кг, в/в, фенобарбитал, пропофол, вплоть до общей анестезии, если нет стойкого эффекта.
При умеренной неврологической симптоматике многие пациенты нуждаются в получении кортикостероидов, противосудорожных или обоих средств. Обзоры литературных данных показали, что 33-81% врачей назначают противосудорожные средства, чтобы предупредить появление судорог. Однако более тщательный анализ данных, проведенный Американской Академией Неврологии, выявил, что противосудорожные средства не эффективны для профилактики судорог у онкологических больных с метастазами. Поэтому противосудорожные средства рекомендуется назначать только пациентам, которые имели судороги. Фенитоин и карбамазепим — наиболее используемые противосудорожные средства, дополненные приемом валпроиловой кислоты и фенобарбитала.
Дексаметазон – глюкокортикоид, наиболее часто используемый для уменьшения отека мозга. Уменьшение отека с последующим клиническим улучшением обычно наблюдается в пределах 1-2 дней. Стандартный подход у больных с симптомами заключается в подведении высокой начальной дозы, от 16 до 32 мг в/в или в/м с последующим снижением дозы до 4-8 мг в/в или per os. При наступлении устойчивого клинического улучшения следует начать медленное снижение доза дексаметазона до самой низкой эффективной, например, по 2 мг каждые 5-7 дней. Следует не забывать, что длительное использование кортикостероидов связано с высокой частотой побочных эффектов, таких как кандидоз полости рта, повышение кислотности желудка, язвенная болезнь, условно-патогенные инфекционные процессы, отсутствие толерантности к глюкозе или свершившийся диабет, артериальная гипертензия, кушингоидные изменения, нарушения сна, личности, остеопороз, аваскулярный некроз, риск тромбоза глубоких вен. Не рекомендуется использовать кортикостероиды у пациентов с отсутствием или минимальными симптомами (1, 2).
Радиационная терапия в виде облучения всего головного мозга (WBRT) — стандартный метод для большинства пациентов с метастазами. В 1971–76 гг. группа RTOG, объединившая 40 институтов США, провела два рандомизированных исследования. У 2000 пациентов с метастазами в головной мозг изучались семь режимов фракционирования дозы облучения. При облучении всего головного мозга использовали разовые дозы 2-2,6-3-4-6-10 Гр, длительность лечения составила от 3-4 недель до 1-2 дней. Несколько лучшие результаты были получены при облучении средними фракциями (2,6-4 Гр). В больших многоцентровых испытаниях, проведенных за последние три десятилетия, не было выявлено преимущество какой либо схемы облучения. Чаще всего облучение всего головного мозга проводится разовыми дозами 3 Гр, 10 фракций, суммарно 30 Гр за 2 недели. После указанной схемы лечения имеется риск возникновения лучевых повреждений примерно у 10% больных, переживших более 9 мес. Этот факт позволил предложить план облучения длительностью 3-4 недели с разовой дозой 2-2,5 Гр для больных с вероятностью выживания больше 9 мес. Однако в рандомизированных испытаниях не подтвердилась надежда на уменьшение постлучевых повреждений мозга при более длительном облучении.
Облучение всего головного мозга в самостоятельном варианте используется у больных с милиарной диссеминацией метастазов, с множественным или ограниченным числом очагов (2-4), но при неблагоприятном прогнозе. Весь мозг облучается при метастазах лимфосарком, мелкоклеточного рака легкого (МРЛ), герминогенных опухолей, при которых хирургическое лечение проводить нецелесообразно, но лучевая терапия обязательно дополняется химиотерапией, к которой опухоли данных локализаций высоко чувствительны.
WBRT проводится с профилактической целью после хирургического удаления одиночных метастазов или при МРЛ, аденокарциноме легкого, лейкозах, учитывая высокий потенциал интракраниального метастазирования при указанных формах первичной опухоли.
Параллельно с лучевой терапией у больных с одиночными метастазами использовался хирургический метод в самостоятельном варианте. При числе метастазов 2-3 хирургическое лечение считалось противопоказанным (3).
Однако в 1993 г. Bindal с соавт. представили ретроспективные данные с анализом результатов лечения 56 пациентов, у которых были удалены 2-3 интракраниальных очага (2 очага — в 51 случае, 3 — в 5 случаях). Авторы определили, что медиана продолжительности жизни при удалении всех метастазов составила 14 мес., а при частичной резекции — только 6 мес. (р=0.003).
После представленных итогов возникли вопросы относительно роли лучевой терапии: необходима ли вообще лучевая терапия после «полной» резекции одиночного метастаза, должна ли послеоперационная лучевая терапия быть локальной или ее следует проводить в виде WBRT.
Ретроспективные исследования, которые изучали роль послеоперационной лучевой терапии при одном метастазе, не сумели ответить на этот вопрос из-за противоречивых результатов. Четко отмечалась меньшая частота рецидива в зоне операции и в других отделах мозга при использовании WBRT, не было единого мнения о пользе для выживаемости, оставалась высокая вероятность развития поздних лучевых повреждений мозга, снижающих качество жизни больных.
Patchell и соавт. опубликовали результаты рандомизированного исследования, определяющего важность включения WBRT. Больные в общем состоянии >70 баллов по шкале Карновского были рандомизированы после полного удаления единичного метастаза в головном мозге. Для увеличения эффекта и снижения возможного нейрокогнитивного ухудшения использовалась классическая лучевая терапия (СОД 50,4 Гр; РОД 1,8 Гр). Анализа данных показал достоверное уменьшение частоты рецидивов (18% против 70%) и причин смерти от неврологической болезни (14% против 44%) у больных с WBRT после хирургического удаления по сравнению с хирургией в самостоятельном варианте. Однако пользы для выживаемости или функциональной независимости больных отмечено не было. Авторы рекомендовали применять WBRT для уменьшения частоты локальных или новых метастазов в головном мозге и снижения вероятности смерти по неврологическим причинам.
WBRT обычно назначается всем пациентам после резекции 2-3 метастазов, даже, когда послеоперационные исследования (КТ и МРТ) не показывают наличие болезни. Высокая вероятность появления новых метастазов в мозге оправдывает применение WBRT после операции, не смотря на потенциальный риск постлучевых изменений. В настоящее время окончательное решение принимается с учетом полноты резекции очагов, чувствительности опухоли к облучению, наличия экстракраниальных метастазов и прогнозирования длительности выживания.
Оценка больших клинических материалов показала, что приблизительно 50% пациентов с метастазами в мозг умирают от неврологических причин (4). Было высказано предположение, что если подводить к метастазам бoльшие дозы, выживаемость может быть увеличена. Были проверены стратегии по увеличению доз облучения с использованием ускоренной гиперфракционной радиотерапии, брахитерапии, фракционированной стереотаксической радиохирургии и стереотаксической радиохирургии (SRS) в виде одной дозы. В последнем десятилетии наиболее активно использовалась SRS с подведением к опухоли всей дозы за один сеанс с минимальной дозой в нормальной ткани мозга.
SRS радиохирургия использует множество мелких, хорошо коллимированых пучков ионизирующего излучения линейного ускорителя или «гамма-ножа» для уничтожения внутричерепных очагов. Анализ 40 нерандомизированных исследований, включавших 2,697 пациентов и 3,922 метастатических очагов, выявил среднюю частоту непосредственного эффекта в 81% случае при использовании SRS.
Активное внедрение в ряде стран SRS для лечения интракраниальных метастазов позволило высказать сомнения в целесообразности использовании WBRT у пациентов с несколькими метастазами.
В настоящее время продолжаются или уже опубликованы предварительные результаты ряда рандомизированных исследований, касающихся более детальной и ясной оценки роли WBRT в сочетании с радиохирургией. Исследование Aoyama и соавт. (5) было проведено в Японии с участием больных с 1-4 метастазами, состоянием ≥70 баллов по шкале Карновского, размерами метастазов по МРТ ≤3 см, получивших радиохирургию в сочетании или без WBRT. Проведено сравнение в группах в зависимости от числа метастазов (1 против 2-4), вида первичной опухоли (легкое против других опухолей), состояния экстракраниальной болезни (есть – нет). WBRT проводилась по схеме 30 Гр за 10 фракций, дозы SRS уменьшались на 30-40% на краях метастазов в группе WBRT+SRS. Первично изучалась выживаемость, вторично – сохранение системных функций (KRS ≥70%), сохранение неврологического статуса (RTOG, стадия ≤2), время, свободное от новых интракраниальных метастазов, поздние неблагоприятные последствия, причины смерти по определению Patchell, частота локального контроля в области поражения.
Медиана продолжительности жизни составила 7.9 мес. и 7.6 мес., метахронные внутримозговые метастазы по прошествии 6 мес. отсутствовали в 48% и 82% (р=0.001) случаев, частота локального контроля метастазов в течение года была 70% и 86% (р=0.001) в группах SRS и WBRT+SRS соответственно. Не было выявлено достоверного различия в показателях выживаемости, причинах смерти, частоте сохранения неврологического и системного состояния больных. Учитывая полученные результаты, отказ от проведения WBRT может быть оправдан, но такой подход допускается только, когда доступно тщательное наблюдение и имеется широкий доступ к методике SRS.
Недавно Manon и соавт. (6) доложили результаты проспективного исследования Eastern Cooperative Oncology Group, в котором WBRT не применяли при 1–3 метастазах саркомы (3 больных), меланомы (14) и рака почки (14), поскольку эти опухоли считаются менее радиочувствительными, и потому польза от WBRT наименее вероятна. Облучали хорошо очерченные очаги с максимальными размерами 4 см в диаметре. При размерах одного из множественных метастазов >3 см, все остальные должны были быть ≤3 см. Не выявлено метастазов в стволе мозга, лептоменингеальной болезни, а также очагов в пределах 10 мм от глазного нерва или хиазмы. Не было предшествующей резекции или лучевой терапии, множественных метастазов в печень, ожидаемое время жизни составляло і3 мес., все больные имели адекватные показатели кроветворения и общее состояние по ECOG 0-2.
Для очагов ≤2 см диаметром использовали дозу 24 Гр, для очагов 2-3 см — 18 Гр, и для очагов большего диаметра (3-4 см) использовали дозу 15 Гр.
Заключение состояло из 4 пунктов:
- первичная SRS сопровождается высокой частотой интракраниального рецидива;
- частота рецидива аналогична таковой после хирургического удаления;
- отказ от WBRT должен быть обдуманным;
- предлагается фаза исследования WBRT+SRS.
Выживаемость — важнейший фактор, определяющий тактику лечения метастазов в головной мозг. Медиана продолжительности жизни у пациентов без лечения составляет приблизительно 1 мес., при добавлении кортикостероидов — 2 мес., после облучения всего головного мозга (WBRT) — 4-6 мес., и 8-9 мес., если используются хирургия или радиохирургия, хотя последние показатели могут быть завышены за счет более строго отбора больных (4).
Начиная с 80 гг., с внедрением новых диагностических методов (КТ, МРТ), основное внимание уделялось совершенствованию методов диагностики внутримозговых метастазов, определению прогностических групп, разработке методов лечения с учетом прогноза. На основе изучения прогностических факторов 1176 больных исследователи RTOG, используя статистический метод, названный рекурсивным парциальным анализом (RPA), выделили три подгруппы (классы). Рекурсивный класс I включал пациентов до 65 лет, в общем состоянии по шкале Карновского ≥70%, излеченной или контролируемой основной опухолью и отсутствием внечерепных метастазов. Эта группа составляла меньше 20% от общей численности пациентов с метастазами в мозг. Класс III включал пациентов в общем состоянии по шкале Карновского <70% независимо от других прогностических факторов, а в класс II вошли все оставшиеся больные. Пациенты I класса имели медиану продолжительности жизни 7.1 мес., III класса — 2.3 мес., II класса — 4.2 мес.
В дальнейшей работе было выявлено, что на выживаемость также влияет ответ метастазов на кортикостероиды и раннее улучшение неврологических симптомов после облучения мозга. Прогностической шкалой предлагается руководствоваться в следующих случаях: отбор больных для активного лечения; информирование пациента о прогнозе; проведение первичного сравнения во время оценки новых лечебных подходов. При определении тактики лечения кроме определения групп прогноза должны учитываться и другие факторы: предполагаемая выживаемость, качество жизни, ответ метастазов на лечение, время сохранения улучшенных показателей статуса больного, неврологической функции, токсичность.
В апреле 2005 г. были опубликованы рекомендации по применению лучевой терапии при метастазах в головной мозг, представленные группой канадских исследователей и базирующиеся на системных обзорах публикаций и мета-анализах. Основные положения рекомендаций представлены ниже (7):
- хирургическое удаление одиночного метастаза должно проводиться у больных с хорошим статусом и возможностью удаления метастаза;
- WBRT должно проводиться для уменьшения риска появления рецидива в зоне операции и в других отделах мозга;
- радиохирургический буст вместе с WBRT может увеличить выживаемость у некоторых больных с нерезектабельным одиночным интракраниальным метастазом;
- весь мозг должен облучаться у больных с множественными метастазами. Стандартная доза 3000 cГр за 10 фракций или 2000 cГр за 5 фракций;
- у отобранных больных радиохирургия вместе с WBRT может увеличивать локальный контроль опухоли. Радиохирургия в самостоятельном варианте может увеличивать выживаемость у отдельных больных;
- радиосенсибилизаторы и химиотерапию в качестве первичного лечения или в сочетании с WBRT рекомендуется использовать только в исследовательских программах.
Оптимальное лечение пациентов с интракраниальными метастазами остается спорным. Предпочтение отдается и в пользу WBRT и локального лечения. Ключевая причина отказа от WBRT – поздняя нейротоксичность, но доказательств этого факта не получено из-за методологических трудностей. Хотя основным пунктом для исследования является выживаемость, существуют определенные трудности в распознавании этого последнего периода. Подавляющее большинство (87%) медицинских и радиационных онкологов указали, что их основная цель в лечении пациентов с метастазами в мозг состоит в том, чтобы стабилизировать или улучшить неврологические симптомы, познавательную (neurocognitive) функцию и качество жизни (QOL). Таким образом, тесты, которые могут оценивать эти функции (например, neurocognitive тесты) должны включаться в современное обследование (табл. 1) (8).
Исторически имелись возражения относительно того, что тестирование познавательной функции не может быть включено в клинические испытания, потому что это слишком обременительно для пациента или невозможно из-за недостатка необходимого нейропсихологического опыта у врачей. В результате эффективность и токсичность определялись состоянием по шкале Карновского, которая использовалась как шкала оценки качества жизни, а данные КТ и МРТ расценивались как близко соответствующие функциям мозга. Однако оценка состоянии по шкале Карновского не обеспечивает получение информации о познавательной функции или восприятии пациентом. Рентгенографические находки типа ненормальности белого вещества мозга (лейкоэнцефалопатия) часто не отражают поведенческие неврологические функции. Несколько недавних исследований показали, что тестирование познавательных функций хорошо переносится пациентами, может быть проведено обученным штатом врачей (хотя тесты должным быть выбраны или обсуждены совместно с нейропсихологом), обеспечивает чувствительную оценку мозговой функции и улучшает прогнозирование выживаемости даже после расчета традиционных прогностических признаков.
Таблица 1.
Шкала краткого исследования психического статуса.
| Оцениваемая функция | Баллы |
|---|---|
| Ориентация во времени по 1 баллу за правильно названные год, время года, месяц, дату и день недели |
5 |
| Ориентация в пространстве по 1 баллу за правильное название страны, региона, города, учреждения, этажа или номера комнаты |
5 |
| Запоминание Повторить название трех предметов (по 1 баллу за каждый предмет) |
3 |
| Внимание и счет Отнять по семи от ста или произнести слово (например, шторм) наоборот (по баллу за каждое правильное вычитание или правильно произнесенную букву) |
5 + 5 |
| Воспроизведение Повторить название трех предметов, запомненных ранее (по 1 баллу за каждый предмет) |
3 |
| Речь
назвать карандаш и наручные часы (по 1 баллу за каждый правильно названный предмет) |
2 1 3 1 1 |
| Конструктивная практика Перерисовать два пересекающихся пятиугольника |
1 |
| Общая оценка | 30 |
| Если общая оценка оказалась менее 24 баллов, как правило, требуется более детальное исследование с целью выявления деменции. |
Неблагоприятные побочные эффекты традиционной лучевой терапии были сгруппированы в три фазы (табл. 2). Не каждый пациент проходит через все фазы. Острая фаза встречается в течение радиационной терапии и включает головную боль, усталость, выпадение волос и обострение предшествующих неврологических дефицитов. В пределах от 2 до 5 мес. после завершения лучевой терапии, появляются признаки отсроченной токсичности, включающей познавательную и исполнительную дисфункцию и уменьшение моторной ловкости. Приобретенные в течение этого периода дефициты часто проходят самостоятельно. Поздняя нейротоксичность появляется через месяцы и годы после лучевой терапии и включает прогрессирующую необратимую деменцию, изменения личности и лейкоэнцефалопатию. Оценка острой и поздней токсичности определяет риск, связанный с излучением и определяет лечебную стратегию. Риск нейротоксичности увеличивается у больных старше 60 лет, при дозах больше 2 Гр за фракцию, при высокой общей дозе, большем объеме облучаемого мозга, гиперфракционированных курсах, более коротком общем временем лечения, одновременной или последовательной химиотерапии и у больных с наличием сопутствующих болезней (сердечно-сосудистой системы, артериальной гипертензии, диабета). В то же время ухудшение познавательной функции может быть выявлено перед облучением и связано с процессом болезни, предшествующим системным лечением или другими сопутствующими неврологическими болезнями. Мейер с соавт. показали, что приблизительно 70–80% пациентов с локализованным мелкоклеточным раком легкого без интракраниальных метастазов имели нарушения познавательной функции перед химиотерапией или радиационной терапией в виде ухудшения устной памяти, исполнительной функции и моторной ловкости. В то же у >90% пациентов с метастазами в мозг до лучевой терапии всего черепа имелиcь нарушения познавательной функции, которые в значительной степени зависели от объема опухоли, но не от числа метастазов, и исходный уровень этой функции был значительным прогностическим признаком выживаемости, помимо обычных используемых показателей прогноза.
Поздние изменения мозга после WBRT имеют особый интерес, поскольку они включают возможность появления деменции. Важно, что деменции, частота которой с течение первого года после WBRT составляла 11%, была выявлена только у пациентов, леченных большими ежедневными фракциями (больше 3 Гр). В то же время приведены веские доводы в пользу того, что лечение крупными фракциями позволяет быстрее получить эффект с улучшением неврологических симптомов и уменьшить время приема поддерживающих лекарств. Кроме того, больные с неблагоприятным прогнозом имеют небольшую выживаемость, и у них не успевает развиться такое серьезное осложнение как деменция. Однако выживаемость у части больных растет, и при хорошем прогнозе больные могут дожить до поздних повреждений, что заставляет изучать факторы, определяющие позднюю нейротоксичность.
Таблица 2.
Лучевые осложнения после облучения черепа.
| Фаза | Признаки | Время появления | Вероятная причина | Лечение |
|---|---|---|---|---|
| Острая | Усталость, головная боль, тошнота, алопеция, эритема кожи черепа, обострение локального неврологического дефицита | Первые 2 недели лучевой терапии | Отек | Кортикостероиды |
| Ранняя отсроченная | Усталость, сонливость, головная боль → познавательная дисфункция → замедленная обработка информации → снижение внимания → неспособность обучения; нарушение памяти → исполнительная дисфункция → нарушение моторной ловкости | 1-6 мес. после лучевой терапии | Демиелинизация | Кортикостероиды, возможно спонтанное улучшение |
| Поздние нарушения | Деменция, изменение личности, лейкоэнцефалопатия, судороги, повышение черепно-мозгового давления, атаксия, дизартрия, несдержанность, оптическая невропатия, индуцированные опухоли | От 6 мес. до нескольких лет после лучевой терапии | Ангиопатия, демиелинизация, некроз | Кортикостероиды, антикоагулянты, вит. Е |
В заключение следует отметить, что решение клинической проблемы должно основываться на оценке прогностических показателей. Это позволяет разделить больных на благоприятные, промежуточные, и неблагоприятные категории и предложить методы лечения (резекцию, облучение, радиохирургию, химиотерапию), которые разработаны в конкретном учреждении и доступны больным.
В странах с большим опытом применения стереотаксической радиохирургии до конца не определено место метода в лечении метастазов: должна ли радиохирургия использоваться в сочетании с WBRT для предупреждения рецидивов и новых метастазов или во время рецидива после WBRT, или использоваться самостоятельно, резервируя WBRT для облучения обширных мозговых рецидивов. В России только набирается опыт лечения с использованием гамма-ножа, нет пока исследований по обоснованному сочетанию радиохирургии с различными методами лечения. В связи с этим общее облучение мозга проводится практически всем больным (после операции, самостоятельно), и при показаниях добавляется локальное облучение отдельных очагов на линейных ускорителях. Дальнейшие исследования должны обязательно включать оценку реакций на облучение всего мозга с изучением познавательной функции путем анкетирования больных с различными первичными новообразованиями, имеющими шанс прожить более 3 мес.
Список литературы
Воздействие радиации на человека
Эффекты воздействия радиации на человека обычно делятся на две категории (рис. 10):
1) Соматические (телесные) — возникающие в организме человека, который подвергался облучению.
2) Генетические — связанные с повреждением генетического аппарата и проявляющиеся в следующем или последующих поколениях: это дети, внуки и более отдаленные потомки человека, подвергшегося облучению.
|
Радиационные эффекты облучения человека |
|
|
Соматические эффекты |
Генетические эффекты |
|
Лучевая болезнь |
Генные мутации |
|
Локальные лучевые поражения |
Хромосомные аберрации |
|
Лейкозы |
|
|
Опухоли разных органов |
|
Рис. 10. Радиационные эффекты облучения человека.
Различают пороговые (детерминированные) и стохастические эффекты. Первые возникают когда число клеток, погибших в результате облучения, потерявших способность воспроизводства или нормального функционирования, достигает критического значения, при котором заметно нарушаются функции пораженных органов. Зависимость тяжести нарушения от величины дозы облучения показана в таблице 30.
Таблица 30.
|
Воздействие различных доз облучения на человеческий организм |
|
| Доза, Гр | Причина и результат воздействия |
| (0.7 — 2) 10-3 | Доза от естественных источников в год |
| 0.05 | Предельно допустимая доза профессионального облучения в год |
| 0.1 | Уровень удвоения вероятности генных мутаций |
| 0.25 | Однократная доза оправданного риска в чрезвычайных обстоятельствах |
| 1.0 | Доза возникновения острой лучевой болезни |
| 3- 5 | Без лечения 50% облученных умирает в течение 1-2 месяцев вследствие нарушения деятельности клеток костного мозга |
| 10 — 50 | Смерть наступает через 1-2 недели вследствие поражений главным образом желудочно кишечного тракта |
| 100 | Смерть наступает через несколько часов или дней вследствие повреждения центральной нервной системы |
Хроническое облучение слабее действует на живой организм по сравнению с однократным облучением в той же дозе, что связано с постоянно идущими процессами восстановления радиационных повреждений. Считается, что примерно 90% радиационных повреждений восстанавливается.
Стохастические (вероятностные) эффекты, такие как злокачественные новообразования, генетические нарушения, могут возникать при любых дозах облучения. С увеличением дозы повышается не тяжесть этих эффектов, а вероятность (риск) их появления. Для количественной оценки частоты возможных стохастических эффектов принята консервативная гипотеза о линейной беспороговой зависимости вероятности отдаленных последствий от дозы облучения с коэффициентом риска около 7 *10-2 /Зв. (Таблица 31).
Таблица 31.
| Число случаев на 100 000 человек при индивидуальной дозе облучения 10 мЗв. | ||||
| Категории облучаемых |
Смертельные случаи рака |
Несмертельные случаи рака |
Тяжелые наследуемые эффекты |
Суммарный эффект: |
| Работающий персонал |
4.0 | 0.8 | 0.8 | 5.6 |
| Все население * | 5.0 | 1.0 | 1.3 | 7.3 |
* Все население включает не только как правило здоровый работающий персонал, но и критические группы (дети, пожилые люди и т.д.)
Радионуклиды накапливаются в органах неравномерно. В процессе обмена веществ в организме человека они замещают атомы стабильных элементов в различных структурах клеток, биологически активных соединениях, что приводит к высоким локальным дозам. При распаде радионуклида образуются изотопы химических элементов, принадлежащие соседним группам периодической системы, что может привести к разрыву химических связей и перестройке молекул. Эффект радиационного воздействия может проявиться совсем не в том месте, которое подвергалось облучению. Превышение дозы радиации может привести к угнетению иммунной системы организма и сделать его восприимчивым к различным заболеваниям. При облучении повышается также вероятность появления злокачественных опухолей.
В таблице 32 приведены сведения о накоплении некоторых радиоактивных элементов в организме человека.
Организм при поступлении продуктов ядерного деления подвергается длительному, убывающему по интенсивности, облучению.
Наиболее интенсивно облучаются органы, через которые поступили радионуклиды в организм (органы дыхания и пищеварения), а также щитовидная железа и печень. Дозы, поглощенные в них, на 1-3 порядка выше, чем в других органах и тканях. По способности концентрировать всосавшиеся продукты деления основные органы можно расположить в следующий ряд:
щитовидная железа > печень > скелет > мышцы.
Так, в щитовидной железе накапливается до 30% всосавшихся продуктов деления, преимущественно радиоизотопов йода.
По концентрации радионуклидов на втором месте после щитовидной железы находится печень. Доза облучения, полученная этим органом, преимущественно обусловлена радионуклидами 99Мо, 132Te,131I, 132I, 140Bа, 140Lа.
Таблица 32.
|
Органы максимального накопления радионуклидов. |
||||
| Элемент | Наиболее чувствительный орган или ткань. |
Масса органа или ткани, кг | Доля полной дозы * | |
| Водород | H | Все тело | 70 | 1.0 |
| Углерод | C | Все тело | 70 | 1.0 |
| Натрий | Nа | Все тело | 70 | 1.0 |
| Калий | К | Мышечная ткань | 30 | 0.92 |
| Стронций | Sr | Кость | 7 | 0.7 |
| Йод | I | Щитовидная железа | 0.2 | 0.2 |
| Цезий | Сs | Мышечная ткань | 30 | 0.45 |
| Барий | Ва | Кость | 7 | 0.96 |
| Радий | Rа | Кость | 7 | 0.99 |
| Торий | Тh | Кость | 7 | 0.82 |
| Уран | U | Почки | 0.3 | 0.065 |
| Плутоний | Рu | Кость | 7 | 0.75 |
* Относящаяся к данному органу доля полной дозы, полученной всем телом человека.
Среди техногенных радионуклидов особого внимания заслуживают изотопы йода. Они обладают высокой химической активностью, способны интенсивно включаться в биологический круговорот и мигрировать по биологическим цепям, одним из звеньев которых может быть человек (рис. 11).
Основным начальным звеном многих пищевых цепей является загрязнение поверхности почвы и растений. Продукты питания животного происхождения — один из основных источников попадания радионуклидов к человеку.
Исследования, охватившие примерно 100000 человек, переживших атомные бомбардировки Хиросимы и Нагасаки, показывают, что рак — наиболее серьезное последствие облучения человека при малых дозах. Первыми среди раковых заболеваний, поражающих население, стоят лейкозы (рис. 12).
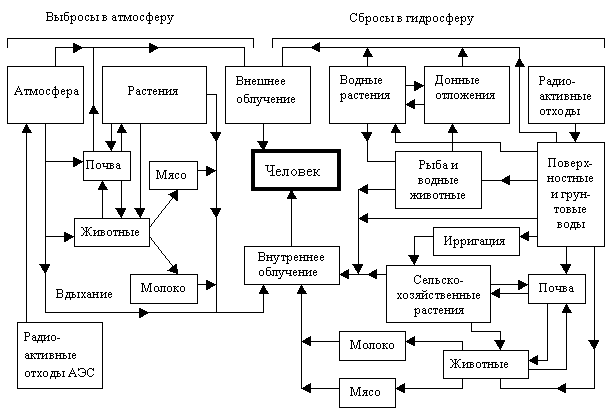
Рис.11. Пути воздействия радиоактивных отходов АЗС на человека.
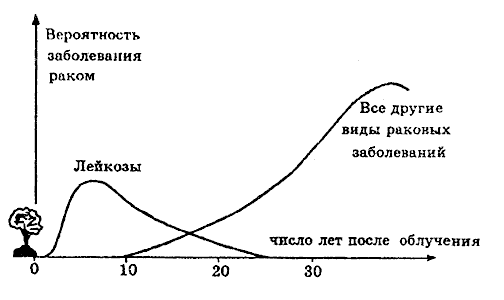
Рис. 12. Относительная среднестатистическая вероятность заболевания раком после получения однократной дозы в 1 рад (0.01 Гр) при равномерном облучении всего тела.
Распространенными видами рака под действием радиации являются рак молочной железы и рак щитовидной железы. Обе эти разновидности рака излечимы и оценки ООН показывают, что в случае рака щитовидной железы летальный исход наблюдается у одного человека из тысячи, облученных при индивидуальной поглощенной дозе один Грей.
Данные по генетическим последствиям облучения весьма неопределенны. Ионизирующее излучение может порождать жизнеспособные клетки, которые будут передавать то или иное изменение из поколения в поколение. Однако анализ этот затруднен, так как примерно 10% всех новорожденных имеют те или иные генетические дефекты и трудно выделить случаи, обусловленные действием радиации. Экспертные оценки показывают, что хроническое облучение при дозе 1 Грей, полученной в течение 30 лет, приводит к появлению около 2000 случаев генетических заболеваний на каждый миллион новорожденных среди детей тех, кто подвергался облучению.
В последние десятилетия процессы взаимодействия ионизирующих излучений с тканями человеческого организма были детально исследованы. В результате выработаны нормы радиационной безопасности, отражающие действительную роль ионизирующих излучений с точки зрения их вреда для здоровья человека. При этом необходимо помнить, что норматив всегда является результатом компромиса между риском и выгодой.
![]()
![]()
Где и какие дозы мы можем получит? Примеры.
Последствия и побочные эффекты после облучения опухоли головного мозга зависят от назначенного плана и дозировки лучевой терапии. Обычно побочные эффекты после лучевой терапии проявляются через 2-2,5 недели после начала лечения. Основными побочными эффектами после облучения опухоли головного мозга являются:
- тошнота и рвота;
- головная боль;
- выпадение волос;
- покраснение и сухость кожи головы;
- потеря аппетита;
- проблемы со слухом;
- повышенная усталость и слабость;
- нарушения памяти или речи;
- нарушение сна;
- временное нарушение мозговой активности.
К наиболее распространенным побочным эффектам после облучения относят потерю волос (частичное облысение) и раздражение кожи головы. Степень облысения у каждого пациента проявляется по-разному, но в любом случае, после завершения облучения волосы отрастают заново. Изначально они могут быть немного мягче и иметь несколько другой цвет, но, со временем, приобретут обычный вид.
Раздражение кожи головы после облучения, как правило, охватывает только ее волосистую часть и область вокруг ушей, и может сопровождаться зудом, сухостью, покраснением, отеком, изменением пигментации. Иногда такой побочный эффект имеет вид ожога. О таких симптомах нужно обязательно сообщать лечащему врачу и не лечить их самостоятельно. После предварительного осмотра врач назначит соответствующее лечение и разъяснит правильную методику ухода за кожей головы.
Практически у всех пациентов наблюдаются такие последствия облучения, как повышенная утомляемость, сонливость, слабость, потеря аппетита. Это связано с тем, что лучевая терапия приводит к гибели клеток, вследствие чего они распадаются и попадают в кровь, оказывая тем самым токсическое воздействие на организм. Данные симптомы обычно длятся около 2-х недель и проходят самостоятельно.
Для минимизации неприятных ощущений и улучшения самочувствия после лучевой терапии венгерские врачи назначают ряд поддерживающих средств – стимулирующих аппетит, понижающих рвотные позывы, улучшающи[ состояние кожи в месте облучения, при необходимости – обезболивающие, и другие препараты, в зависимости от проявления побочных эффектов у пациента. Также пациенту рекомендуется полноценный отдых, сбалансированное питание, легкая гимнастика (в т.ч. дыхательная), прогулки на свежем воздухе.
Лечение в Европе осуществляется при использовании наиболее щадящих эффективных методик облучения, что позволяет свести риск осложнений к минимуму. К тому же лечение рака у детей и взрослых и других патологий организма лучевой терапией проводится с помощью самого современного оборудования (в т.ч. установки «Гамма-нож»), усовершенствованные технологии которого значительно уменьшают вероятность проявления неприятных последствий для пациента.
Лучевая терапия с помощью «Гамма-ножа»
Опубликовано в 2016, Выпуск Август 2016, МЕДИЦИНСКИЕ НАУКИ | Нет комментариев
Сухоручкин А.А.1, Бахметьев А.С.2, Сухоручкин В.А.3
1ORCID: 0000-0001-8039-1600, Врач ультразвуковой диагностики ООО «Стройград», Частная клиника «Медицинский центр», г. Кирсанов, 2ORCID: 0000-0003-3814-5515, Ассистент кафедры лучевой диагностики и лучевой терапии им. Н.Е. Штерна, ГБОУ ВПО «Саратовский ГМУ им. В.И. Разумовского» Минздрава РФ, 3ORCID: 0000-0003-0862-7476, Студент лечебного факультета ГБОУ ВПО «Саратовского ГМУ им. В.И. Разумовского» Минздрава РФ
ВЛИЯНИЕ ЭЛЕКТРОМАГНИТНОГО ИЗЛУЧЕНИЯ МОБИЛЬНОГО ТЕЛЕФОНА НА АРТЕРИИ ГОЛОВНОГО МОЗГА
Аннотация
В статье проведен анализ воздействия электромагнитного излучения работающего в режиме разговора мобильного радиотелефона на тонус средней и передней мозговых артерий. Среди исследуемых 80 добровольцев спазм в бассейне указанных мозговых артерий возник более чем в 88% случаях. Показаны и детально проанализированы динамические изменения линейной скорости кровотока и индекса резистентности в каждом из бассейнов внутримозговых артерий при разговоре по мобильному радиотелефону длительностью 7 минут.
Ключевые слова: электромагнитное излучение, средняя мозговая артерия, передняя мозговая артерия.
Sukhoruchkin A.A.1, Bakhmetev A.S.2, Sukhoruchkin V.A.3
EFFECT OF MOBILE PHONE’S ELECTROMAGNETIC RADIATION FOR CEREBRAL ARTERIES
Abstract
Keywords: electromagnetic radiation, middle cerebral artery, anterior cerebral artery.
Быстрое развитие технического прогресса последних десятилетий привело к резкому ухудшению техногенной обстановки в крупных населенных пунктах, что в наши дни заставляет на всех уровнях активно обсуждать тему экологии организма и головного мозга. Неблагоприятное воздействие электромагнитных излучений (ЭМИ) на здоровье организма человека изучено достаточно хорошо, в том числе и на больших статистических выборках в различных странах . Доказано, что технопатогенным излучениям наиболее подвержен мозг человека, в результате чего в организме сначала развиваются функциональные нарушения, а затем уже и более серьезные изменения (инсульт, инфаркт, онкологические заболевания и т.д.) . В 2011 году Всемирная организация здравоохранения и Международное Агентство по изучению рака отнесли мобильные телефоны к потенциальным канцерогенам группы 2В . Крупное статистическое исследование в Великобритании подтвердило, что число людей с выявленной опухолью мозга за последние 30 лет увеличилось почти на 50% . В одном из самых крупных исследований (Международное сотрудничество Interphone – 12800 пациентов из 13 стран) была показана прямая зависимость развития глиомы и ЭМИ от мобильных телефонов.
Известно, что использование телефона в режиме разговора более 10 минут в сутки приводит к повышению температуры подкожно-жирового слоя облучаемого участка на 4-5 градусов по Цельсию . Наконец, доказано, что мобильные телефоны оказывают вредное воздействие на эндокринную и иммунную системы ребенка, вызывая головные боли, а также провоцируя ослабление памяти и изменение структуры сна .
В различных исследованиях изучается влияние ЭМИ на психоэмоциональный статус человека, на корреляцию между продолжительностью телефонного разговора и развитие возможного онкологического процесса и т.д. Но ни в одной из найденных работ не было показано влияние ЭМИ на магистральные интракраниальные артерии. Известно, что стойкий спазм мозговых сосудов вызывает упорные головные боли, снижает работоспособность, вызывает раздражение, утомляемость и нарушение сна .
Цель исследования: изучить влияние ЭМИ мобильного телефона стандарта GSM в режиме разговора на резистентность магистральных артерий головного мозга.
Материал и методы. В исследование были включены 80 добровольцев в возрасте 18-70 лет (мужчин – 30, женщин – 50, средний возраст – 37,5 лет) с доступными транстемпоральными акустическими окнами без хронических заболеваний, способных повлиять на центральную гемодинамику (артериальная гипертензия, сахарный диабет, хроническая ишемия головного мозга, ишемическая болезнь сердца и т.д.). Из исследования были исключены пациенты со стенозирующим атеросклерозом брахиоцефальных артерий, а также со спазмом в бассейне средней мозговой артерии (СМА) и передней мозговой артерии (ПМА). Исследование проводилось в положении лежа на спине с включенным в руке исследуемого мобильным телефоном в режиме разговора в течение 7 минут. Измеряли линейную скорость кровотока (ЛСК) и индекс резистивности (RI) в СМА и ПМА с обеих сторон. Спазмом мозговых сосудов считалось превышение RI 0,65 и более. Индекс RI при слабовыраженном спазме ПМА и СМА колебался в диапазоне 0,65-0,69, при умеренно-выраженном – от 0,7 до 0,74 и при выраженном спазме – более 0,75. Показатели ЛСК и RI по обеим СМА и ПМА измерялись до начала проведения исследования, затем после 1, 5 и 7 минуты разговора по мобильному телефону. С целью минимизирования погрешности измерений использовали одинаковый современный мобильный телефон для всех добровольцев. Ультразвуковые исследования проводились на стационарном аппарате экспертного класса Philips HD 11 XE (производство – Голландия) фазированным секторным датчиком с частотой 2-4 МГц на базе отделения ультразвуковой и функциональной диагностики Клинической больницы им. С.Р. Миротворцева СГМУ (г. Саратов), а также на базе клиники «Медицинский центр» (г. Кирсанов, Тамбовская область) на приборе экспертного класса Mindray DC-8 фазированным датчиком с частотой 2-4 МГц.
Результаты. При анализе полученных данных выявили увеличение ЛСК и RI в бассейне СМА абсолютно у всех добровольцев (100%) уже к исходу 3 минуты разговора. К 7 минуте ультразвуковые признаки спазма хотя бы одной СМА были выявлены у 70 (87,5%, средний RI – 0,715, средняя ЛСК – 88±19,7 см/сек) из 80 исследуемых человек. Среднее значение прироста RI составило 0,24 (минимальное повышение – 0,16, максимальное – 0,31), что в большинстве случаев (61,25% от общего количества человек со спазмом в СМА) вызвало появление умеренно-выраженного спазма с обеих сторон. Слабовыраженный спазм в бассейне обеих СМА возник у 14 (17,5%) добровольца, умеренно-выраженный – в 40 (50%) случаях и выраженный у 7 (8,75%) человек. Односторонний спазм СМА (у всех добровольцев умеренно-выраженного характера) возник в 9 (11,25%) случаях, причем во всех случаях – на контрлатеральной от мобильного телефона стороне. Полученные результаты не зависели от пола, возраста и исходного артериального давления.
Увеличение ЛСК и RI в бассейне ПМА к исходу 3 минуты разговора выявили 28 (35%) человек, к окончанию разговора – в 66 (82,5%, средний RI – 0,677, средняя ЛСК – 71±11,5 см/сек) случаях. Спазм с обеих сторон по ПМА к исходу 7 минуты выявили у 55 (68,75%) добровольцев. Преобладали (50 случаев – 62,5%) слабовыраженные индексы спазма RI в диапазоне 0,65-0,69. Умеренно-выраженный спазм ПМА с обеих сторон возник у 3 (3,75%) человек. Выраженный спазм возник в 2 (2,5%) случаях. Односторонний спазм по ПМА встретился у 5 (6,25%) добровольцев (во всех случаях – на контрлатеральной от мобильного телефона стороне). Среднее значение прироста RI составило 0,198 (минимальное повышение – 0,11, максимальное – 0,29). Как и в случае с СМА, зафиксированные изменения в бассейне ПМА не коррелировали с возрастом, полом и артериальным давлением, измеренным непосредственно перед проведением исследования. Общее количество случаев, в которых к концу длительного разговора по мобильному телефону возник спазм обеих СМА и обеих ПМА – 71 (88,75%). В одном случае у добровольца 24 лет был зафиксирован двусторонний спазм по обеим ПМА (RI в диапазоне 0,66-0,68) в отсутствие повышения RI по СМА (не более 0,61-0,63).
Выводы. Длительный разговор (более 5 минут) по мобильному телефону в большинстве случаев (88,75%) приводит к спазму в бассейне магистральных мозговых артерий у лиц трудоспособного возраста, что несомненно может говорить о высокой значимости ЭМИ как фактора риска возникновения головной боли и других многочисленных отрицательных психоэмоциональных факторов (отсутствие внимания, нарушение структуры сна, раздражительность, ухудшение памяти и т.д.). При сравнении возникновения спазма между СМА и ПМА можно утверждать, что в большинстве случаев первой реагирует СМА. Общее количество спазмированных СМА превосходит количество спазмированных ПМА (131 СМА против 115 ПМА). Примечательно и в то же время требует проведения дополнительного исследования то, что в случае одностороннего изменения RI как в бассейне СМА, так и в бассейне ПМА, спазм в большинстве случаев возникал на контрлатеральной от мобильного телефона стороне.
Литература
References