Механизм действия глюкагона
Эффекты глюкагона, как правило, противоположны эффектам инсулина. Если инсулин способствует запасанию энергии, стимулируя гликогенез, липогенез и синтез белка, то глюкагон, стимулируя гликогенолиз и липолиз , вызывает быструю мобилизацию источников потенциальной энергии с образованием глюкозы и жирных кислот соответственно. Глюкагон — наиболее активный стимулятор глюконеогенеза ; кроме того, он обладает и кетогенным действием.
Печень — основная мишень глюкагона. Связываясь со своими рецепторами на плазматической мембране гепатоцитов, глюкагон активирует аденилатциклазу . Генерируемый при этом сАМР в свою очередь активирует фосфорилазу , которая ускоряет распад гликогена, а одновременное ингибирование гликогенсинтетазы тормозит образование последнего. Для этого эффекта характерна и гормональная, и тканевая специфичность: глюкагон не влияет на гликогенолиз в мышце, а адреналин активен и в мышцах и в печени.
Повышенное содержание сАМР индуцирует ряд ферментов глюконеогенеза, стимулируя превращение аминокислот в глюкозу. Главная роль среди этих ферментов принадлежит ФЕПКК . Глюкагон опосредованно через сАМР повышает скорость транскрипции гена ФЕПКК , стимулируя тем самым синтез больших количеств ФЕПКК. Этот эффект противоположен действию инсулина, который подавляет транскрипцию гена ФЕПКК. Другие примеры приведены в табл. 51.7 .
Суммарный эффект глюкагона в печени сводится к повышенному образованию глюкозы. Поскольку большая ее часть покидает печень, концентрация глюкозы в крови под влиянием глюкагона повышается.
Глюкагон — мощный липолитический агент. Повышая содержание сАМР в адипоцитах , он активирует гормон-чувствительную липазу . Образующиеся при этом в большом количестве жирные кислоты могут использоваться в качестве источников энергии или превращается в кетоновые тела ( ацетоацетат и бета-гидроксимасляная кислота ). Это важный аспект метаболизма при диабете , поскольку при инсулиновой недостаточности содержание глюкагона всегда повышено.
Глюкагон впервые был обнаружен в коммерческих препаратах инсулина еще в 1923 г., однако только в 1953 г. венгерский биохимик Ф. Штрауб получил этот гормон в гомогенном состоянии. Глюкагон синтезируется в основном в α-клетках панкреатических островков поджелудочной железы, а также в ряде клеток кишечника (см. далее). Он представлен одной линейно расположенной полипептидной цепью, в состав которой входит 29 аминокислотных остатков в следующей последовательности:
Н–Гис–Сер–Глн–Гли–Тре–Фен–Тре–Сер–Асп–Тир–Сер–Лиз–Тир–Лей– –Асп–Сер–Aрг–Aрг–Ала–Глн–Асп–Фен–Вал–Глн–Трп–Лей–Мет–Асн–
–Тре–ОН
Первичная структура глюкагонов человека и животных оказалась идентичной; исключение составляет только глюкагон индюка, у которого вместо аспарагина в положении 28 содержится серин. Особенностью структуры глюкагона является отсутствие дисульфидных связей и цистеина. Глюкагон образуется из своего предшественника проглюкагона, содержащего на С-конце полипептида дополнительный октапептид (8 остатков), отщепляемый в процессе постсинтетического протеолиза. Имеются данные, что у проглюкагона, так же как и у проинсулина, существует предшественник – препроглюкагон (мол. масса 9000), структура которого пока не расшифрована.
По биологическому действию глюкагон, как и адреналин, относятся к гипергликемическим факторам, вызывает увеличение концентрации глюкозы в крови главным образом за счет распада гликогена в печени. Органами-мишенями для глюкагона являются печень, миокард, жировая ткань, но не скелетные мышцы. Биосинтез и секреция глюкагона контролируются главным образом концентрацией глюкозы по принципу обратной связи. Таким же свойством обладают аминокислоты и свободные жирные кислоты. На секрецию глюкагона оказывают влияние также инсулин и инсулиноподобные факторы роста.
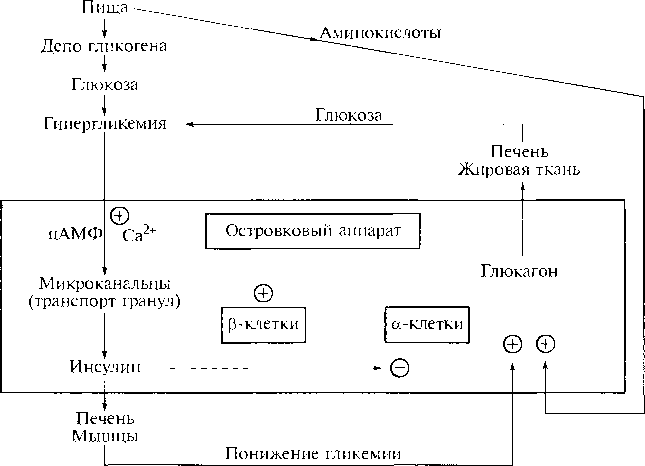
В механизме действия глюкагона первичным является связывание со специфическими рецепторами мембраны клеток , образовавшийся глю-кагонрецепторный комплекс активирует аденилатциклазу и соответственно образование цАМФ. Последний, являясь универсальным эффектором внутриклеточных ферментов, активирует протеинкиназу, которая в свою очередь фосфорилирует киназу фосфорилазы и гликогенсинтазу. Фосфорили-рование первого фермента способствует формированию активной гликоген-фосфорилазы и соответственно распаду гликогена с образованием глюкозо—1-фосфата (см. главу 10), в то время как фосфорилирование гликогенсинта-зы сопровождается переходом ее в неактивную форму и соответственно блокированием синтеза гликогена. Общим итогом действия глюкагона являются ускорение распада гликогена и торможение его синтеза в печени, что приводит к увеличению концентрации глюкозы в крови.
Гипергликемический эффект глюкагона обусловлен, однако, не только распадом гликогена. Имеются бесспорные доказательства существования глюконеогенетического механизма гипергликемии, вызванной глюкагоном. Установлено, что глюкагон способствует образованию глюкозы из промежуточных продуктов обмена белков и жиров. Глюкагон стимулирует образование глюкозы из аминокислот путем индукции синтеза ферментов глюконеогенеза при участии цАМФ, в частности фосфоенолпируваткарбок-сикиназы – ключевого фермента этого процесса. Глюкагон в отличие от адреналина тормозит гликолитический распад глюкозы до молочной кислоты, способствуя тем самым гипергликемии. Он активирует опосредованно через цАМФ липазу тканей, оказывая мощный липолитический эффект. Существуют и различия в физиологическом действии: в отличие от адреналина глюкагон не повышает кровяного давления и не увеличивает частоту сердечных сокращений. Следует отметить, что, помимо панкреатического глюкагона, в последнее время доказано существование кишечного глюкагона, синтезирующегося по всему пищеварительному тракту и поступающего в кровь. Первичная структура кишечного глюкагона пока точно не расшифрована, однако в его молекуле открыты идентичные N-концевому и среднему участкам панкреатического глюкагона аминокислотные последовательности, но разная С-концевая последовательность аминокислот.
Таким образом, панкреатические островки, синтезирующие два противоположного действия гормона – инсулин и глюкагон, выполняют ключевую роль в регуляции обмена веществ на молекулярном уровне.
Предыдущая страница | Следующая страница
СОДЕРЖАНИЕ
Глюкагон — гормон, вырабатываемый альфа-клетками поджелудочной железы. Является физиологическим антагонистом инсулина: стимулирует печень высвобождать запасённую в ней в виде гликогена глюкозу.
Продукция глюкагона поджелудочной железой не обязательно нарушена в начальный период жизни с диабетом. Однако, с течением времени у больного диабетом способность организма секретировать достаточное количество глюкагона в ответ на гипогликемию обычно исчезает. Это происходит как у детей, так и взрослых. Этот процесс не считается поздним осложнением диабета, а скорее является способом адаптации организма к повторным эпизодам гипогликемии. Больные диабетом, которые ещё могут секретировать немного собственного инсулина, лучше способны на «защиту глюкагоном» (секреция глюкагона в ответ на гипогликемию). Результаты некоторых исследований показывают, что защита глюкагоном может быть частично восстановлена, если диабетику удастся какое-то время избегать гипогликемия.
У здорового человека выработка глюкагона уменьшается после еды, когда глюкоза крови и концентрация инсулина повышается. Но это не происходит у больного диабетом. Это следствие того, что инсулин при инъекции попадает в поджелудочную железу менее концентрированным, чем при выработке его непосредственно поджелудочной железой.
Литература Править
Глюкагон представляет собой гормон полипептидной природы, выделяемый a-клетками поджелудочной железы. Основной функцией этого гормона является поддержание энергетического гомеостаза организма за счет мобилизации эндогенных энергетических ресурсов, этим объясняется его суммарный катаболический эффект.
В состав полипептидной цепи глюкагона входит 29 аминокислотных остатков, его молекулярная масса 4200, в его составе отсутствует цистеин. Глюкагон был синтезирован химическим путем, чем была окончательно подтверждена его химическая структура.
Глюкагон образуется из препроглюкагона — пептида-предшественника, состоящего из 180 аминокислоти пяти доменов которые подвергаются раздельному процессингу (Bell et al., 1983). За N-концевым сигнальным пептидом в молекуле препроглюкагона следует глицентиноподобный панкреатический пептид затем идут аминокислотные последовательности глюкагона и глюкагоноподобных пептидов типов 1 и 2. Процессинг препроглюкагона осуществляется в несколько этапов и зависит от ткани, в которой он происходит. В результате из одного и того же препрогормона в а-клетках островков поджелудочной железы и в нейроэндокринных клетках кишечника (L-клетках) образуются разные пептиды. Глицентин, важнейший промежуточный продукт процессинга, состоит из N-концевого глицентиноподобного панкреатического пептида и С-концево-го глюкагона, разделенных между собой двумя остатками аргинина. Оксинтомодулин состоит из глюкагона и С-концевого гексапептида, тоже разделенных между собой двумя остатками аргинина.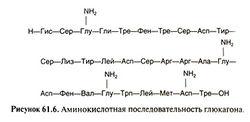
Физиологическая роль пептидов — предшественников глюкагона не ясна, однако сложная регуляция процессинга препроглюкагона предполагает, что всем им должны быть присущи особые функции. В секреторных гранулах а-клеток островков поджелудочной железы различимы центральное ядро из глюкагона и периферический ободок из глицентина. В L-клетках кишечника секреторные гранулы содержат только глицентин; по-видимому, эти клетки лишены фермента, который превращает глицентин в глюкагон. Оксинтомодулин связывается с рецепторами глюкагона на гепатоцитах и стимулирует аденилатциклазу; активность этого пептида составляет 10—20% активности глюкагона. Глюкагоноподобный пептид типа 1 — чрезвычайно сильный стимулятор секреции инсулина, но он не оказывает почти никакого действия на гепатоциты. Глицентин, оксинтомодулин и глюкагоноподобные пептиды обнаруживаются преимущественно в кишечнике. Их секреция продолжается и после панкреатэктомии.
Регулируемым параметром в контуре регуляции секреции глюкагона является концентрация глюкозы. Уменьшение ее в крови стимулирует альфа-клетки, которые увеличивают секрецию гормона, что приводит к росту концентрации глюкозы, которая путем отрицательной обратной связи уменьшает секрецию глюкагона.

Увеличение секреции глюкагона вызывает повышение концентрации аминокислот в крови (особенно аргинина) холецистокинина, катехоламинов, ацетилхолина. Уменьшение секреции глюкагона возникает при увеличении: концентрации глюкозы в крови, инсулина, соматостатина, жирных кислот и кетонов.
Глюкагон для гепатоцитов служит внешним сигналом о необходимости выделения в кровь глюкозы за счёт распада гликогена (гликогенолиза) или синтеза глюкозы из других веществ — глюконеогенеза (этот процесс будет изложен позднее). Гормон связывается с рецептором на плазматической мембране и активирует при посредничестве G-белка аденилатциклазу, которая катализирует образование цАМФ из АТФ (см. раздел 5). Далее следует каскад реакций, приводящий в печени к активации гликогенфосфорилазы и ингибированию гликогенсинтазы (рис. 7-29). Этот механизм приводит к высвобождению из гликогена глюкозо-1-фосфата, который превращается в глюкозо-6-фосфат. Затем под влиянием глюкозо-6-фосфатазы образуется свободная глюкоза, способная выйти из клетки в кровь. Таким образом, глюкагон в печени, стимулируя распад гликогена, способствует поддержанию глюкозы в крови на постоянном уровне.
1 — глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ; 2 — α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ; 3 — в присутствии цАМФ протеинкиназа А (цАМФ-зависимая) обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С; 4 — протеинкиназа А фосфорилирует и активирует киназу фосфорилазы; 5 — киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму; 6-протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние; 7 — в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада; 8 — фосфодиэсте-раза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс ос-субъединица-ГТФ затем распадается, α-, β- и γ-субъединицы G-белка реассоциируются.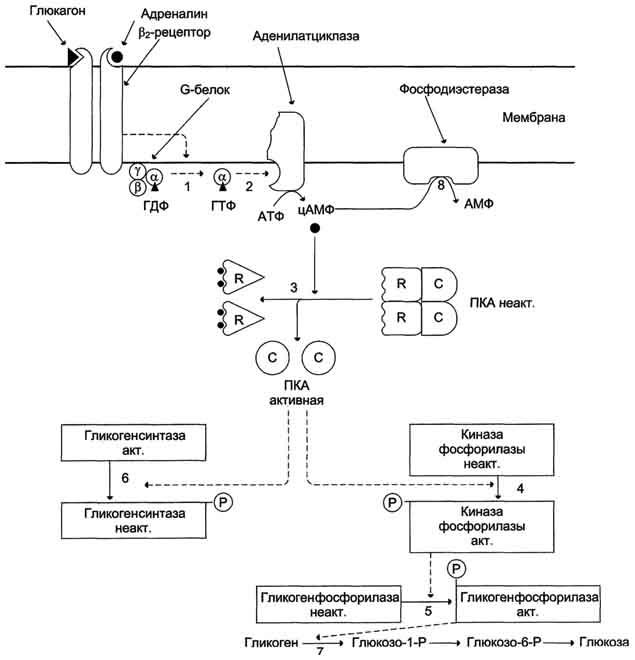
Глюкагон увеличивает содержание глюкозы (способствует гипергликемии) в плазме крови. Этот эффект реализуется несколькими путями.
Стимуляция гликогенолиза. Глюкагон, активируя гликоген фосфорилазу и ингибируя гликоген синтазу в гепатоцитах, приводит к быстрому и выраженному распаду гликогена и освобождению глюкозы в кровь.
Подавление гликолиза. Глюкагон ингибирует ключевые ферменты гликолиза (фосфофруктокиназа, пируваткиназа) в печени, что приводит к содержания глюкозо-6-фосфата в гепатоцитах, его дефосфорилированию и освобождению глюкозы в кровь.
Стимуляция глюконеогенеза. Глюкагон усиливает транспорт АК из крови в гепатоциты и одновременно активирует ключевые ферменты глюконеогенеза (пируваткарбоксилаза. Фруктозо01,6-дифосфатаза), что приводи к содержания глюкозы в цитоплазме клеток и её поступлению в кровь.
Глюкагон способствует образованию кетоновых тел путем стимуляции окисления жирных кислот: ингибирование активности ацетил-КоА-карбоксилазы приводит к ↓ содержания ингибитора карнитин ацилтрансферазы – малонил-КоА, что приводит к усиленному поступлению жирных кислот из цитоплазмы в митохондрии для их β-окисления и превращения в кетокислоты. Другими словами, в отличие от инсулина, глюкагон оказывает кетогенный эффект.