Люминальный рак
Лечение может сильно отличаться в зависимости от стадии и типа злокачественного новообразования.
Необходимость и последовательность каждого из этапов лечения определяется врачом-онкологом с привлечением хирургов и специалистов по лучевой терапии. Помимо химиотерапии, лекарственная терапия рака молочной железы может включать гормонотерапию, таргетную терапию, а также остеомодифицирующую терапию.
Течение, прогноз и лечение рака молочной железы зависят не только от стадии заболевания, но и от биологического подтипа опухоли. Чтобы отнести злокачественное образование к тому или иному типу и определить чувствительность раковых клеток к гормонотерапии, лучевой терапии, химиотерапии и таргетной терапии проводится специальное исследование — иммуногистохимическое (ИГХ). Для него используются гистологические препараты, которые были изготовлены из материала, полученного при биопсии или операции.
Этот диагностический метод позволяет выявить:
- уровень экспрессии к рецепторам эстрогена и прогестерона (определяет чувствительность к гормонотерапии);
- гиперэкспрессию HER2/neu рецептора к эпителиальному фактору роста (определяет чувствительность к таргетной терапии). Встречается примерно в 30% случаев РМЖ, они имеют менее благоприятное течение;
- индекс митотической активности Ki67 (маркер агрессивности опухоли).
В зависимости от результатов ИГХ выделяют следующие подтипы рака молочной железы:
- люминальный А (высокая экспрессия РЭ и РП, Ki67 менее 20%, отсутствие гиперэкспрессии гена Her2);
- люминальный В (низкая экспрессия РЭ, положительная экспрессия РП, Ki67 более 20%, отсутствие гиперэкспрессии гена Her2);
- люминальный В, Her2-позитивный (положительная экспрессия РЭ и РП, наличие гиперэкспрессии гена Her2);
- нелюминальный, Her2-позитивный (отрицательная экспрессия РЭ и РП, наличие гиперэкспрессии гена Her2);
- тройной негативный (базалоподобный).
Принципиально следует отличать ранний рак молочной железы, местнораспространенный и метастатический.
Лечение раннего рака молочной железы (до IIA стадии и некоторых типов IIB) можно начинать с хирургического этапа (за исключением тройного негативного и Her2-позитивного рака).
Для местнораспространенного рака сначала проводится химиотерапия и далее, по возможности, хирургическое лечение.
При метастатическом раке хирургическое лечение не проводится.
Стадия определяется по системе TNM, где T обозначает размер первичной опухоли, N — статус лимфатических узлов, M — наличие или отсутствие отдаленных метастазов. Для раннего рака характерны малый размер первичной опухоли (до 5 см) без вовлечения или с минимальным вовлечением регионарных лимфатических узлов.
Содержание
Хирургическое лечение
Большинство женщин с раком молочной железы нуждаются в хирургическом лечении.
При раннем раке молочной железы может быть проведено органосохранное лечение — с сохранением части молочной железы, что особенно важно с точки зрения косметического результата.
Виды органосохранных операций:
- удаление опухоли в пределах здоровых тканей с исследованием краев резекции (лампэктомия);
- различные виды резекций, наиболее часто выполняется радикальная резекция молочной железы.
Во всех случаях рака молочной железы необходима операция на лимфатических узлах подмышечной области (лимфаденэктомия). При этом происходит удаление всех аксиллярных (подмышечных) лимфатических узлов, что крайне необходимо для их оценки — определения стадии заболевания и прогноза. Операция называется аксиллярная лимфаденэктомия.
При органосохранных операциях может быть выполнена менее травматичная операция — биопсия сторожевого (или сигнального) лимфатического узла. Это первый лимфатический узел на пути лимфооттока, в него метастазы опухоли распространяются в первую очередь. Если он не поражен, это свидетельствует о том, что другие лимфатические узлы этой группы также не поражены. Специальные методы позволяют найти сторожевой лимфатический узел и взять его на анализ — при отсутствии в нем метастазов проведение полной лимфаденэктомии, возможно, не потребуется.
Органосохранное лечение возможно также при изначально местнораспространенном раке, который хорошо ответил на химиотерапию.
При более распространенных стадиях рака молочной железы обычно проводится радикальная мастэктомия. Во время операции удаляется вся ткань молочной железы с кожей над ней, а также проводится полноценная лимфаденэктомия. Такие операции оставляют выраженный косметический дефект. В связи с чем во многих случаях проводятся онкопластические операции (подразумевающие реконструктивный этап), например, подкожная мастэктомия (кожесохраняющая) с установкой силиконового импланта. Также на первом этапе может быть установлен экспандер — специальный вид импланта, который на протяжении нескольких месяцев наполняется жидкостью с помощью шприца через специальную мембрану. Задача экспандера — растянуть местные ткани. Через некоторое время проводится операция по замене экспандера на эндопротез.
В тех случаях, когда одномоментная пластика или онкопластическая операция по тем или иным причинам невозможны, проводится отсроченная реконструктивная операция, которая может использовать аутологичные (собственные) ткани, перемещенные с других участков тела — например, с включением кожи живота, подкожной клетчатки и фрагмента прямой мышцы живота (DIEP-лоскут). В таком случае из донорских тканей формируется каркас будущей груди, в который помещается силиконовый имплант. Сегодня существуют различные варианты подобных лоскутов (DIEP-лоскут, TRAM и пр.).
Вид операции определяется врачом хирургом-онкомаммологом с учетом размера, стадии и биологического типа опухоли, а также с учетом предпочтений пациентки.
Системное (лекарственное) лечение рака молочной железы
Химиотерапия
Химиотерапия — базовый вид лекарственного лечения почти для всех пациентов с раком молочной железы. Он подразумевает использование специальных цитостатических препаратов, которые циркулируют по всему организму и уничтожают опухолевые клетки.
Рак молочной железы считается системным заболеванием, и уже на самых ранних стадиях в крови пациенток обнаруживаются циркулирующие опухолевые клетки. Это не значит, что каждая из этих клеток обязательно станет метастазом — подавляющее большинство погибает или «засыпает», но некоторые могут реализоваться в метастазы даже спустя годы.
В зависимости от цели и времени проведения по отношению к другим методам лечения (хирургического, лучевого), а также стадии рака молочной железы различают разные типы химиотерапии.
Неоадьювантная химиотерапия (НАХТ). Проводится перед операцией в рамках комбинированного лечения, когда операция запланирована (при исходно операбельном раке), или предполагается (при первично неоперабельном раке), что под воздействием химиотерапии опухоль перейдет в операбельное состояние. НАХТ назначается при местнораспространенном раке и в ряде случаев при раннем раке молочной железы.
Еще одна цель неоадъювантной химиотерапии — оценить чувствительность рака к противоопухолевому лечению. После химиотерапии проводится операция, а во время гистологического исследования оценивается реакция опухоли на предшествующее лечение.
Адьювантная химиотерапия. Назначается после хирургического лечения. Ее задача — «закрепить» результаты лечения и снизить риск прогрессирования болезни. Внедрение адьювантной химиотерапии является большим достижением в онкологии, она значительно увеличила выживаемость пациенток с раком молочной железы.
Лечебная химиотерапия. К сожалению, не все случаи рака молочной железы диагностируются на ранней стадии, и нередко на момент установления диагноза у пациента уже присутствуют отдаленные метастазы. В этом случае основным методом лечения является химиотерапия. Хирургическое лечение первичной опухоли в молочной железе на этой стадии не проводится, за исключением так называемых санационных операций (связанных с кровотечением или нагноением). Задача лечебной химиотерапии — максимальное продление жизни пациента и поддержка качества жизни, в связи с чем этот тип химиотерапии также называют паллиативной. Однако во многих случаях с ее помощью может быть достигнута длительная ремиссия и даже полный ответ.
В клинике Рассвет при химиотерапии рака молочной железы можно воспользоваться услугой гипотермии кожи головы с помощью специального холодового шлема. Это позволяет сохранить волосы у большинства пациенток и снизить дискомфорт от последствий лечения, что крайне важно с точки зрения качества жизни и психоэмоционального состояния. Данная процедура используется также при других видах рака, но для рака молочной железы были получены самые убедительные результаты. Это стало причиной включения гипотермии в международные клинические рекомендации по лечению РМЖ.
Подробнее
Таргетные препараты
Рак молочной железы был первой болезнью, для лечения которой стали применять таргетную терапию — относительно новый вид лечения, направленный на конкретные клеточные мишени.
Таргетная терапия использует препараты — моноклональные антитела, которые «атакуют» (блокируют) специфические рецепторы на поверхности раковых (и других) клеток, что ломает определенное звено в цикле их развития и роста. Одним из примеров является эпидермальный фактор роста. В случае рака молочной железы это HER2 (human epidermal growth factor receptor 2 или erbB2). Повышенная экспрессия этого гена (гиперэкспрессия) на поверхности клеток рака молочной железы выявляется примерно у 15-30% пациентов. Гиперэкспрессия данного онкогена (маркера) усиливает пролиферацию (деление) раковых клеток и тормозит их естественную гибель. Это является фактором, обуславливающим повышенную агрессивность опухоли и менее благоприятный прогноз. Анти-HER2-терапия сегодня является «золотым стандартом» в лечении пациентов с HER2-позитивным раком молочной железы.
Помимо анти-HER2-терапии, сегодня используются и другие клеточные мишени. Среди наиболее изученных — так называемые циклинзависимые киназы CDK4/6, ингибирование которых позволяет получить впечатляющие результаты у женщин с метастатическим гормоноположительным, HER2-негативным раком молочной железы.
Гормонотерапия
В случаях, когда опухоль является гормоночувствительной, то есть экспрессирует на поверхности клеток рецепторы эстрогена и прогестерона (люминальный А и люминальный В подтипы), применяется терапия, направленная на устранение эстрогенов из организма.
Почему это важно? Эстроген (главный женский половой гормон), помимо прочего, имеет в качестве одного из органов-мишеней молочную железу, заставляя ее клетки делиться и преумножаться, что в свою очередь стимулирует рост опухолевых клеток.
Как работает гормонотерапия рака молочной железы? Существует несколько типов препаратов, воздействующих на разные звенья. Блокирование рецепторов к эстрогену на поверхности раковых клеток осуществляется с помощью антиэстрогеновых препаратов. Таким образом клетки не реагируют на эстрогены в крови.
У женщин с гормоночувствительным раком молочной железы в пременопаузе, то есть с сохранной функцией яичников, рекомендуется овариальная супрессия. Ранее это достигалось с помощью овариэктомии (удаление яичников) или воздействием лучевой терапии на яичники (прекращение их функции). В современной онкологии принято использовать медикаментозное выключение яичников (блокирование выработки эстрогенов) с помощью специальных гормонов — агонистов гонадотропин-рилизинг факторов. Эффект метода обратим, и женщина после такого лечения может вернуться к детородной функции. В клинике Рассвет мы применяем только медикаментозный способ овариальной супрессии.
Эстрогены могут также синтезироваться в жировой ткани из андрогенов (других гормонов, которые вырабатываются почками и надпочечниками) под действием фермента ароматазы. Специальные препараты, ингибиторы ароматазы, блокируют «обходной путь» синтеза эстрогенов в жировой ткани.
В клинике Рассвет применяются все виды гормональной терапии, которая сегодня является обязательным методом лечения у всех женщин с гормоночувствительным раком молочной железы. Вид гормонотерапии определяется врачом-онкологом — в зависимости от стадии заболевания, функции яичников, а также с учетом ранее проводимого и/или планирующегося лечения.
Остеомодифицирующая терапия
Вид терапии, который используются у пациенток с раком молочной железы в качестве профилактики и лечения так называемых костных событий (метастазов в кости, переломов костей).
Рак молочной железы (в случаях, когда речь идет о прогрессировании или изначально метастатической форме) наиболее часто метастазирует в кости скелета. Это связывают со схожестью структуры ткани молочной железы и костного мозга — метастазы находят более благоприятную среду, максимально похожую на ту, где они появились изначально. При этом формируется порочный круг, результатом которого является разрушение костной ткани с формированием полостей (пустот) — остеокластических метастазов. Именно в этой зоне может возникнуть перелом, что обычно проявляется выраженным болевым синдромом и ограничением в движении. Очень часто это становится причиной прекращения лечения, в связи с нетранспортабельностью пациента.
Задача остеомодифицирующей терапии — прекращение разрушения костной ткани.
Остеомодифицирующая терапия проводится не только при метастазировании рака. Ее препараты широко используются в лечении остеопороза (снижение минерализации костной ткани), которая возникает у большинства женщин в постменопаузе. Но интересно другое. Эта группа препаратов показала свою эффективность в качестве профилактики костных событий у женщин, получивших радикальное лечение рака молочной железы. Как показали недавно проведенные исследования, подобный подход не только улучшает состояние костной ткани, которое неизбежно страдает на фоне гормональной терапии, но и улучшает показатели общей и безрецидивной выживаемости.
Лучевая терапия
Лучевая терапия (ЛТ) является одним из 3 основных методов лечения онкологических заболеваний. Метод основан на воздействии радиации на облучаемые участки тела, в результате чего опухолевые клетки повреждаются и погибают. Чем больше доза радиации, тем выше повреждение.
В настоящий момент для лучевой терапии все чаще используются линейные ускорители электронов. Менее распространены (уходят в прошлое) гамма-терапевтические установки и рентгенотерапия. Это позволяет лучше контролировать дозовое распределение между мишенью (облучаемая зона) и нормальными тканями, через которые неизбежно проходят лучи. Современные аппараты позволяют подводить максимальное облучение к опухоли, учитывая ее конфигурацию, и минимально повреждать окружающие ткани. Для этого используются специальные поворотные излучатели, которые модулируют пучок особым образом (IMRT).
Лучевая терапия используется в большинстве случаев лечения рака молочной железы в рамках комбинированного или комплексного лечения.
Основная роль ЛТ в лечении рака молочной железы — закрепление эффекта лечения за счет облучения места, где ранее была опухоль (выполняется после операции) и зон регионарного лимфооттока (подмышечные, над- и подключичные зоны, внутригрудные лимфатические узлы).
Таким образом лучевая терапия в основном снижает риск развития локального и регионального (то есть на месте опухоли и в регионарных зонах) рецидива, но может использовать в случае отдаленного метастазирования с паллиативной целью. Так, при поражении метастазами позвоночника проводится облучение пораженных отделов, чтобы снизить риск перелома.
Клиника Рассвет работает с надежными и проверенными центрами лучевой терапии, а их доктора, лучевые терапевты являются частью нашей мультидисциплинарной команды по лечению онкологических заболеваний.
Лечение рака молочной железы в клинике Рассвет
Лечение рака молочной железы — сложный, комбинированный процесс, требующий глубокого погружения в историю конкретного пациента, с учетом множества индивидуальных особенностей. Врачи клиники Рассвет обладают всеми необходимыми компетенциями, опытом зарубежных стажировок, что позволяет использовать самые передовые средства для лечения этого заболевания.
Информация о заболевании
X РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ФАКТОРЫ ПРОГНОЗА И ТАКТИКА ЛЕЧЕНИЯ МЕСТНО-РАСПРОСТРАНЕННОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ
С.М. Портной
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Определение. Под местно-распространенным раком молочной железы (РМЖ) понимается РМЖ при наличии, по крайней мере, одного из следующих признаков: распространение опухоли на кожу молочной железы, распространение опухоли на подлежащую грудную стенку, метастазы в ипсилатеральных надключичных лимфатических узлах, метастазы в ипсилатеральных подключичных лимфатических узлах; ипсилатеральные аксиллярные метастазы, спаянные между собой или фиксированные к другим структурам; большая опухоль в маленькой молочной железе (1). Под такое определение местно-распространенного РМЖ подпадает рак IIIa стадии, IIIb стадии, IIIc стадии и, частично, IIb стадии по последней классификации TNM.
Статистика. По оценке Hortobagyi G.N. и соавт., (1) ежегодно в мире выявляются 300000-350000 новых больных местно-распространенным РМЖ. В России в структуре онкологической заболеваемости женщин РМЖ занимает 1-ое место. Заболеваемость и смертность от этой болезни за 30 лет выросли в 4 раза: в 1970 г. стандартизованные показатели заболеваемости и смертности на 100000 населения составляли 9,6 и 4,2 (2); в 2001 они составили 38,3 и 16,9 соответственно (3). За 13 лет доля РМЖ III стадии среди вновь выявленных заболеваний в относительном выражении сократилась с 30,2 % в 1990 г. до 25,4% в 2003 г., хотя абсолютное число больных раком III стадии выросло за этот период с 9634 до 11760 (4, 5).
Клинико-морфологические факторы прогноза. Фиксация опухоли к грудной стенке, изъязвление опухоли, отёк и краснота кожи молочной железы существенно отягощают прогноз болезни, что позволило Наagensen С. & Stout A.P. (6, 7) отнести эти симптомы к признакам иноперабельности.
По данным ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России самый частый из этих признаков – отек кожи. Наличие отёка кожи у больных без системной терапии сопровождается 5-летней безрецидивной выживаемостью (БРВ), равной 23%, общей выживаемостью (ОВ), равной 30%; 10-летние БРВ и ОВ равны 0%. Судьба больных, не получавших по разным причинам системную адъювантную терапию, свидетельствуют о том, что с появлением отёка и/или гиперемии кожи молочной железы РМЖ становится системной болезнью на 100% и его лечение невозможно без системной терапии (8). Клинические симптомы, относящиеся к критериям T и N по системе TNM, оказываются самыми сильными прогностическими признаками (рис. 1).
Местно-распространённый РМЖ отличается от локализованного не только степенью распространённости опухоли, при этом варианте возрастает частота опухолей с неблагоприятным прогнозом и снижается частота относительно благоприятных прогностических факторов. Так, по данным ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, частота редких морфологических форм рака с относительно доброкачественным течением (слизистый, папиллярный, тубулярный и медуллярный) при раннем РМЖ (T1-2N0M0) составляет 11%, а при местно-распространенном РМЖ — 2%. Анеуплоидные опухоли при раннем РМЖ наблюдались в 62% случаев, а при местно-распространенном РМЖ — в 85%, причём доля анеуплоидных многоклоновых опухолей составила 4% и 17% соответственно (8).
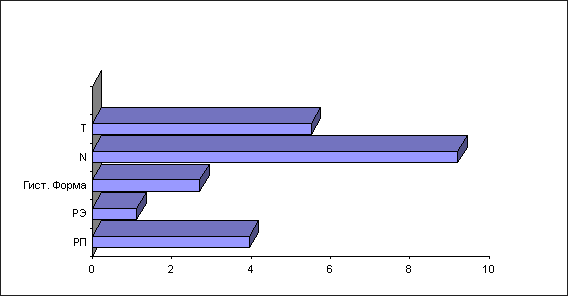
Рис. 1. Весовые коэффициенты (по Шеннону) прогностически значимых признаков у больных, не получавших адъювантной терапии.
Молекулярно-биологические прогностические и предсказательные факторы. Среди огромного количества молекулярно-биологических исследований, относящихся к прогнозированию РМЖ и поиску факторов, предсказывающих чувствительность опухоли к различным способам лечения, необходимо выделить появление молекулярно-генетической классификации РМЖ. К ее достоинствам следует отнести интегральную оценку огромного количества молекулярно-биологических характеристик опухоли как известных ранее, так и новых.
Итак, Perou C.M. и соавт. (9), Sorlie T. и соавт. (10) представили классификацию РМЖ, основанную на вариациях набора экспрессируемых генов и корреляции генетических характеристик опухоли с отдаленными результатами. Исследовались 85 образцов тканей, в том числе 4 образца нормальной ткани молочной железы, 3 фиброаденомы, 2 протоковых рака in situ, 51 образец опухоли от больных местно-распространенным РМЖ. Из 8102 генов выбран набор «существенных» генов (427) — генов с наибольшей вариацией в их экспрессии между различными опухолями. Статистический анализ включал также изучение корреляции между выраженностью экспрессии каждого из генов с длительностью жизни пациента. Такому анализу подверглись 1753 гена.
Все опухоли были разделены на две большие группы. Первая включала 3 подгруппы, опухоли каждой из них характеризовались низкой экспрессией (или отсутствием экспрессии) РЭ и некоторых дополнительных транскрипционных факторов, экспрессируемых РЭ+ опухолями:
- 1a. Опухоли подобные базальному эпителию молочной железы. Характеризуются высокой экспрессией кератинов 5 и 17, ламинина, протеина 7, связывающего жирные кислоты;
- 1b. Подгруппа ERBB2+. Опухоли с высокой экспрессией некоторых генов 17q22.24, включая ERBB2 и GRB7;
- 1c. Опухоли, подобные нормальным клеткам молочной железы. Имеют самую выраженную экспрессию многих генов, известных для жировой ткани и клеток других неэпителиальных тканей. Эти опухоли демонстрировали также выраженную экспрессию генов базального эпителия и низкую экспрессию генов люминального эпителия.
Вторая группа опухолей описывается как опухоли РЭ+, подобные люминальному эпителию. Группа также делится на 3 подгруппы:
- 2a. Люминальный подтип А. Клетки демонстрируют высочайшую экспрессию гена РЭ ? и эстроген-регулируемого LIV-1;
- 2b. Люминальный подтип В. Клетки имеют умеренную или низкую экспрессию генов, специфичных для люминального типа, включая кластер РЭ;
- 2c. Люминальный подтип С. Клетки имеют те же характеристики, что и клетки люминального типа В, отличаются от последних высокой экспрессией генов, координирующая функция которых неизвестна, имеющих сходные черты с генами, экспрессирующимися в опухолях, подобных базальному эпителию, и подтипе ERBB2+.
При анализе корреляции экспрессии генов с выживаемостью оказалось, что из 1753 генов влияние на выживаемость имеют 264 гена. Больные с опухолями, подобными базальному эпителию, и с опухолями подтипа ERBB2+ имеют самую короткую длительность жизни. Люминальный подтип С характеризовался более низкой выживаемостью по сравнению с люминальными типами А и В (9, 10).
При планировании лечения местно-распространенного РМЖ большее значение могут иметь не прогностические факторы, а факторы, предсказывающие эффект того или иного лечения. Примером исследования, оценивающего предсказательные возможности молекулярно-генетической классификации РМЖ, является работа Rouzier R. и соавт. (11). 82 больным РМЖ I-III стадий проводилась предоперационная ХТ паклитакселом, а затем 5-фторурацилом, доксорубицином и циклофосфаном. До начала ХТ производилась биопсия опухоли, определялся профиль экспрессируемых генов и по ним — принадлежность опухоли к молекулярно-генетическому типу. Опухоли базального подтипа и подтипа erbB2+ имели самую высокую частоту полных морфологических регрессий — по 45%; опухоли люминального типа — 6%, опухоли, подобные нормальным клеткам, не имели ни одного случая полных морфологических регрессий. Ни один из 61 гена, ассоциировавшегося с полной морфологической регрессией опухолей базального подтипа, не ассоциировался с таким же эффектом у опухолей подтипа erbB2+, что говорит о разных молекулярных механизмах чувствительности опухолей к ХТ в этих подгруппах.
Вошло в практику суррогатное выделение предложенных подтипов РМЖ, основанное на иммуногистохимическом исследовании РЭ, РП и HER2neu: люминальный тип характеризуется как РЭ+ HER2neu-, HER2neu+ подтип — любые значения РЭ и РП при гиперэкспрессии HER2neu, базальный подтип – РЭ-РП-, HER2neu-. Гиперэкспрессия HER2neu давно рассматривается как фактор неблагоприятного прогноза (12), прогностическое значение базального подтипа РМЖ оценено дополнительно относительно недавно, показано неблагоприятное течение опухолей, имеющих такие характеристики (13).
Ревизия результатов системной терапии в зависимости от принадлежности опухоли к тому или иному подтипу показала предсказательную значимость новой классификации. Люминальный тип РМЖ. Анализ публикаций по неоадъювантной химиотерапии, проведенный Cuffer T. и соавт. (14), показал, что достижение полного морфологического эффекта у больных с РЭ+ опухолями возможно значительно реже (5-8%), чем у больных с РЭ- опухолями (21-23%). Семиглазовым В.Ф. и соавт. представлены результаты неоадъювантной терапии больных гормонально-зависимым местно-распространенным РМЖ: эффективность эндокринной терапии ингибиторами ароматазы не уступала эффективности химиотерапии по схеме АТ (15). В то же время нет оснований утверждать, что химиотерапия не нужна больным с РЭ+ опухолями. При метаанализе рандомизированных исследований было показано, что адъювантная полихимиотерапия примерно в равной степени как при РЭ-, так и при РЭ+ опухолях улучшает безрецидивную и общую выживаемость (16).
HER2neu+ подтип РМЖ. У больных с поражением подмышечных лимфатических узлов адъювантная ХТ, включающая антрациклины (CEF) имела преимущества перед схемой CMF при амплификации HER2neu, причем вероятность рецидива болезни была ниже почти в 2 раза (относительный риск 0.52; р=0.003). У больных с отсутствием амплификации HER2neu результаты лечения были одинаковы (17). Резистентность HER2neu+ подтипа РМЖ к химиотерапии, основанной на применении алкилирующих препаратов, была так же продемонстрирована в публикации Rodenhuis S. с соавт. Это самое крупное рандомизированное исследование по сравнению адъювантной высокодозной химиотерапии с обычной химиотерапией. В исследование были включены 885 больных РМЖ III стадии с поражением 4 и более лимфатических узлов. Контрольная группа больных получала 5 курсов ХТ по схеме FEC, вторая группа больных получала 4 курса по схеме FEC, а затем – курс высокодозной ХТ (циклофосфан 6 г/м², тиофосфамид 480 мг/м² и карбоплатин 1600 мг/м²) и переливание клеток-предшественников гемопоэза. При сравнении групп в целом было отмечено некоторое снижение риска развития рецидива болезни в группе больных, получавших высокодозную ХТ (относительный риск 0,84, р=0,076). Когда была проанализирована экспрессия HER2neu, оказалось, что у больных с гиперэкспрессией имеется тенденция к повышению риска рецидива (относительный риск 1,26, р=0,22) при высокодозной ХТ, а у больных с отсутствием гиперэкспрессии HER2neu высокодозная ХТ имеет выраженные преимущества как по показателю безрецидивной (относительный риск 0,68, р=0,002), так и общей выживаемости (относительный риск 0,72, р=0,02). Причем примерно равное снижение риска болезни наблюдалось как у больных с HER2neu- РЭ-, так и с HER2neu- РЭ+ опухолями (18).
Гиперэкспрессия HER2neu в опухоли обусловливает низкую чувствительность к тамоксифену, но не к ингибиторам ароматазы. В частности, при проведении неоадъювантной эндокринной терапии у больных РМЖ, имевших РЭ+ опухоли и гиперэкспрекспрессию ErbB-1 и/или ErbB-2 эффективность летрозола составила 88% против 21% при применении тамоксифена, р=0,0004 (19).
Особенностью данного подтипа РМЖ является чувствительность к лечению герцептином. Как было показано рядом масштабных рандомизированных исследований, герцептин примерно вдвое снижает вероятность рецидива болезни (20).
Базальный подтип РМЖ, РЭ-РП- HER2neu-. Такая характеристика демонстрирует отсутствие молекулярных «мишеней» в опухолях и, соответственно, — отсутствие возможностей таргетной терапии, необходимость проведения химиотерапии в полном объеме.
Список литературы:
3. Злокачественные новообразования в России и странах СНГ в 2001 г. Под ред. Давыдова М.И. и Аксель Е.М. ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. М.: Медицинское информационное агентство, 2003.
4. Двойрин В.В.. Статистика рака молочной железы в России. Вестник онкологического научного центра АМН России, 1994, №1, 3-12.
5. Аксель Е.М. Злокачественные образования молочной железы: Состояние онкологической помощи, заболеваемость и смертность. Маммология – 2006, №1, 9-15.
6. Haagensen C., Stout A.P. Carcinoma of the breast. I — Results of treatment. Ann. Surg., 1942, 116, 801 — 815.
7. Haagensen C., Stout A.P. Carcinoma of the breast. II — Criteria of operability. Ann. Surg., 1943, 118, 859-870 & 1032-1051.
8. Портной С.М. Рак молочной железы (факторы прогноза и лечение). Автореф. дис. … д.м.н. М., 1997.
9. Perou C.M., Sorlie T., Eisen M.B., et al. Molecular portraits of human breast tumors. Nature. 2000, 406, 747–752.
Дружков М.О., Гатауллин И.Г., Дружков О.Б.
Государственное автономное учреждение здравоохранения «Республиканский клинический онкологический диспансер», Казань, Россия
В статье рассмотрены принципы лечения локальных рецидивов рака молочной железы.
Материалы и методы. Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период с 2000 по 2011 гг. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: иммуногистохимическое исследование гормональных рецепторов, опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов.
Результаты. По нашим наблюдениям фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев.
Изменения в опухолях люминального А фенотипа произошли у 10% пациентов (p<0,05). Рак молочной железы люминального В HER2-позитивного подтипа поменял иммунофенотип в рецидивных опухолях у 75% пациентов (p=0,005). Трижды-негативные опухоли поменяли иммунофенотип в 33,3% случаев. Динамика иммунофенотипа рака молочной железы HER2-позитивного молекулярно-генетического типа опухолей наблюдалась у 28,6% пациентов.
Больные раком молочной железы люминального А типа имеют благоприятный прогноз локального рецидивирования. У большинства (75,6%) больных с люминальным А типом рака молочной железы локальный рецидив возникает в сроки более 30 месяцев, у 24,4% – в период до 30 месяцев (p<0,05). Для люминального В типа, как с гиперэкспрессией онкогена HER2/neu, так и без нее, наиболее характерны средние сроки (от 30 до 60 месяцев) возникновения рецидива – 60% больных. Трижды-негативный и HER2-позитивный тип первичной опухоли сопряжен с неблагоприятным прогнозом локального рецидивирования. Трижды-негативный тип рака молочной железы статистически достоверно (p<0,05) локально рецидивирует в ранние сроки (до 30 месяцев) – 61,5% больных. У пациентов HER2-позитивного типа первичной опухоли локальный рецидив диагностируют у 83,3% больных в сроки до 60 месяцев.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменения иммуногистохимических свойств раковой опухоли, нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы.
Выводы. К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива. Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Ключевые слова: рак молочной железы, локальный рецидив, иммунофенотип рецидивной опухоли, молекулярно-генетические подтипы рака молочной железы.
Изучением проблемы локальных рецидивов рака молочной железы занимаются крупные мировые онкологические институты, проведены многочисленные исследования, наиболее значимые из них: Milan1, Milan2, NSABP, DBGC, SPORE, PP . В вышеперечисленных исследованиях изучались сроки возникновения локальных рецидивов в зависимости от объема оперативного лечения, различных схем комплексного лечения, молекулярно-генетических подтипов рака молочной железы . По результатам данных исследований разработаны практические рекомендации Американского Общества Онкологов (NCCN), Европейского общества онкологов (EORTC) . Благодаря внедрению разработанных стандартов лечения рака молочной железы удалось снизить показатели смертности и увеличить выживаемость пациентов, страдающих данным заболеванием . Но, несмотря на успехи комплексного лечения рака молочной железы, частота возникновения локальных рецидивов остается достаточно высокой . По различным данным, частота локального рецидивирования рака молочной железы зависит от стадии заболевания и локорегионарного распространения и достигает от 4% до 22%. Перечисленные выше клинические исследования не учитывали изменения иммунофенотипа рака молочной железы. Однако иммуногистохимические показатели определяют во многом тактику лечения данной болезни. Известно, что раковая опухоль гетерогенна по клеточному составу, кроме того, геном злокачественной опухоли неустойчив и подвержен влиянию многочисленных мутационных процессов, приводящих к изменению ее фенотипических признаков .
Цель исследования: разработка тактики комплексного лечения локальных рецидивов с учетом изменения иммунофенотипов первичной опухоли и локального рецидива рака молочной железы.
Материалы и методы исследования
Нами проведен ретроспективный анализ историй болезней больных, прошедших лечение в республиканском онкологическом диспансере за период 10 лет. Отобранные 130 клинических случаев возникновения локального рецидива были проанализированы по следующим параметрам: результаты клинических, лабораторных методов диагностики, иммуногистохимического исследования гормональных рецепторов опухолевого тканевого маркера HER2/neu и индекса пролиферативной активности Ki67. Полученные результаты подлежали сравнению с соответствующими показателями первичных опухолей у данных пациентов. Данные историй болезней и амбулаторных карт были закодированы для обработки в статистической программе SPSS 12.0. Всего были проанализированы 20 признаков с их градациями – клинические данные, морфологические факторы и тактика лечения опухолей. После мастэктомии рецидивы возникли у 76 пациентов (1,4%), после органосохранной операции – у 54 пациентов (5,7%). Объем хирургического вмешательства при локальном рецидиве зависел от объема предшествующего хирургического лечения, размеров рецидивной опухоли и был представлен несколькими вариантами. Широкое иссечение рецидива в области послеоперационного рубца или на передней грудной стенке проведено 77 больным (59,3%), ампутация остатка молочной железы (простая мастэктомия) после органосохранной операции – 37 пациентам (28,3%), повторная органосохранная операция (в сочетании с пластической коррекцией и без) – 16 человек (12,4%).
Результаты исследования и их обсуждение
На основании исследования мы подтвердили, что раковая опухоль на фоне проводимого лечения часто меняет свои молекулярно-биологические свойства. По нашим наблюдениям, изменения произошли у 45,7% пациентов. Все возможные изменения иммунофенотипа рака молочной железы отражены на рисунке 1.
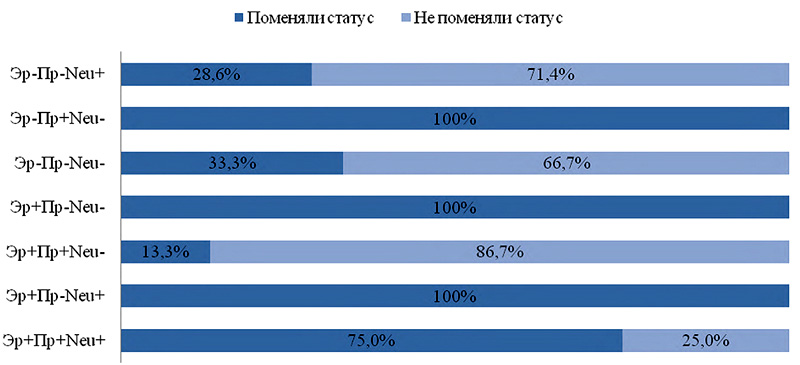
Рисунок 1. Динамика иммунофенотипа первичной опухоли РМЖ.
На рисунке представлены сочетания ИГХ-показателей рака молочной железы. В отношении каждого из них показаны изменения в процентном соотношении. Мы подтвердили большую предрасположенность к изменениям некоторых иммунофенотипов первичной опухоли по сравнению с другими. Первичные опухоли с иммунофенотипом ER+PR-Neu+, ER+PR-Neu-, ER-PR+Neu- более предрасположены к изменениям (100%, p<0,005) при возникновении локального рецидива. Опухоли с иммунофенотипом ER+PR+Neu- значительно реже меняли свой иммунофенотип (20,0%).
Для анализа клинического значения обнаруженных изменений иммуногистохимических показателей рака молочной железы полученные результаты были объединены согласно общепринятой молекулярно-генетической классификации. По нашим наблюдениям, фенотип (молекулярно-генетический подтип) рака молочной железы меняется в 31,9% случаев. Результаты распределения пациентов по иммуногистохимическим показателям первичной опухоли и локального рецидива представлены на рисунке 2.
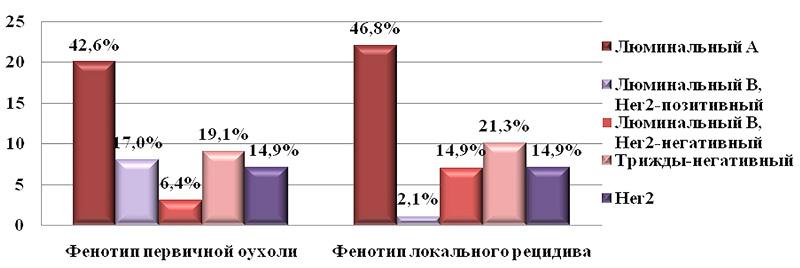
Рисунок 2. Распределение пациентов с первичной опухолью и локальными рецидивами
по молекулярно-генетическим подтипам, чел.
По нашим наблюдениям, отраженные на схеме (рис.4) изменения фенотипа рака молочной железы имеют общие принципы. По мере увеличения числа исследованных опухолей менялись только количественные (рис.3), но не качественные характеристики динамики фенотипа РМЖ. То есть можно говорить о том, что изменения иммунофенотипа рака молочной железы имеют закономерный характер.
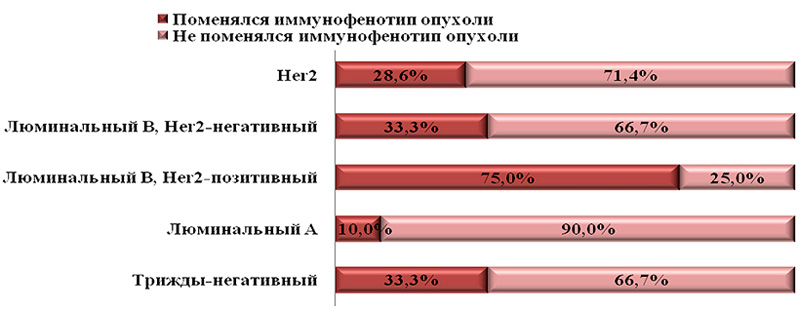
Рисунок 3. Динамика иммунофенотипа РМЖ.
Опухоли HER2-позитивного типа изменили свои молекулярно-генетические свойства в рецидивной опухоли у трети пациентов. Опухоли люминального В типа HER2-позитивного поменялись в 75% случаев. Опухоли люминального А молекулярно-генетического типа практически не менялись (10% опухолей). Опухоли трижды-негативного типа в 33,3% случаев перешли в другой подтип. Опухоли люминального B HER2-позитивного подтипа достоверно чаще других (75%, p<0,05) изменили свой иммунофенотип в рецидивной опухоли. Опухоли люминального А типа менее других молекулярно-генетических типов РМЖ склонны к динамике – 90% (p<0,05) не поменяли иммунофенотип в рецидивной опухоли. Опухоли люминального А типа, утратив экспрессию рецепторов стероидных гормонов, переходили в трижды-негативный тип. Опухоли люминального В типа, утрачивая гиперэкпрессию онкогена HER2/neu, индекса пролиферативной активности Ki67 или экспрессию рецепторов эстрогена и прогестерона либо экспрессию и тех и других, переходили в люминальный А тип, трижды-негативный или в HER2-позитивный тип. Опухоли HER2-позитивного типа начинали экспрессировать рецепторы стероидных гормонов и при этом утрачивали гиерэкспрессию онкогена HER2/neu, таким образом приобретая люминальный А фенотип в рецидивных опухолях, а утратив только экспрессию онкогена HER2/neu, становились трижды-негативными. Опухоли трижды-негативного типа, начиная экспрессировать рецепторы эстрогена и прогестерона в рецидивной опухоли, приобретали признаки люминального А фенотипа.
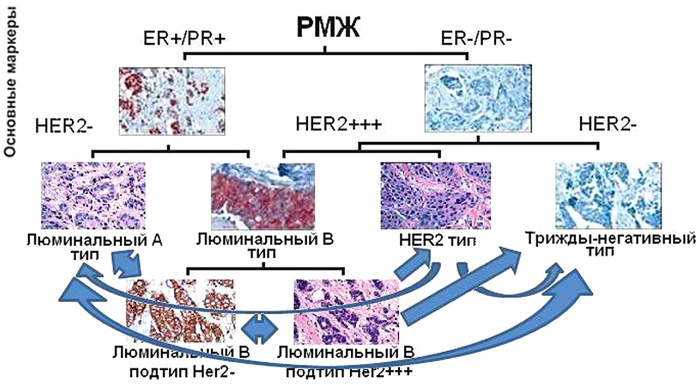
Рисунок 4. Сводная схема динамики иммунофенотипа РМЖ.
Опираясь на общие принципы лечения рака молочной железы, но с учетом изменения иммуногистохимических свойств раковой опухоли, нами разработан алгоритм комплексной терапии локальных рецидивов рака молочной железы (рис.5). Внедрение в клиническую практику разработанного алгоритма, по нашему мнению, позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
В основу алгоритма положено деление локальных рецидивов на первично-резектабельные и первично-нерезектабельные формы, ключевым является иммунодиагностика локального рецидива рака молочной железы (рис.5).
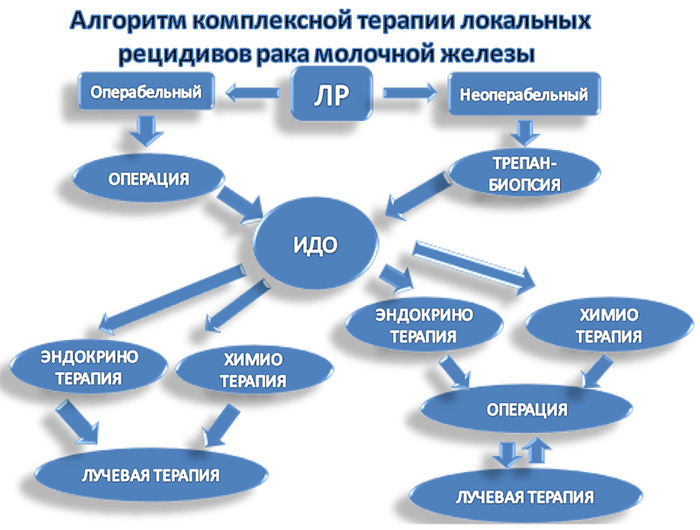
Рисунок 5. Алгоритм комплексной терапии локальных рецидивов (ЛР) РМЖ
(ИДО – иммунодиагностика опухоли).
Комплексное лечение пациентов с операбельной формой локального рецидива начинаем с хирургического удаления рецидивной опухоли. Объем хирургического вмешательства зависит от размеров рецидивной опухоли, предшествующей операции и представлен несколькими вариантами. После радикальных мастэктомий проводится иссечение рецидива в области послеоперационного рубца или на передней грудной стенке. После предшествующей органосохранной операции проводится ампутация остатка молочной железы (простая мастэктомия), если размер рецидивной опухоли превышает 2 см в наибольшем измерении. В случае, когда размер рецидивной опухоли не превышает 2 см, проводится повторная органосохранная операция (в сочетании с пластической коррекцией и без), отступая от краев опухоли не менее 2 см, и гистологическое исследование резекционных линий на степень их «чистоты». Все удаленные опухоли подвергаются гистологическому и иммуногистохимическому исследованию. В зависимости от результатов назначается лекарственная терапия. Если опухоль оказывается гормонозависимой с высокой экспрессией рецепторов стероидных гормонов (7-8 баллов), то целесообразнее всего проведение гормонотерапии II-III линии. В случае низкой экспрессии рецепторов стероидных гормонов в рецидивной опухоли или ее отсутствия проводится полихимиотерапия с последующей эндокринотерапией.
Хирургическое лечение локальных рецидивов осложненной формы в большинстве случаев затруднительно ввиду врастания в переднюю грудную стенку или близлежащие крупные сосудисто-нервные пучки, либо ввиду больших размеров рецидивной опухоли, отсутствия ее четких границ и отсутствия возможности закрытия кожного дефекта операционной раны. Поэтому комплексное лечение неоперабельных локальных рецидивов целесообразно начинать с системного лечения, основной целью которого является уменьшение размеров рецидивной опухоли для возможности дальнейшего ее удаления. В первую очередь должна проводиться системная терапия осложненной (неоперабельной) формы локальных рецидивов рака молочной железы, которая включает в себя химиотерапию и эндокринотерапию. Пациентам, ранее получавшим ПХТ I линии с антрациклин-содержащими схемами (FAC, CAF, AC), целесообразнее проводить более «агрессивные» таксан- и платино-содержащие схемы химиотерапии.
В случае, если неоперабельная форма локального рецидива сопровождается отдаленным метастазированием, рецидивная опухоль на фоне системного лечения будет являться своеобразным маркером прогрессирования заболевания и показателем ее эффективности. Данным пациентам дальнейшее оперативное лечение целесообразнее всего проводить только в случае стабилизации заболевания и его длительной ремиссии. Местное воздействие является следующим этапом комплексной терапии осложненных (неоперабельных) форм ЛР. К оперативному лечению рецидивной опухоли следует приступать только в случае регресса опухоли под воздействием системной терапии. В том случае, если достигнуть положительного эффекта от лекарственного лечения не удалось и опухоль по-прежнему хирургически нерезектабельна, целесообразно проведение лучевой терапии.
Выводы
К лечению локальных рецидивов рака молочной железы необходимо подходить комплексно. В тактике лечения должны учитываться молекулярно-биологические свойства локального рецидива. Внедрение в клиническую практику разработанного алгоритма позволит улучшить отдаленные результаты комплексного лечения локальных рецидивов рака молочной железы.
Литература