Кальция гидроксид
Гидроксид кальция – химическое вещество имеющее сильное основание. Каковы его особенности и химические свойства рассмотрим в данной статье.
Содержание
Характеристика гидроксида кальция
Кристаллический гидроксид кальция – это порошок белого цвета, который разлагается при нагревании, но практически нерастворимый в воде. Формула гидроксида кальция – Ca(OH)2 . В ионном виде уравнение образования гидроксида кальция выглядит так:
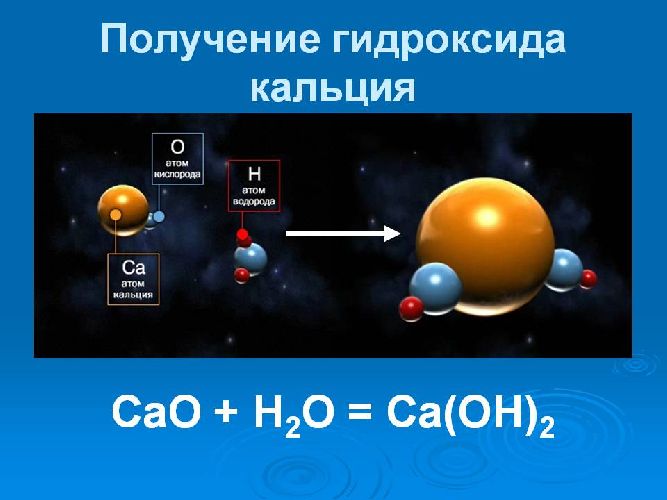
Рис. 1. Уравнение образование гидроксида кальция.
Гидроксид кальция имеет и другие названия: гашеная известь, известковое молоко, известковая вода
Молярная масса гидроксида кальция составляет 74.09 г/моль. Это значит, что 74,09 г/моль количества вещества гидроксида кальция содержат 6,02*10^23 атомов или молекул этого вещества.
Гидроксид кальция используется для побелки в строительстве, дезинфекции стволов деревьев, в сахарной промышленности, для дублении кож, для получения хлорной извести. Тестообразная смесь гашеной извести с цементом и песком используется в строительстве.

Рис. 2. Гидроксид кальция.
Химические свойства гидроксида кальция
Гидроксид кальция, как и все основания, вступает в реакцию с кислотами:
Ca(OH)2 (гидроксид кальция)+H2SO4 (серная кислота)=CaSo4 (соль – сульфат кальция)+2H2 O (вода).
Гидроксид кальция также способен образовывать соединения с углекислым газом. Раствор этого вещества на воздухе становится мутным, так как гидроксид кальция, подобно другим сильным основаниям, взаимодействует с растворенным в воде углекислым газом:
Ca(OH)2+CO2 (гидроксид кальция)=CaCO3 (карбонат кальция)+H2 O (вода)
При нагревании до 400 градусов гидроксид кальция вступает в реакцию с оксидом углерода:
Ca(OH)2 (гидроксид кальция)+CO (оксид углерода)=CaCO3 (карбонат кальция)+H2 (водород).
Гидроксид кальция может взаимодействовать с солями, в результате чего образуется осадок:
Сa(OH)2 (гидроксид кальция)+Na2 SO3 (сульфит натрия)=CaSO3 (сульфит кальция)+2NaOH (гидроксид натрия).
При температуре 520-580 градусов гидроксид кальция подвержен реакции разложения. В результате образуются оксид кальция и вода:

Рис. 3. Гашеная известь.
Ca(OH)2 (гидроксид кальция)=CaO (оксид кальция)+H2 O (вода).
Получение гидроксида кальция происходит при химической реакции оксида кальция (негашеной извести) с водой. Этот процесс получил название «гашение извести». Уравнение реакции гашения извести выглядит следующим образом: CaO (оксид кальция)+H2 O (вода)=Ca(OH)2 (гидроксид кальция).
Что мы узнали?
Гидроксид кальция – сильное основание, малорастворимое в воде. Как и любой химический элемент он обладает рядом свойств т способен вступать в реакцию с углекислым газом, солями, а также разлагается при высокой температуре. Гидроксид кальция используют в строительстве и промышленности.
Тест по теме
- Вопрос 1 из 10
Гидроксид кальция — это:
- порошок белого цвета
- жидкость белого цвета
- порошок темного цвета
- жидкость темного цвета
Начать тест(новая вкладка)
Оценка доклада
2. ОСНОВАНИЯ
Основания – это сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксогрупп (ОН-).
С точки зрения теории электролитической диссоциации это электролиты (вещества, растворы или расплавы которых проводят электрический ток), диссоциирующие в водных растворах на катионы металлов и анионы только гидроксид — ионов ОН-.
Растворимые в воде основания называются щелочами. К ним относятся основания, которые образованы металлами 1-й группы главной подгруппы (LiOH, NaOH и другие) и щелочноземельными металлами (Са(ОН)2, Sr(ОН)2, Ва(ОН)2). Основания, образованные металлами других групп периодической системы в воде практически не растворяются. Щелочи в воде диссоциируют полностью:
NaOH ® Na+ + OH-.
Многокислотные основания в воде диссоциируют ступенчато:
Ba(OH)2 ® BaOH+ + OH-,
Ba(OH)+ ![]() Ba2+ + OH-.
Ba2+ + OH-.
Cтупенчатой диссоциацией оснований объясняется образование основных солей.
Номенклатура оснований.
Основания называются следующим образом: сначала произносят слово «гидроксид», а затем металл, который его образует. Если металл имеет переменную валентность, то она указывается в названии.
КОН – гидроксид калия;
Ca(OH)2 – гидроксид кальция;
Fe(OH)2 – гидроксид железа (II);
Fe(OH)3 – гидроксид железа (III);
При составлении формул оснований исходят из того, что молекула электронейтральна. Гидроксид – ион всегда имеет заряд (–1). В молекуле основания их число определяется положительным зарядом катиона металла. Гидрокогруппа заключается в круглые скобки, а выравнивающий заряды индекс ставится справа внизу за скобками:
Ca+2(OH)–2, Fe3+(OH)3-.
Классификация оснований по следующим признакам:
1. По кислотности (по числу групп ОН— в молекуле основания): однокислотные – NaOH, KOH, многокислотные – Ca(OH)2, Al(OH)3.
2. По растворимости: растворимые (щелочи) – LiOH, KOH, нерастворимые – Cu(OH)2, Al(OH)3.
3. По силе (по степени диссоциации):
а) сильные (α = 100 %) – все растворимые основания NaOH, LiOH, Ba(OH)2, малорастворимый Ca(OH)2.
б) слабые (α < 100 %) – все нерастворимые основания Cu(OH)2, Fe(OH)3 и растворимое NH4OH.
4. По химическим свойствам: основные – Са(ОН)2, NaОН; амфотерные – Zn(ОН)2, Al(ОН)3.
Основания
Это гидроксиды щелочных и щелочноземельных металлов (и магния), а также металлов в минимальной степени окисления (если она имеет переменное значение).
Например: NaOH, LiOH, Mg(OH)2, Ca(OH)2, Cr(OH)2, Mn(OH)2.
Получение
1. Взаимодействие активного металла с водой:
2Na + 2H2O → 2NaOH + H2![]()
Ca + 2H2O → Ca(OH)2 + H2![]()
Mg + 2H2O ![]() Mg(OH)2 + H2
Mg(OH)2 + H2![]()
2. Взаимодействие основных оксидов с водой (только для щелочных и щелочноземельных металлов):
Na2O + H2O → 2NaOH,
CaO + H2O → Ca(OH)2.
3. Промышленным способом получения щелочей является электролиз растворов солей:
2NaCI + 4H2O![]()
![]() 2NaOH + 2H2
2NaOH + 2H2![]() + CI2
+ CI2
4. Взаимодействие растворимых солей со щелочами, причем для нерастворимых оснований это единственный способ получения:
Na2SO4 + Ba(OH)2 → 2NaOH + BaSO4
MgSO4 + 2NaOH → Mg(OH)2 + Na2SO4.
Все основания являются твердыми веществами. В воде нерастворимы, кроме щелочей. Щелочи – это белые кристаллические вещества, мылкие на ощупь, вызывающие сильные ожоги при попадании на кожу. Поэтому они называются «едкими». При работе со щелочами необходимо соблюдать определенные правила и использовать индивидуальные средства защиты (очки, резиновые перчатки, пинцеты и др.).
Если щелочь попала на кожу необходимо промыть это место большим количеством воды до исчезновения мылкости, а затем нейтрализовать раствором борной кислоты.
Химические свойства оснований с точки зрения теории электролитической диссоциации обусловлены наличием в их растворах избытка свободных гидроксид –
ионов ОН—.
1. Изменение цвета индикаторов:
фенолфталеин – малиновый
лакмус – синий
метиловый оранжевый – желтый
2. Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
2NaOH + H2SO4 → Na2SO4 + 2H2O,
Cu(OH)2 + 2HCI → CuCI2 + 2H2O.
3. Взаимодействие с кислотными оксидами:
2NaOH + SO3 → Na2SO4 + H2O
4. Взаимодействие с амфотерными оксидами и гидроксидами:
а) при плавлении:
2NaOH + AI2O3 2NaAIO2 + H2O,
NaOH + AI(OH)3 NaAIO2 + 2H2O.
б) в растворе:
2NaOH + AI2O3 +3H2O → 2Na,
NaOH + AI(OH)3 → Na.
5. Взаимодействие с некоторыми простыми веществами (амфотерными металлами, кремнием и другими):
2NaOH + Zn + 2H2O → Na2 + H2
2NaOH + Si + H2O → Na 2SiO3 + 2H2
6. Взаимодействие с растворимыми солями с образованием осадков:
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4,
Ba(OH)2 + K2SO4 → BaSO4 + 2KOH.
7. Малорастворимые и нерастворимые основания разлагаются при нагревании:
Ca(OH)2 CaO + H2O,
Cu(OH)2 CuO + H2O.
голубой цвет черный цвет
Амфотерные гидроксиды
Это гидроксиды металлов (Be(OH)2, AI(OH)3, Zn(OH)2) и металлов в промежуточной степени окисления (Сr(OH)3, Mn(OH)4).
Амфотерные гидроксиды получают взаимодействием растворимых солей со щелочами взятых в недостатке или эквивалентном количестве, т.к. в избытке они растворяются:
AICI3 + 3NaOH → AI(OH)3 +3NaCI.
Физические свойства
Это твердые вещества, практически нерастворимые в воде. Zn(OH)2 – белый, Fe(ОН)3 – бурый цвет.
Химические свойства
Амфотерные гидроксиды проявляют свойства оснований и кислот, поэтому взаимодействуют как с кислотами, так и с основаниями.
1. Взаимодействие с кислотами с образованием соли и воды:
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O.
2. Взаимодействие с растворами и расплавами щелочей с образованием соли и воды:
AI(OH)3 + NaOH Na,
AI(OH)3 + NaOH NaAIO2 + 2H2O.
3. Взаимодействие с кислотными и основными оксидами:
2Fe(OH)3 + 3SO3 Fe2(SO4)3 + 3H2O,
2Fe(OH)3 + Na2O 2NaFeO2 + 3H2O.
Получение и химические свойства оснований
Цель работы: ознакомиться с химическими свойствами оснований и способами их получения.
Ход работы:
Опыт № 1. Взаимодействие металлов с водой.
В пробирку налить 3–5 см3 воды и опустить в нее несколько кусочков мелко нарезанной магниевой ленты. Нагреть на спиртовке 3–5 мин, охладить и добавить туда 1–2 капли раствора фенолфталеина. Как изменился цвет индикатора? Сравнить с пунктом 1 на с. 27. Написать уравнение реакции. Какие металлы взаимодействуют с водой?
Опыт № 2. Получение и свойства нерастворимых
оснований
В пробирки с разбавленными растворами солей MgCI2, FeCI3, CuSO4 (5–6 капель) внести по 6–8 капель разбавленного раствора щелочи NaOH до образования осадков. Отметить их окраску. Записать уравнения реакций.
Разделить полученный синий осадок Cu(OH)2 на две пробирки. В одну из них добавить 2–3 капли разбавленного раствора кислоты, в другую _ столько же щелочи. В какой пробирке наблюдалось растворение осадка? Написать уравнение реакции.
Повторить этот опыт с двумя другими гидроксидами, полученными по обменным реакциям. Отметить наблюдаемые явления, записать уравнения реакций. Сделать общий вывод о способности оснований взаимодействовать с кислотами и щелочами.
Опыт№ 3. Получение и свойства амфотерных гидроксидов
Прочитайте следующий текст и выполните задания 6—8.
В пищевой промышленности используется пищевая добавка Е526, которая представляет собой гидроксид кальция Ca(OH)2. Она находит применение при производстве: фруктовых соков, детского питания, маринованных огурцов, пищевой соли, кондитерских изделий и сладостей.
Получение гидроксида кальция в промышленном масштабе возможно путём смешивания оксида кальция с водой, этот процесс называется гашение.
Широкое применение гидроксид кальция получил в производстве таких строительных материалов, как белила, штукатурка и гипсовые растворы. Это связано с его способностью взаимодействовать с углекислым газом CO2, содержащимся в воздухе. Это же свойство раствора гидроксида кальция применяется для измерения количественного содержания углекислого газа в воздухе.
Полезным свойством гидроксида кальция является его способность выступать в роли флокулянта, очищающего сточные воды от взвешенных и коллоидных частиц (в том числе солей железа). Он также используется для повышения рН воды, так как природная вода содержит вещества (например, кислоты), вызывающие коррозию в сантехнических трубах.
Кальций (Ca)
Получение: Кальций получают путем электролиза его расплавленного хлорида (CaHl)
Применение: Благодаря большой химической активности кальций применяют для восстановления некоторых тугоплавких металлов (титан, цирконий, и.т.д) из оксидов. Кальций также используют на производстве для отчистки стали и чугуна от кислорода, серы и фосфора, для получения некоторых прочных сплавов.
Оксид кальция (CaO) — негашеная известь
Получение: Оксид кальция в промышленности получают путем обжига известняка:
CaCO3 CaO + CO2
Применение: При взаимодействии с водой выделяется большое количество теплоты, и оксид кальция превращается в гидроксид кальция — гашеная известь:
CaO + H2O Ca(OH)2 + Q
Гидроксид кальция (Ca(OH)2) — гашеная известь
Получение: Получается при взаимодействии негашеной извести с водой.
Применение: Гидроксид кальция применяется в виде гашеной извести, известкового молока, и известковой воды.
Гашеная известь:
Белый рыхлый порошок немного растворенный в воде. Тестообразную смесь гашеной извести с цементом, водой и песком используют в строительстве. Смесь постепенно твердеет.
Известковое молоко:
Суспензия, похожая на молоко. Она образуется при смешивании избытка гашеной извести с водой. Известковое молоко применяется для получения хлорной извести, производстве сахара, для побелки стволов деревьев.
Известковая вода:
Прозрачный раствор гидроксида кальция. Известковую воду получают фильтрованием известкового молока. При прохождении через нее оксида углерода мутнеет:
Ca(OH)2 + CO2 CaCO3 + H2O
Гипс
Существует несколько видов гипса — природный, жженый и безводный. Жженый гипс или алебастр получают при нагревании природного гипса до температуры 150о — 180о С. Если смешать алебастр с водой, то получится полужидкая пластическая масса, которая быстро твердеет из-за присоединения воды. Свойство жженого гипса застывать используется на практике. Алебастр смешивают с известью и используют как штукатурку. Из чистого алебастра изготавливают скульптуры, а в медицине он используется при переломах.