Гипоэхогенность
Аутоиммунный тиреоидит и репродуктивная функция женщины
Т.Н. Демина, Н.Ф. Алипова, Донецкий региональный центр охраны материнства и детства, Кафедра акушерства, гинекологии и перинатологии ФПО Донецкого государственного медицинского университета
Акушерство, гинекология, репродуктология (275) 2009 (тематический номер) / Репродуктивное здоровье
- Добавить в закладки
- Версия для печати
- Послать другу
- Комментарии к статье
Аутоиммунный тиреоидит (АИТ) — гетерогенная группа воспалительных заболеваний щитовидной железы аутоиммунной этиологии, в основе патогенеза которых лежит различной выраженности деструкция фолликулов и фолликулярных клеток щитовидной железы. Распространенность АИТ колеблется от 0,1 до 1,2 % у детей и до 6–11 % у женщин старше 60 лет (Matsuura и соавт., 1990). По данным Weetman (1992), частота клинически выраженных форм АИТ составляет 1 %. Субклинический тиреоидит и циркулирующие антитела обнаруживаются у 10–15 % практически здоровых лиц, находящихся в эутиреоидном состоянии.
Выделяется несколько видов аутоиммунных тиреоидитов: хронический аутоиммунный тиреоидит, послеродовой, безболевой и цитокининдуцированный тиреоидит, подострый тиреоидит, редкие тиреоидиты, к которым относят острый гнойный тиреоидит, фиброзирующий тиреоидит Риделя, а также специфические тиреоидиты.
Хронический аутоиммунный тиреоидит (тиреоидит Хашимото, лимфоцитарный тиреоидит) — хроническое воспалительное заболевание щитовидной железы аутоиммунного генеза, при котором в результате хронически прогрессирующей лимфоидной инфильтрации происходит постепенная деструкция паренхимы щитовидной железы с возможным исходом в первичный гипотиреоз. Впервые заболевание было описано японским хирургом Н. Hashimoto в 1912 г. АИТ развивается на фоне генетически детерминированного дефекта иммунного ответа, приводящего к Т-лимфоцитарной агрессии против собственных тиреоцитов, заканчивающейся их разрушением. Гистологически при этом определяются лимфоцитарная и плазмоцитарная инфильтрация, онкоцитарная трансформация тиреоцитов (образование клеток Гюртле — Ашкенази), разрушение фолликулов. Аутоиммунный тиреоидит имеет тенденцию проявляться в виде семейных форм. У пациентов с повышенной частотой антител к тиреопероксидазе (АТ-ТПО) обнаруживаются гаплотипы HLA-DR3, DR5, В8. В 50 % случаев у родственников пациентов с аутоиммунным тиреоидитом обнаруживаются циркулирующие антитела к щитовидной железе. Кроме того, наблюдается сочетание аутоиммунного тиреоидита у одного и того же пациента или в пределах одной семьи с другими аутоиммунными заболеваниями — пернициозной анемией, аутоиммунным первичным гипокортицизмом, хроническим аутоиммунным гепатитом, сахарным диабетом 1-го типа, витилиго, ревматоидным артритом и др.
Патологическое значение для организма аутоиммунного тиреоидита практически исчерпывается тем, что он является фактором риска развития гипотиреоза. Факт носительства антител к щитовидной железе, которые являются маркерами аутоиммунного тиреоидита, в популяции многократно превышает распространенность гипотиреоза и свидетельствует о том, что в большинстве случаев заболевание не приводит к развитию гипотиреоза. Течение тиреоидита носит фазовый характер. Эутиреоидная фаза может продолжаться многие годы, или десятилетия, или даже на протяжении всей жизни. Далее в случае прогрессирования процесса, а именно постепенного усиления лимфоцитарной инфильтрации щитовидной железы и деструкции ее фолликулярного эпителия, число клеток, продуцирующих тиреоидные гормоны, уменьшается. В этих условиях, для того чтобы обеспечить организм достаточным количеством тиреоидных гормонов, повышается продукция тиреотропного гормона (ТТГ), который гиперстимулирует щитовидную железу. За счет этой гиперстимуляции на протяжении неопределенного времени (иногда десятков лет) удается сохранять продукцию тироксина (Т4) на нормальном уровне. Это фаза субклинического гипотиреоза (повышенные значения ТТГ при нормальном уровне Т4). При дальнейшем разрушении щитовидной железы число функционирующих тиреоцитов падает ниже критического уровня, концентрация Т4 в крови снижается и манифестирует гипотиреоз (фаза манифестного гипотиреоза).
Распространенность аутоиммунного тиреоидита оценить трудно, поскольку в эутиреоидной фазе он практически не имеет точных диагностических критериев. Распространенность как носительства АТ-ТПО, так и гипотиреоза в исходе аутоиммунного тиреоидита примерно в 10 раз выше у женщин по сравнению с мужчинами. Аутоиммунный тиреоидит является причиной примерно 70–80 % всех случаев первичного гипотиреоза, распространенность которого составляет порядка 2 % в общей популяции и достигает 10–12 % среди женщин пожилого возраста.
Клинические симптомы в эутиреоидной фазе и фазе субклинического гипотиреоза отсутствуют. В отдельных, относительно редких случаях на первый план еще в эутиреоидной фазе выступает увеличение объема щитовидной железы (зоб), которое достаточно редко достигает значительных степеней.
К критериям, сочетание которых позволяет установить диагноз аутоиммунного тиреоидита, относят: повышение уровня циркулирующих антител к щитовидной железе (более информативно определение АТ-ТПО); обнаружение типичных ультразвуковых признаков аутоиммунного тиреоидита (гипоэхогенность щитовидной железы); наличие первичного гипотиреоза (субклинического или манифестного).
При отсутствии хотя бы одного из перечисленных критериев диагноз аутоиммунного тиреоидита носит вероятностный характер, поскольку само по себе повышение уровня АТ-ТПО или гипоэхогенность щитовидной железы по данным УЗИ еще не свидетельствуют об аутоиммунном тиреоидите и не позволяют установить этот диагноз. Таким образом, диагностика аутоиммунного тиреоидита в эутиреоидной фазе (до манифестации гипотиреоза) достаточно сложна. При этом реальной практической необходимости в установлении диагноза аутоиммунного тиреоидита в фазе эутиреоза, как правило, нет, поскольку лечение (заместительная терапия L-тироксином) показано пациентам только в гипотиреоидной фазе. Специфическое лечение не разработано, и на сегодняшний день отсутствуют эффективные и безопасные методы воздействия на аутоиммунный процесс, развивающийся в щитовидной железе, которые могли бы предотвратить прогрессирование аутоиммунного тиреоидита до гипотиреоза. Аутоиммунный тиреоидит и носительство АТ-ТПО следует рассматривать как факторы риска развития гипотиреоза в будущем. Вероятность развития гипотиреоза у женщины с повышенным уровнем АТ-ТПО и нормальным уровнем ТТГ составляет около 2 % в год, вероятность развития явного гипотиреоза у женщины с субклиническим гипотиреозом (повышение значений ТТГ при нормальном уровне Т4) и повышенным уровнем АТ-ТПО составляет 4,5 % в год. У женщин, которые являются носительницами АТ-ТПО без нарушения функции щитовидной железы, при наступлении беременности повышается риск развития гипотиреоза и относительной гестационной гипотироксинемии. В связи с этим у таких женщин необходим контроль функции щитовидной железы как на ранних сроках беременности, так и на более поздних сроках.
Послеродовой, безболевой и цитокининдуцированный тиреоидиты — это варианты аутоиммунного тиреоидита, которые объединяет фазность изменений, происходящих в щитовидной железе, связанных с аутоиммунной агрессией: при наиболее типичном течении фаза деструктивного тиреотоксикоза сменяется фазой транзиторного гипотиреоза, после чего в большинстве случаев происходит восстановление функции щитовидной железы.
Наиболее изучен и чаще всего встречается послеродовой тиреоидит. В качестве причины послеродового тиреоидита рассматривается избыточная реактивация иммунной системы после естественной гестационной иммуносупрессии (феномен рикошета), которая у предрасположенных лиц (носительницы АТ-ТПО) приводит к деструктивному аутоиммунному тиреоидиту. Данный вид АИТ развивается в послеродовом периоде у 5–9 % всех женщин, при этом он строго ассоциирован с носительством АТ-ТПО. Он развивается у 50 % носительниц АТ-ТПО, при этом распространенность носительства АТ-ТПО среди женщин достигает 10 %. Послеродовой тиреоидит, как правило, манифестирует легким тиреотоксикозом примерно на 14-й неделе после родов, к 19-й неделе переходя в гипотиреоидную фазу. В ряде случаев гипотиреоидная фаза послеродового тиреоидита ассоциирована с послеродовой депрессией. У женщин с послеродовым тиреоидитом вероятность его повторения после следующей беременности составляет 70 %. Примерно у 25–30 % женщин, перенесших послеродовой тиреоидит, в дальнейшем развивается хронический вариант аутоиммунного тиреоидита с исходом в стойкий гипотиреоз.
Провоцирующие факторы для безболевого («молчащего») тиреоидита неизвестны; этот вариант деструктивного аутоиммунного тиреоидита является полным аналогом послеродового, но развивается вне связи с беременностью. Причиной развития цитокининдуцированного тиреоидита является назначение пациентке по поводу различных заболеваний (гепатит С, заболевания крови) препаратов интерферона, при этом четкой временной связи между развитием тиреоидита и продолжительностью терапии интерферонами не прослеживается: тиреоидит может развиться как в начале лечения, так и спустя месяцы.
Подострый тиреоидит (тиреоидит де Кервена, гранулематозный тиреоидит) — воспалительное заболевание щитовидной железы, предположительно вирусной этиологии, при котором деструктивный тиреотоксикоз сочетается с болевым синдромом в области шеи и симптоматикой острого инфекционного заболевания.
К редким тиреоидитам относят острый гнойный тиреоидит, фиброзирующий тиреоидит Риделя, а также специфические тиреоидиты (туберкулезный, сифилитический, грибковый и прочие). Причиной острого гнойного тиреоидита является гематогенное или лимфогенное инфицирование из других очагов инфекции (челюстно-лицевая область, легкие) или инфицирование послеоперационной раны. Причина фиброзирующего тиреоидита Риделя неизвестна, ранее его рассматривали как вариант аутоиммунного тиреоидита или фиброзирующей болезни (синдром Ормонда), поскольку описаны его сочетания с медиастинальным и ретроперитонеальным фиброзом.
В настоящее время не существует единой точки зрения на роль антител к ткани щитовидной железы (АТ-ЩЖ) в генезе нарушения репродуктивной функции женщин.
Частота нарушений менструального цикла при АИТ и вызванном им гипотиреозе в 3 раза выше, чем в общей популяции женщин репродуктивного возраста, и составляет, по данным разных исследователей, 23,4–70 %. Наиболее распространенные нарушения менструального цикла — олигоменорея, гиперменорея, меноррагия, стойкая аменорея. Следует учитывать, что бесплодие на фоне гипотиреоза наблюдают и при регулярном менструальном цикле из-за недостаточности лютеиновой фазы. Длительный некомпенсированный первичный гипотиреоз часто приводит к хронической ановуляции и дисфункциональным маточным кровотечениям, возможно развитие гипогонадотропной аменореи. При длительном дефиците тиреоидных гормонов закономерно развивается вторичная гиперпролактинемия, которая может сопровождаться всем спектром симптомов (галакторея, аменорея), характерных для гиперпролактинемического гипогонадизма. Кроме того, дефицит трийодтиронина (Т3) нарушает образование дофамина, необходимого для нормального пульсового выделения лютеинизирующего гормона (ЛГ).
Установлено, что почти у трети (27 %) женщин с преждевременной яичниковой недостаточностью присутствует аутоиммунная патология ЩЖ. Недавнее проспективное исследование продемонстрировало в 3 раза более высокую частоту АИТ у пациенток с синдромом поликистозных яичников (СПКЯ), и было показано, что своевременная коррекция гипотиреоза в исходе АИТ является неотъемлемым условием восстановления репродуктивной функции у женщин с СПКЯ.
Проблема нарушений функции ЩЖ у женщин, страдающих бесплодием, в последние годы вызывает большой интерес ученых и клиницистов. Согласно результатам последних исследований, гипотиреоз (как манифестный, так и субклинический) в исходе АИТ — довольно значимый фактор женского бесплодия. Чаще всего манифестный гипотиреоз связан с овуляторной дисфункцией, в то время как при субклиническом гипотиреозе овуляция и оплодотворение могут быть не нарушены, однако повышен риск невынашивания беременности, особенно у женщин с антитиреоидными антителами. Важное значение имеет своевременное выявление и лечение субклинического гипотиреоза у женщин с бесплодием неясного генеза.
Существует точка зрения, что аутоиммунные тиреопатии могут способствовать формированию аутоиммунных поражений других эндокринных желез, в том числе аутоиммунной патологии в репродуктивной системе. Отмечено, что наиболее часто высокий уровень АТ-ЩЖ (29 %) выявляют у женщин с бесплодием и эндометриозом.
Известно, что в генезе бесплодия определенную роль отводят аутоиммунным процессам в яичниках, приводящим к появлению аутоантител к клеткам гранулезы и тека-клеткам, препятствующим нормальному фолликулогенезу, овуляции и адекватному функционированию желтого тела. Именно аутоиммунными механизмами объясняют патогенез бесплодия при эндометриозе, когда, помимо аутоантител к ткани яичников, определяют отложения иммунных комплексов в эндометрии, что ведет к нарушению имплантации. Принимая во внимание часто встречающееся сочетание аутоиммунной патологии ЩЖ у женщин с бесплодием и общность формирования аутоиммунных процессов в организме, можно предположить наличие аутоиммунного генеза бесплодия у инфертильных женщин — носительниц антитиреоидных антител. В пользу этой гипотезы свидетельствует частое сочетание аутоиммунных тиреопатий с бесплодием неясного генеза.
В последнее время в литературе активно обсуждается значение адекватной функции ЩЖ для повышения эффективности лечения бесплодия в программе экстракорпорального оплодотворения и переноса эмбриона в полость матки (ЭКО и ПЭ). Отмечена высокая частота носительства АТ-ЩЖ у женщин с неудачными попытками ЭКО и ПЭ.
A. Geva и соавт. установили, что АТ-ЩЖ присутствовали у 20 % женщин с бесплодием, которые нуждались в проведении ЭКО и ПЭ по поводу трубно-перитонеального фактора бесплодия и бесплодия неясного генеза, при этом у 12 % обнаружены антиовариальные антитела. Примечателен тот факт, что у всех женщин в данном исследовании нарушения функции ЩЖ к моменту обследования и в анамнезе не выявлено. Эти результаты позволяют предположить, что антитиреоидные антитела могут быть независимым фактором бесплодия. С.Kim и соавт. также показали, что носительство АТ-ЩЖ без нарушения ее функции у женщин с трубным бесплодием и бесплодием неясного генеза сочетается с неблагоприятным исходом беременности после ЭКО. Эти данные свидетельствуют в пользу проведения скрининга на АТ-ЩЖ в качестве раннего маркера риска неудач при имплантации и прогноза беременности после ЭКО. Предпринимались попытки введения иммуноглобулина G пациенткам с АТ-ЩЖ в программе ЭКО и ПЭ, и показано улучшение исходов программы на фоне проведенной терапии.
Как известно, стимуляция суперовуляции, проводимая в программах ЭКО и ПЭ с целью получения максимального количества ооцитов, сопровождается высокими уровнями эстрогенов в крови. Гиперэстрогения за счет ряда компенсаторных механизмов (повышение уровня тироксинсвязывающего глобулина (ТСГ) в печени, связывание дополнительного количества свободных тиреоидных гормонов и как следствие — снижение уровня Т3, Т4) приводит к повышению уровня ТТГ. Это способствует повышенной стимуляции ЩЖ, которая вынуждена задействовать свои резервные возможности. Поэтому у женщин с АТ-ЩЖ даже без исходного нарушения тиреоидной функции имеется риск развития гипотироксинемии в ранние сроки индуцированной беременности (ИБ). Таким образом, как стимуляция суперовуляции, так и носительство АТ-ЩЖ — факторы, снижающие нормальный функциональный ответ ЩЖ, необходимый для адекватного развития ИБ. Женщины со стимулированными беременностями представляют собой группу риска по развитию осложнений: высокой частоты ранних репродуктивных потерь, многоплодия, раннего гестоза, тяжелего синдрома гиперстимуляции яичников, фетоплацентарной недостаточности, угрозы преждевременных родов. В связи с этим ведение стимулированного цикла и I триместра ИБ требует тщательного динамического наблюдения и гормонального контроля. Высокая стероидная нагрузка вследствие гиперстимуляции яичников, а также прием большого числа гормональных препаратов влияют на метаболизм тиреоидных гормонов, приводят к гиперстимуляции ЩЖ, что, в свою очередь, может усугубить неблагоприятное течение беременности и негативно отразиться на развитии плода.
Все авторы едины во мнении, что риск спонтанного прерывания беременности на ранних сроках у женщин с АТ-ЩЖ превышает таковой у женщин без них в 2–4 раза, поэтому носительницы АТ-ТПО составляют группу риска ранних репродуктивных потерь, что требует специального наблюдения этой категории женщин акушерами-гинекологами еще на этапе планирования беременности. Наиболее велик этот риск в I триместре беременности. В дальнейшем у женщин, имеющих в анамнезе привычное невынашивание (2 самопроизвольных выкидыша и более), этот риск повышается с увеличением срока беременности.
Таким образом, АИТ во время беременности несет риск развития гипотиреоза и относительной гипотироксинемии у плода. Вот почему скрининг на АТ-ТПО, маркер АИТ, должен проводиться у всех женщин на этапе планирования беременности и в ранние сроки наступившей беременности. Вследствие иммуносупрессивного действия беременности возможна ремиссия аутоиммунного тиреоидита в этот период и рецидив в послеродовом периоде.
Некомпенсированный гипотиреоз в период беременности оказывает следующие отрицательные воздействия на организм матери и плода:
— развиваются такие осложнения беременности, как угроза прерывания, преэклампсия, отслойка плаценты, задержка внутриутробного развития плода, послеродовые кровотечения, нарушения функций сердечно-сосудистой системы, анемия;
— блокирующие антитела к рецепторам тиреотропного гормона проходят через плаценту к плоду и вызывают развитие фетального и неонатального гипотиреоза.
Фетальный гипотиреоз проявляется внутриутробным замедлением роста, брадикардией, запоздалым появлением ядер окостенения, нарушением процессов развития центральной нервной системы.
Неонатальный гипотиреоз продолжается в течение 1–4 месяцев (период полувыведения материнских антител к щитовидной железе — около 3 недель). Признаками неонатального гипотиреоза являются переношенная беременность (более 42 недель), большая масса тела при рождении (более 4 кг), макроглоссия, периферический цианоз, отеки, затруднение дыхания, низкий, грубый тембр голоса при плаче и крике, сонливость, пониженная активность, гипотермия, сухость кожи, снижение содержания тиреоидных гормонов в крови новорожденного.
Следовательно, важнейшая задача акушеров-гинекологов и эндокринологов состоит в выявлении нарушений функции ЩЖ у женщин репродуктивного возраста еще на этапе планирования беременности. Особое внимание следует уделять женщинам, которым с целью достижения беременности планируется проведение индукции овуляции или программы ЭКО и ПЭ.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Максимова Н.А. 1 Арзамасцева М.А. 1 Ильченко М.Г. 1 Акопян Л.Г. 1 Некрасова Г.А. 1 Егорова А.С. 1 1 ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России Злокачественные опухоли щитовидной железы составляют 1,2–2,0 % в общей структуре онкологических заболеваний в России. С целью определения диагностической ценности ультразвукового исследования и аспирационной пункционной биопсии в выявляемости патологии щитовидной железы на этапах скрининга в РНИОИ мы произвели анализ исследований 181 пациента. Для уточнения характера патологии всем пациентам была проведена пункционная аспирационная биопсия (ПАБ) под УЗ- контролем. Возраст пациентов варьировал от 33 до 77 лет. У 102 (56,4 %) обследуемых из 181 определялись единичные, у 79 (43,6 %) – множественные узловые образования щитовидной железы. У 118 (65,2 %) пациентов наблюдались различные варианты диффузно-узлового зоба. Рак щитовидной железы (РЩЖ) обнаружен у 22 (12,1 %) человек, папиллярный и фолликулярный рак в равных количествах по 9 (41 %) человек, в 3 (13,6 %) случаях железистый рак и у 1 (4,5 %) пациента – аденокарцинома метастатического характера. Для РЩЖ ультразвуковыми критериями являлись гипоэхогенная, гетерогенная эхо-структура с неровными, нечеткими контурами с мелкими гиперэхогенными включениями – микрокальцинатами. У 4 (20 %) больных были диагностированы регионарные метастатически измененные лимфатические узлы от 1,5 до 2,5 см. У 14 (70 %) пациентов РЩЖ сочетался с узловым зобом, у 6 (30 %) были солитарные новообразования. Таким образом, проведение ПАБ под УЗ-контролем узловых образований в щитовидной железе повышает диагностическую ценность метода, подтверждая этиологию в узловых образованиях щитовидной железы.
 210 KB рак щитовидной железы ультразвуковое исследование пункционная аспирационная биопсия 1. Максимова Н.А., Кит О.И., Ильченко М.Г., Акопян Л.Г., Арзамасцева М.А. Ультразвуковая диагностика новообразований щитовидной железы с применением эластографии /Н.А. Максимова // Современные проблемы науки и образования. – 2016. – № 3 . URL: http://science-education.ru/ru/article/view?id=24645 (дата обращения: 21.06.2017). 2. Зубарева И.А. Анализ ультразвуковой картины рака щитовидной железы у жителей юго-западных районов Брянской области / И.А. Зубарева // Sono Ace International. – 2007. – № 16. – Рубрика: Эхография в онкологии. – С. 52-57. 3. Серов А.С. Значение тонкоигольной аспирационной биопсии под контролем УЗИ в диагностике очаговых образований щитовидной железы / А.С. Серов, Н.А. Попова, Л.Н. Жогова // Актуальные проблемы в онкологии: материалы XXI межрегион. научно-практич. конф. – Липецк, 2008. – С. 158-160. 4. Васильев Д.А. Пути улучшения диагностической значимости соноэластографии при дифференциальной диагностике узловых образований щитовидной железы / А.Д. Васильев, Е.В. Костромина, З.А.-Г. Раджабова // Клиническая и экспериментальная тиреоидология. – 2014. – Т.10, № 1. – С.38-43. 5. Cosgrove D., Piscaglia F., Bamber J., et al. EFSUMB Guidelines and Recommendations on the Clinical Use of Ultrasound Elastography. Part 2: Clinical Applications. Stuttgart – New York: Georg Thierne Verlag KG. 2013. . – URL: http://elastografia.ru/upload/iblock/66t/66189dc016693e57cdad15204749b5ad.pdf. 6. Сенча А. Ультразвуковая диагностика. Поверхностно-расположенные органы. – М.: Видар, 2015. – 512 с. 7. Кит О.И., Максимова Н.А., Дурицкий М.Н., Арзамасцева М.А., Ильченко М.Г. Роль ультразвукового исследования на этапах скрининга при проведении дней профилактики онкологических заболеваний молочных желез /О.И. Кит // Современные проблемы науки и образования. – 2015. – № 2-1 . URL: http://science-education.ru/ru/article/view?id=18134 (дата обращения: 21.06.2017).
210 KB рак щитовидной железы ультразвуковое исследование пункционная аспирационная биопсия 1. Максимова Н.А., Кит О.И., Ильченко М.Г., Акопян Л.Г., Арзамасцева М.А. Ультразвуковая диагностика новообразований щитовидной железы с применением эластографии /Н.А. Максимова // Современные проблемы науки и образования. – 2016. – № 3 . URL: http://science-education.ru/ru/article/view?id=24645 (дата обращения: 21.06.2017). 2. Зубарева И.А. Анализ ультразвуковой картины рака щитовидной железы у жителей юго-западных районов Брянской области / И.А. Зубарева // Sono Ace International. – 2007. – № 16. – Рубрика: Эхография в онкологии. – С. 52-57. 3. Серов А.С. Значение тонкоигольной аспирационной биопсии под контролем УЗИ в диагностике очаговых образований щитовидной железы / А.С. Серов, Н.А. Попова, Л.Н. Жогова // Актуальные проблемы в онкологии: материалы XXI межрегион. научно-практич. конф. – Липецк, 2008. – С. 158-160. 4. Васильев Д.А. Пути улучшения диагностической значимости соноэластографии при дифференциальной диагностике узловых образований щитовидной железы / А.Д. Васильев, Е.В. Костромина, З.А.-Г. Раджабова // Клиническая и экспериментальная тиреоидология. – 2014. – Т.10, № 1. – С.38-43. 5. Cosgrove D., Piscaglia F., Bamber J., et al. EFSUMB Guidelines and Recommendations on the Clinical Use of Ultrasound Elastography. Part 2: Clinical Applications. Stuttgart – New York: Georg Thierne Verlag KG. 2013. . – URL: http://elastografia.ru/upload/iblock/66t/66189dc016693e57cdad15204749b5ad.pdf. 6. Сенча А. Ультразвуковая диагностика. Поверхностно-расположенные органы. – М.: Видар, 2015. – 512 с. 7. Кит О.И., Максимова Н.А., Дурицкий М.Н., Арзамасцева М.А., Ильченко М.Г. Роль ультразвукового исследования на этапах скрининга при проведении дней профилактики онкологических заболеваний молочных желез /О.И. Кит // Современные проблемы науки и образования. – 2015. – № 2-1 . URL: http://science-education.ru/ru/article/view?id=18134 (дата обращения: 21.06.2017).
Узловые образования щитовидной железы встречаются у 4–5 % из общей популяции, являясь самой распространенной патологией среди эндокринных заболеваний. Злокачественные опухоли щитовидной железы составляют 1,2–2,0 % в общей структуре онкологических заболеваний в России. Распространенность злокачественных новообразований в России составил в 2005 году 62,4 на 100 тысяч населения, а в 2015 году 101,4 на 100 тысяч населения .
Дифференцированный рак щитовидной железы не имеет патогномоничных признаков и длительное время может протекать бессимптомно: нет ни болей, ни лихорадки, не страдает общее состояние и даже работоспособность. При наличии достаточно крупного узлового образования в проекции щитовидной железы пациента беспокоит только сам факт существования узла. Часто больной и не подозревает о существовании у него опухоли, которая является неожиданной находкой при врачебном осмотре.
Несмотря на доступность осмотру и возможности пальпаторного обследования, а также множества эффективных инструментальных способов распознавания патологии щитовидной железы: радионуклидная диагностика, магнитно-резонансная томография, компьютерная томография вызывают критическое отношение у специалистов из-за лучевой нагрузки на орган, остается необходимость более раннего ее выявления. Использование мультипараметрического ультразвукового исследования (УЗИ) при выявлении патологии и дифференциальной диагностике узловых образований на сегодняшний день стало основным и обязательным методом при подозрении на опухолевое поражение щитовидной железы. Согласно многочисленным отечественным и зарубежным публикациям чувствительность и специфичность методики серой шкалы и применение импульсноволновой допплерографии, позволяющей оценивать кровоток в узлах и щитовидной железе в дифференциальной диагностике злокачественных и доброкачественных процессов, колеблется в пределах 65–75 % .
Применение современных ультразвуковых технологий сканирования позволяет выявить нодулярные образования размерами от 0,3 см . Чувствительность этого метода в выявлении непальпируемых очагов опухолевого роста достигает 91 %. Пункционная аспирационная биопсия (ПАБ) под УЗ-контролем щитовидной железы получила широкое распространение в диагностике заболеваний щитовидной железы при непальпируемых и мелких узлах, позволяет уточнить необходимый тип хирургического вмешательства. Цитологическое исследование пунктата является наиболее быстрым методом дооперационной диагностики. Точность цитологического заключения при узловых образованиях достигает 77,3 %. Главным условием положительной цитологической диагностики узловых образований является правильное выполнение пункционной биопсии, с достаточным количеством клеток в цитологическом препарате для дачи цитологического заключения .
Остается необходимость более раннего выявления патологии щитовидной железы на основе совершенствования технологий диагностического процесса и поиска новых критериев для увеличения информативности ультразвукового исследования (УЗИ) в диагностике данной патологии. К таким критериям относят эластографические, получаемые с помощью компрессионной эластографии и эластографии сдвиговой волной, позволяющие объективно характеризовать упругие свойства различных тканевых образований, в том числе щитовидной железы .
Целью настоящего исследования было определение диагностической ценности УЗИ с использованием режима эластографии и ПАБ в выявляемости патологии щитовидной железы на этапах скрининга в Ростовском научно-исследовательском онкологическом институте (РНИОИ).
Материалы и методы. В основу работы положены данные о 181 пациентах, направленных на УЗИ из поликлинического отделения РНИОИ для определения и уточнения характера узловых образований в щитовидной железе. С целью верификации патологии всем пациентам была проведена ПАБ под УЗ-контролем.
Возраст пациентов варьировал от 33 до 77 лет. Среди обследованных пациентов мужчины и женщины составили 24 (13,3 %) и 157 (86,7 %) соответственно. УЗИ выполняли на аппарате «Logiq Е9», с использованием мультичастотного линейного датчика, работающего в диапазоне 6–15 МГц, что позволило выявить очаги опухолевого роста от 0,3 см.
УЗИ выполняли по стандартной методике с проведением серошкального исследования, цветового и энергетического допплеровского картирования (В-режим, ЦДК, ЭДК), а также с использованием режима эластографии, с помощью которого проводилась качественная оценка жесткости очаговых образований. Нами использовались типы карты окрашивания, при котором более жесткие ткани картируются синим цветом, менее жесткие зеленым, промежуточные являются красными . Также всем пациентам проводили исследование путей регионарного лимфооттока. При наличии лимфатических узлов, устанавливалась их связь с магистральными сосудами.
Расчет оценки эффективности (чувствительность, специфичность, точность) методов ультразвуковых исследований производился по стандартизированным методам оценки диагностической информативности.
Результаты исследования и их обсуждение
У 102 (56,4 %) обследуемых были выявлены единичные узлы щитовидной железы, у 79 (43,6 %) выявлены множественные узловые образования.
Наибольшую группу, более половины из обследованных 65,2 %, составили различные варианты диффузно-узлового зоба.
Распределение по нозологическим формам изменений в щитовидной железы, выявленных в процессе УЗИ, представлено в таблице 1.
Таблица 1
Патология щитовидной железы по нозологическим формам выявленная в процессе УЗИ
|
Нозология (n =181) |
Абс (n) |
% |
|
Рак щитовидной железы |
||
|
Аденома |
8,3 |
|
|
Коллоидные образования |
9,4 |
|
|
Узловой зоб |
65,2 |
|
|
Тиреоидит |
6,0 |
|
|
Всего |
Доброкачественный узел в щитовидной железе имеет изо- или гиперэхогенную однородную структуру, ровный контур, окруженный гипоэхогенным ободком.
На рисунке 1 визуализируется изоэхогенное узловое образование с ровными, четкими контурами, тонким гипоэхогенным ободком. При энергетическом допплеровском картировании выявляется обогащение сосудистого рисунка.
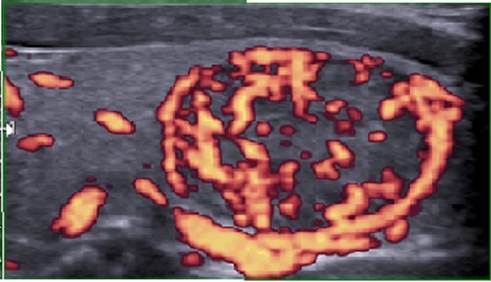
Рис.1. Токсическая аденома щитовидной железы. В режиме ЭДК
Кальцинаты встречаются как при доброкачественном, так и при злокачественном поражении. Чем крупнее узел, тем чаще выявляется гетерогенность его эхо-структуры.
Для РЩЖ ультразвуковыми критериями являлись гипоэхогенные узлы с гетерогенной эхо-структурой и неровными, нечеткими контурами. Из 20 пациентов с диагнозом рак щитовидной железы 15 (75 %) образований выглядели как гипоэхогенные, 5 (25 %) узла имели вид изоэхогенных. Злокачественный узел имел неоднородную структуру, у 6 (30 %) пациентов за счет кистозной дегенерации, у 3 (15 %) за счет обызвествления узла (рис. 2).
При компрессионной эластографии жесткие узлы, окрашенные в синий цвет, расценивались как малигнизированные, что позволило повысить информативность метода, однако мы столкнулись с рядом ограничений: в доброкачественных узловых образованиях с фиброзно-атрофической инволюцией и образованиях с кальцинатами регистрировалось повышение жесткости 35 (19,3 %), также мы не смогли оценить этим методом коллоидные кисты с жидким содержимым 17 человек (9,4 %), так как эластографический сигнал при этом, по сути, шум жидкости, и мы получали данные деформации низкого качества.
На рисунке 2 определяется солидное, гипоэхогенные узловое образование, неоднородной эхо-структуры с кальцинированными включениями, контуры неровные, нечеткие. При компрессионной эластографии окрашивается в синий цвет, что свидетельствует о его жесткости.
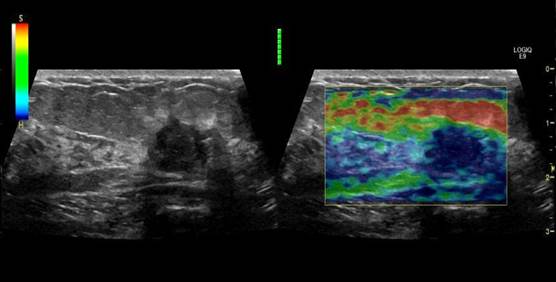
Рис.2. Папиллярный рак щитовидной железы. Компрессионная эластография
У 4 (20 %) больных определялись регионарные лимфатические узлы, размерами 1,5–2,5 см, пониженной эхо-плотности, неоднородной эхо-структуры.
При исследовании кровотока в узлах щитовидной железы получены противоречивые результаты. У 4 (20 %) пациентов в узловых образованиях до 1,0 см сосудистый рисунок отсутствовал. У 13 (65 %) больных РЩЖ выявлены сосуды внутри опухоли, но такая же картина наблюдалась в гиперфункционирующих автономных аденомах 11 (73,3 %). В доброкачественных фолликулярных образованиях у 98 (72,6 %) из 135 пациентов отмечался периферический тип кровотока. Таким образом, чувствительность признака «усиление васкуляризации опухоли» в выявлении РЩЖ составляет 100 % при специфичности до 88,2 %. При выявлении усиления сосудистого рисунка в узле можно заподозрить РЩЖ, в ряде случаев выявлялись узлы с выраженной внутриузловой васкуляризацией и наличием извитых, ветвящихся сосудов .
Из 20 больных РЩЖ только у 6 (30 %) не было сопутствующей узловой патологии, а у 14 (70 %) был выявлен фоновый узловой процесс. Доброкачественные заболевания щитовидной железы (тиреоидиты, узловой зоб, аденомы) явились фоном, на котором происходило развитие рака.
ПАБ получила широкое распространение в диагностике щитовидной железы. Выполнение ПАБ без визуального контроля особенно трудно при мелких и непальпируемых узлах. ПАБ под УЗ-контролем позволила получить материал для цитологического исследования из узлов 0,5–0,9 см .
Так как в щитовидной железе часто выявлялись множественные узловые образования, проводилась пункционная биопсия каждого узла, подозрительного на злокачественные по УЗ-картине и в узлах, в которых было выявлено усиление сосудистого рисунка и в узлах с повышенными критериями жесткости.
Цитологическое исследование пунктата является наиболее быстрым методом дооперационной диагностики. Ответ может быть получен в зависимости от используемых красителей уже через 5–60 минут. Главным условием успешной цитологической верификации при патологии щитовидной железы является правильное выполнение ПАБ, с достаточным количеством клеток, позволяющим дать цитологическое заключение. Данный метод является наиболее важным для дифференциальной диагностики доброкачественных и злокачественных очагов в щитовидной железе.
При цитологическом обследовании диагноз РЩЖ был установлен у 22 пациентов, из них папиллярный и фолликулярный рак был выявлен в равных количествах по 9 (41 %) случаев, у 3(13,6 %) больного железистый рак и у 1 (4,5 %) – аденокарцинома метастатического характера. Осложнения при ПАБ отмечались редко в виде кратковременных болевых ощущений, локальных гематом, единичный случай местного воспалительного характера. В таблице 2 представлены данные результатов ультразвукового и цитологического исследований. При сопоставлении ультразвуковой картины и цитологического заключения при УЗИ РЩЖ установлен не был у 2 (9 %) пациентов, было вынесено заключение – узловой зоб.
Результаты УЗИ и цитологического заключения представлены в таблице 2
Таблица 2
Результаты УЗИ и цитологического заключения
Достаточно высокий процент выявления рака среди узловых образований щитовидной железы можно объяснить следующим обстоятельством. Имеет значение определенный отбор больных в специализированное онкологическое учреждение, куда обращаются больные, у которых велика вероятность злокачественной опухоли .
Подтверждена важность цитологического метода в оценке своевременной диагностики и адекватного лечения больных. Чувствительность метода ПАБ под УЗ-контролем составляет 96 %, специфичность 91 %, точность 94 %, предсказуемость положительного теста 96 % и предсказуемость отрицательного теста 91 %.
Таким образом, мультипараметрическое ультразвуковое исследование, включающее В-режим, ЭДК, ЦДК, допплерометрию, эластографию и пункционную аспирационную биопсию под УЗ-контролем с последующим цитологическим исследованием является высокоинформативным методом диагностики в выявлении РЩЖ.
Библиографическая ссылка
Максимова Н.А., Арзамасцева М.А., Ильченко М.Г., Акопян Л.Г., Некрасова Г.А., Егорова А.С. ЗНАЧЕНИЕ МУЛЬТИПАРАМЕТРИЧЕСКОГО УЛЬТРАЗВУКОВОГО ИССЛЕДОВАНИЯ И ТОНКОИГОЛЬНОЙ АСПИРАЦИОННОЙ БИОПСИИ У ПАЦИЕНТОВ С УЗЛОВЫМИ ОБРАЗОВАНИЯМИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ НА ЭТАПАХ СКРИНИНГА // Современные проблемы науки и образования. – 2017. – № 5.;
URL: http://www.science-education.ru/ru/article/view?id=26927 (дата обращения: 29.10.2020).

 Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Резюме. Описан случай из собственной практики: клиническая характеристика больной с лейомиомой мочевого пузыря, морфологические особенности опухоли, проведенное лечение, его результат.
Опухоли мочевого пузыря по своему гистогенезу достаточно разнообразны. Среди новообразований мочевого пузыря различают опухоли эпителиального и неэпителиального строения. Первые составляют 95% всех новообразований мочевого пузыря, вторые — только 5% . Среди доброкачественных опухолей мочевого пузыря встречаются: фибромы, фибромиксомы, фибромиомы, гемангиомы, рабдомиомы, лейомиомы, нефромы. Все они составляют всего 0,3% по отношению к новообразованиям мочевого пузыря вообще . Несмотря на прогресс в области диагностических технологий, внематочная форма лейомиомы остается серьезной проблемой в онкологии. Данные литературы показывают, что внематочная лейомиома встречается крайне редко и трудна для диагностики. Она может возникать в мочеполовом тракте (вульве, яичниках, уретре, мочевом пузыре) . Возможен доброкачественный метастазирующий рост, диссеминированный перитонеальный лейомиоматоз (ДПЛ), интравенозный лейомиоматоз, паразитарная лейомиома и ретроперитонеальный рост. Учитывая небольшое количество наблюдений данной патологии, какой-либо определенный стандарт лечения не разработан. Прогноз заболевания однозначно определить сложно ввиду малого количества наблюдений. Изложенное выше обосновало цель данного сообщения — описание собственного опыта диагностики, лечения и последующего наблюдения больной с лейомиомой мочевого пузыря.
Больная Н., 41 год. В анамнезе менструальный цикл с 12 лет, регулярный, родов — 1, медицинских абортов — 2. Сопутствующие заболевания: вегето-сосудистая дистония по смешанному типу. Дисметаболический синдром. Наблюдение уролога не проводилось. В мае 2011 г. у больной появились дизурические расстройства, в связи с чем обследовалась по месту жительства. При ультразвуковом исследовании (УЗИ) заподозрена опухоль мочевого пузыря, больная была направлена на консультацию в Луганский областной клинический онкологический диспансер. По данным УЗИ, в мочевом пузыре по левой стенке определялось гипоэхогенное образование до 3,5 см в диаметре. Была выполнена компьютерная томография (КТ) органов брюшной полости и малого таза. Заключение КТ: в мочевом пузыре по левой передне-боковой стенке определяется объемное образование однородной гиперденсивной структуры, условными размерами 56×40 мм, с неровными бугристыми контурами, с признаками эндо- и экзофитного роста. Окружающая клетчатка была не изменена. В отделении больной была выполнена цистоскопия. При ревизии: слизистая умеренно гиперемирована. Отмечается расширение подслизистых вен, больше в области левой боковой стенки. Устья мочеточников щелевидные, симметричные, перистальтические движения с выбросом мочи. Левая стенка пролабирована в просвет мочевого пузыря за счет давления извне. Слизистая не изменена. Больная была осмотрена гинекологом, маммологом, хирургом. Выполнено трансвагинальное УЗИ. Какой-либо органной принадлежности опухоли и отдаленных метастазов выявлено не было. Выполнена трансабдоминальная аспирационная биопсия опухоли малого таза. Цитологическое заключение — кровь, слизь, детрит. Единичные эпителиальные клетки. Атипические клетки не найдены. 11.10.2011 г. выполнена операция — гемирезекция мочевого пузыря. При интраоперационной ревизии мочевого пузыря: в области левой стенки определялась солидная опухоль в толще стенки (рис. 1 в), без признаков прорастания слизистой оболочки (рис. 1 а, 2) и инвазии в паравезикальную клетчатку (рис. 1 б). Морфологическое заключение № 21090-92 от 21.10.2011 г. Лейомиома (рис. 3). Послеоперационный период протекал без осложнений.
Рис. 1. Опухоль мочевого пузыря: а — вид со стороны мочевого пузыря; б — вид со стороны малого таза; в — на разрезе Рис. 2. Опухоль мочевого пузыря: слизистая мочевого пузыря отсепарованная — прорастания нет Рис. 3. Патогистологические препараты
Заживление послеоперационного шва — первичным натяжением. Уретральный катетер удален на 14-е сутки, самостоятельное мочеиспускание восстановлено. При контрольном обследовании, через 4 мес после операции, общее состояние удовлетворительное, жалоб не предъявляет. По данным УЗИ органов брюшной полости и малого таза — признаков рецидива заболевания нет.
Заключение
Таким образом, комплексное использование ультразвукового мониторинга, КТ, диагностической цистоскопии позволяют улучшить результаты диагностики и лечения такой редко встречающейся патологии, как лейомиома мочевого пузыря. Учитывая небольшое количество наблюдений данной патологии, было сложно предложить какой-либо определенный стандарт лечения. Большее количество наблюдений позволит более точно определить характер клинического течения и тактику лечения при данном заболевании.
Учитывая возможное рецидивирование и метастазирование данной опухоли , мы рекомендуем проводить динамическое наблюдение пациентов с данной патологией не реже 1 раза в 3 мес в течение первого года, а затем 1 раз в 6 мес (УЗИ органов брюшной полости и малого таза, цистоскопия, рентгенография органов грудной полости).
Литература
1. Маринбах Е.Б. (1975) Клиническая онкоурология. М.: Медицина, 345.
2. Матвеев Б.П. (2003) Клиническая онкоурология. Москва, 717.
При опухолях почек ультразвуковое исследование является одним из ведущих в диагностике первичной опухоли. Опухоль обычно имеет вид гипоэхогенного, изоэхогенного или гиперэхогенного образования гетерогенной структуры, если имеется выход опухоли за капсулу почки, контур ее в этой области становится неровным, иногда нечетким. Минимальны размеры опухолей в почке, при которой ее удается визуализировать – 10-15 мм (при выходе опухоли за контур почки). Если опухоль расположена интрапаренхиматозно, она может быть не видна при размерах 20-25 мм, особенно при изоэхогенной структуре.
Кроме самой опухоли почки необходимо и возможно осматривать почечные сосуды и нижнюю полую вену, поскольку наличие в почечной и нижней полой венах опухолевого тромба типично для опухолей почек. Удается определить распространенность тромба (периренальный – в почечной вене, субпеченочный – в нижней полой вене ниже печени, ретропеченочный (рис. 1) и надпеченочный).
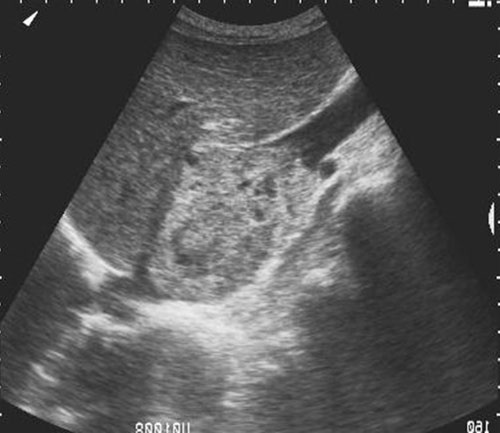
Рис. 1
Кроме исследования почек выполняется также исследование забрюшинных, а при необходимости и надключичных, лимфатических узлов и печени. В динамике после операции исследование производится в том же объеме, особое внимание обращают на ложе удаленной почки или на почку в области резекции (при органосохраняющей операции) для исключения местного рецидива.
