Е202, что это?

Большинство сухофруктов, поставляемых на пищевой рынок обрабатывают диоксидом серы (SO2), который обозначается на упаковках как консервант E220. Этот консервант препятствует развитию микроорганизмов в сухофруктах, позволяет им не темнеть, одним словом — придает аппетитный внешний вид и сильно увеличивает срок хранения.
Однако, диоксид серы (Е220) является высокотоксичным соединением. Чувствительность к отравлению диоксидом серы у всех людей различная. Например у меня, после поедания нескольких штук кураги, обработанных диоксидом серы уже через несколько минут начинается першение в горле и головная боль. Другие люди менее чувствительны к этому консерванту. Общие симптомы отравления диоксидом серы следующие: сильное першение в горле, насморк, кашель, охриплость, головная боль, тошнота. При отравлении высокими концентрациями возможно удушье и отек легких.
И хотя существуют нормы (предельно допустимые концентрации) на содержание диоксида серы при обработке различных продуктов, согласитесь, очень хочется избежать его поедания. И сделать это вполне реально.
Удаление диоксида серы из сухофруктов основано на хорошей растворимости этого вещества в воде. То есть достаточно вымачивать сухофрукты в воде комнатной температуры, при этом несколько раз меняя воду. Я вымачиваю 1 час в одной воде, далее хорошо промываю и снова вымачиваю еще полчаса. После этого сухофрукты теряют большую часть Е220 и их уже можно есть!
А теперь, чтобы не быть голословной, давайте проведем химический эксперимент по удалению консерванта E220 из пакетика с сухофруктами популярной марки «Chaka». Как видим, производитель честно указал данный консервант в составе продукта.

Высыпаем сухофрукты в чашку, заливаем фильтрованной водой комнатной температуры и оставляем на 1 час. Диоксид серы (SO2) растворяется в воде с образованием нестойкой сернистой кислоты, которая присутствует в воде в виде сульфит-ионов SO3 2−. Растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры.
В течение этого часа несколько раз перемешиваем сухофрукты в воде, чтобы SO2 лучше выходил. Через час получаем вот такую «водичку» (на самом деле это раствор диоксида серы, сернистой кислоты, как будет видно далее). «Водичка» окрашена в оранжево-красный цвет — это сказались вишни.

Химическая активность SO2 велика. Качественной реакцией на сульфит-ион SO3 2− и на SO2 является реакция с перманганатом калия (KMnO4) — это ни что иное, как марганцовка. В результате этой реакции происходит обесцвечивание фиолетового раствора марганцовки:

Берем несколько крупинок марганцовки. Я взяла 2 крупинки для начала:

Разводим в небольшом количестве воды:

Теперь сюда мы должны прибавить нашу «водичку». Если в ней присутствует диоксид серы, то произойдет реакция с обесцвечиванием фиолетового раствора. Если диоксид серы в воде не присутствует, то ничего не произойдет.

Добавляем две чайных ложки. Фиолетового цвета как ни бывало!

Берем еще несколько крупинок марганцовки и опускаем в «пробирку». Несколько крупинок должны дать темный фиолетово-черный раствор, все знают, насколько марганцовка сильно окрашивает: одна крупинка и можно испачкать весь дом.
Видим, что марганцовка даже в такой высокой концентрации оказалась полностью обесцвечена в результате произошедшей химической реакции. Это доказывает, что диоксид серы перешел в воду, в которой вымачивались сухофрукты, образовав серную кислоту и сульфаты.
Вопрос полностью ли он перешел, а если перешел частично, то сколько его осталось в сухофруктах остается открытым. Однако, думаю, большая часть все-таки уходит.
Резюме: удалить диоксид серы из сухофруктов можно вымачиванием в воде комнатной температуры, с обязательным последующим промыванием проточной водой.
Вы можете повторить этот нехитрый эксперимент у себя дома).
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Рева И.В. 4 Ямамото Т. 1 Гульков А.Н. 4 Такафуджи Я. 2 Балдаев С.Н. 4 Пикула К.С. 4 Индык М.В. 4 Лемешко Т.Н. 3 Багрянцев В.Н. 4 Рева Г.В. 4 1 Международный медицинский научно-образовательный центр 2 Институт медицинских исследований Ногучи 3 Тихоокеанский государственный медицинский университет Владивосток 4 Дальневосточный федеральный университет Учитывая возрастающую антибиотикорезистентность микроорганизмов, появление новых устойчивых к антибиотикам штаммов смертельно опасных инфекционных патогенов, поиск альтернативных медицинских препаратов приобретает особую актуальность на современном этапе. В работе представлен анализ собственных и данных литературы о роли экзогенного и эндогенного hydrogen peroxide в условиях нормы и патологии, на фоне микробной контаминации и при острой и хронической ишемии тканей. Показано, что наряду с отрицательной ролью внутриклеточного hydrogen peroxide, при парентеральном введении, он оказывает благоприятное лечебное действие при инфекциях, ишемических повреждениях нервной ткани, а также онкологической и эндокринной патологии. Отмечено, что в то время, как наружное применение препаратов hydrogen peroxide не вызывает никаких сомнений в необходимости его использования, применение его в качестве внутреннего лечебного препарата требует глубоких исследований вследствие многочисленных противоречивых данных.
 1478 KB гидроген пероксид ишемия апоптоз некроз гемоглобин активные формы кислорода (АФК) регенерация макрофаги «кислородный взрыв» 1. Дубинина Е.Е. Роль активных форм кислорода в качестве сигнальных молекул в метаболизме тканей при состояниях окислительного стресса // Вопросы медицинской химии. – 2001. – Т. 47; №6. – С. 561–581. 2. Dottore G.R., Chiarini R., De Gregorio M., Leo M., Casini G., Cestari L., Sellari-Franceschini S., Nardi M., Vitti P., Marcocci C., Marinò M. Selenium rescues orbital fibroblasts from cell death induced by hydrogen peroxide: another molecular basis for the effects of selenium in graves’ orbitopathy // Endocrine. 2017 Jan 17. doi: 10.1007/s12020–016–1226–9. 3. Fenton H.J.H. (1894). Oxidation of tartaric acid in presence of iron // J. Chem. Soc., Trans. 65 (65): 899–911. 4. Galadari S., Rahman A., Pallichankandy S., Thayyullathil F. Reactive oxygen species and cancer paradox: to promote or to suppress? // Free Radic Biol Med. 2017 Jan 11. pii: S0891–5849(17)30003–5. doi: 10.1016/j.freeradbiomed.2017.01.004. 5. Goldstein Sara, Meyerstein Dan, and Czapski Gidon (1993). «The Fenton reagents». Free Radical Biology and Medicine 15 (4): 435–445. DOI:10.1016/0891–5849(93)90043. 6. Haber F. and Weiss J. (1932). Über die Katalyse des Hydroperoxydes // Naturwissenschaften. DOI:10.1007/BF0150471. 7. He Y., Del Valle A., Qian Y., Huang Y.F. Near infrared light-mediated enhancement of reactive oxygen species generation through electron transfer from graphene oxide to iron hydroxide/oxide // Nanoscale. 2017 Jan 9. doi: 10.1039/c6nr08784a. 8. Hendriksen S.M., Menth N.L., Westgard B.C., Cole J.B., Walter J.W., Masters T.C., Logue C.J. Hyperbaric oxygen therapy for the prevention of arterial gas embolism in food grade hydrogen peroxide ingestion // Am J Emerg Med. 2016 Dec 14. pii: S0735–6757(16)30926–3. doi: 10.1016/j.ajem.2016.12.027. 9. Lago L., Nunes E.A., Vigato A.A., Souza V.C., Barbosa F.Jr., Sato J.R., Batista B.L., Cerchiaro G. Flow of essential elements in subcellular fractions during oxidative stress // Biometals. 2017 Jan 12. doi: 10.1007/s10534–016–9988–3. 10. Lisher J.P., Tsui H.T., Ramos-Montañez S., Hentchel K.L., Martin J.E., Trinidad J.C., Winkler M.E., Giedroc D.P. Biological and Chemical Adaptation to Endogenous Hydrogen Peroxide Production in Streptococcus pneumoniae D39 // mSphere. 2017 Jan 4;2(1). pii: e00291–16. doi: 10.1128/mSphere.00291–16. 11. Millonig G., Ganzleben I., Peccerella T., Casanovas G., Brodziak-Jarosz L., BreitkopfHeinlein K., Dick T.P., Seitz H.-K., Muckenthaler M.U., and Mueller, S. Sustained submicromolar H2O2 levels induce hepcidin via signal transducer and activator of transcription 3 (STAT3). J. Biol. Chem. – 2012.- 287, 37472–37482. 12. Okahashi N., Nakata M., Kuwata H., Kawabata, S. Streptococcus oralis induces lysosomal impairment of macrophages via bacterial hydrogen peroxide // Infect. Immun. – 2017.- 84, 2042– 050. 13. de Oliveira M.R., da Costa Ferreira G., Brasil F.B., Peres A. Pinocembrin Suppresses H2O2–Induced Mitochondrial Dysfunction by a Mechanism Dependent on the Nrf2/HO-1 Axis in SH-SY5Y Cells // ol Neurobiol. 2017 Jan 13. doi: 10.1007/s12035–016–0380–7. 14. Patel R.P., Moellering D., Murphy-Ullrich J., Jo H., Beckman J.S., Darley-Usmar V.M. Cell signaling by reactive nitrogen and oxygen species in atherosclerosis. Free Radic. Biol. Med. – 2000. – 1780–1794. 15. Pospíšil P. Production of Reactive Oxygen Species by Photosystem II as a Response to Light and Temperature Stress // Front Plant Sci. 2016 Dec 26;7:1950. doi: 10.3389/fpls.2016.01950. 16. Rai P., Parrish M., Tay I.J.J., Li N., Ackerman S., He F., Kwang J., Chow V. T., Engelward B.P. Streptococcus pneumoniae secretes hydrogen peroxide leading to DNA damage and apoptosis in lung cells. Proc. Natl. Acad. Sci. USA. – 2015. – 112, E3421–E3430. 17. Rajic Z., Tovmasyan A., de Santana O.L., Peixoto I.N., Spasojevic I., do Monte S.A., Ventura E., Rebouças J.S., Batinic-Haberle I. Challenges encountered during development of Mn porphyrin-based, potent redox-active drug and superoxide dismutase mimic, MnTnBuOE-2–PyP5+, and its alkoxyalkyl analogues // J Inorg Biochem. 2017 Jan 5;169:50–60. doi: 10.1016/j.jinorgbio.2017.01.003. 18. Sjöberg A.P., Trouw L.A., Clark S.J., Sjölander J., Heinegård D., Sim R.B., Day A.J., Blom A.M. The factor H variant associated with age-related macular degeneration (His-384) and the non-disease-associated form bind differentially to C-reactive protein, fibromodulin, DNA, and necrotic cells. J. Biol. Chem. – 2007. – 282, 10894–10900. 19. Singh S.K., Thirumalai A., Pathak A., Ngwa D.N., Agrawal A. Functional transformation of C-reactive protein by hydrogen peroxide // J Biol Chem. 2017 Jan 17. pii: jbc.M116.773176. doi: 10.1074/jbc.M116.773176. 20. Su C.K., Tseng P.J., Chiu H.T., Del Vall A., Huang Y.F., Sun Y.C. Sequential enzymatic derivatization coupled with online microdialysis sampling for simultaneous profiling of mouse tumor extracellular hydrogen peroxide, lactate, and glucose // Anal Chim Acta. 2017 Mar 1;956:24–31. doi: 10.1016/j.aca.2016.11.060. 21. de Santana J., Florêncio J.R., de Almeida L., Fernandes L.S., da Silva Filho A.A., Salvador M.J., Sousa O.V., Alves M.S. In vitro antibacterial activity of Vernonia polyanthes Less. leaf rinse extract (Asteraceae): prospecting new therapeutic options against Staphylococcus aureus infections! // Planta Med. 2016 Dec; 81(S 01):S1–S381 22. Sutariya S., Patel H. Effect of hydrogen peroxide on improving the heat stability of whey protein isolate solutions // Food Chem. 2017 May 15;223:114–120. doi: 10.1016/j.foodchem.2016.12.013. 23. Tan L., Zhang X., Mei Z., Wang J., Li X., Huang W., Yang S. Fermented Chinese Formula Shuan-Tong-Ling Protects Brain Microvascular Endothelial Cells against Oxidative Stress Injury // Evid Based Complement Alternat Med. 2016;2016:5154290. doi: 10.1155/2016/5154290. 24. Watanabe Y, Ishimori K, Uchida T. Dual role of the active-center cysteine in human peroxiredoxin 1: Peroxidase activity and heme binding // Biochem Biophys Res Commun. 2017 Jan 10. pii: S0006–291X(17)30043–8. doi: 10.1016/j.bbrc.2017.01.034. 25. Zhao J., Zhou H., Sun L., Yang B., Zhang L., Shi H., Zheng Y. Selection of suitable reference genes for quantative real time PCR in trabecular meshwork cells under oxidative stress // Tru radic res. – 2017. – jan., 15: 1–20. Doi 10.1080/10715762.20171282612.
1478 KB гидроген пероксид ишемия апоптоз некроз гемоглобин активные формы кислорода (АФК) регенерация макрофаги «кислородный взрыв» 1. Дубинина Е.Е. Роль активных форм кислорода в качестве сигнальных молекул в метаболизме тканей при состояниях окислительного стресса // Вопросы медицинской химии. – 2001. – Т. 47; №6. – С. 561–581. 2. Dottore G.R., Chiarini R., De Gregorio M., Leo M., Casini G., Cestari L., Sellari-Franceschini S., Nardi M., Vitti P., Marcocci C., Marinò M. Selenium rescues orbital fibroblasts from cell death induced by hydrogen peroxide: another molecular basis for the effects of selenium in graves’ orbitopathy // Endocrine. 2017 Jan 17. doi: 10.1007/s12020–016–1226–9. 3. Fenton H.J.H. (1894). Oxidation of tartaric acid in presence of iron // J. Chem. Soc., Trans. 65 (65): 899–911. 4. Galadari S., Rahman A., Pallichankandy S., Thayyullathil F. Reactive oxygen species and cancer paradox: to promote or to suppress? // Free Radic Biol Med. 2017 Jan 11. pii: S0891–5849(17)30003–5. doi: 10.1016/j.freeradbiomed.2017.01.004. 5. Goldstein Sara, Meyerstein Dan, and Czapski Gidon (1993). «The Fenton reagents». Free Radical Biology and Medicine 15 (4): 435–445. DOI:10.1016/0891–5849(93)90043. 6. Haber F. and Weiss J. (1932). Über die Katalyse des Hydroperoxydes // Naturwissenschaften. DOI:10.1007/BF0150471. 7. He Y., Del Valle A., Qian Y., Huang Y.F. Near infrared light-mediated enhancement of reactive oxygen species generation through electron transfer from graphene oxide to iron hydroxide/oxide // Nanoscale. 2017 Jan 9. doi: 10.1039/c6nr08784a. 8. Hendriksen S.M., Menth N.L., Westgard B.C., Cole J.B., Walter J.W., Masters T.C., Logue C.J. Hyperbaric oxygen therapy for the prevention of arterial gas embolism in food grade hydrogen peroxide ingestion // Am J Emerg Med. 2016 Dec 14. pii: S0735–6757(16)30926–3. doi: 10.1016/j.ajem.2016.12.027. 9. Lago L., Nunes E.A., Vigato A.A., Souza V.C., Barbosa F.Jr., Sato J.R., Batista B.L., Cerchiaro G. Flow of essential elements in subcellular fractions during oxidative stress // Biometals. 2017 Jan 12. doi: 10.1007/s10534–016–9988–3. 10. Lisher J.P., Tsui H.T., Ramos-Montañez S., Hentchel K.L., Martin J.E., Trinidad J.C., Winkler M.E., Giedroc D.P. Biological and Chemical Adaptation to Endogenous Hydrogen Peroxide Production in Streptococcus pneumoniae D39 // mSphere. 2017 Jan 4;2(1). pii: e00291–16. doi: 10.1128/mSphere.00291–16. 11. Millonig G., Ganzleben I., Peccerella T., Casanovas G., Brodziak-Jarosz L., BreitkopfHeinlein K., Dick T.P., Seitz H.-K., Muckenthaler M.U., and Mueller, S. Sustained submicromolar H2O2 levels induce hepcidin via signal transducer and activator of transcription 3 (STAT3). J. Biol. Chem. – 2012.- 287, 37472–37482. 12. Okahashi N., Nakata M., Kuwata H., Kawabata, S. Streptococcus oralis induces lysosomal impairment of macrophages via bacterial hydrogen peroxide // Infect. Immun. – 2017.- 84, 2042– 050. 13. de Oliveira M.R., da Costa Ferreira G., Brasil F.B., Peres A. Pinocembrin Suppresses H2O2–Induced Mitochondrial Dysfunction by a Mechanism Dependent on the Nrf2/HO-1 Axis in SH-SY5Y Cells // ol Neurobiol. 2017 Jan 13. doi: 10.1007/s12035–016–0380–7. 14. Patel R.P., Moellering D., Murphy-Ullrich J., Jo H., Beckman J.S., Darley-Usmar V.M. Cell signaling by reactive nitrogen and oxygen species in atherosclerosis. Free Radic. Biol. Med. – 2000. – 1780–1794. 15. Pospíšil P. Production of Reactive Oxygen Species by Photosystem II as a Response to Light and Temperature Stress // Front Plant Sci. 2016 Dec 26;7:1950. doi: 10.3389/fpls.2016.01950. 16. Rai P., Parrish M., Tay I.J.J., Li N., Ackerman S., He F., Kwang J., Chow V. T., Engelward B.P. Streptococcus pneumoniae secretes hydrogen peroxide leading to DNA damage and apoptosis in lung cells. Proc. Natl. Acad. Sci. USA. – 2015. – 112, E3421–E3430. 17. Rajic Z., Tovmasyan A., de Santana O.L., Peixoto I.N., Spasojevic I., do Monte S.A., Ventura E., Rebouças J.S., Batinic-Haberle I. Challenges encountered during development of Mn porphyrin-based, potent redox-active drug and superoxide dismutase mimic, MnTnBuOE-2–PyP5+, and its alkoxyalkyl analogues // J Inorg Biochem. 2017 Jan 5;169:50–60. doi: 10.1016/j.jinorgbio.2017.01.003. 18. Sjöberg A.P., Trouw L.A., Clark S.J., Sjölander J., Heinegård D., Sim R.B., Day A.J., Blom A.M. The factor H variant associated with age-related macular degeneration (His-384) and the non-disease-associated form bind differentially to C-reactive protein, fibromodulin, DNA, and necrotic cells. J. Biol. Chem. – 2007. – 282, 10894–10900. 19. Singh S.K., Thirumalai A., Pathak A., Ngwa D.N., Agrawal A. Functional transformation of C-reactive protein by hydrogen peroxide // J Biol Chem. 2017 Jan 17. pii: jbc.M116.773176. doi: 10.1074/jbc.M116.773176. 20. Su C.K., Tseng P.J., Chiu H.T., Del Vall A., Huang Y.F., Sun Y.C. Sequential enzymatic derivatization coupled with online microdialysis sampling for simultaneous profiling of mouse tumor extracellular hydrogen peroxide, lactate, and glucose // Anal Chim Acta. 2017 Mar 1;956:24–31. doi: 10.1016/j.aca.2016.11.060. 21. de Santana J., Florêncio J.R., de Almeida L., Fernandes L.S., da Silva Filho A.A., Salvador M.J., Sousa O.V., Alves M.S. In vitro antibacterial activity of Vernonia polyanthes Less. leaf rinse extract (Asteraceae): prospecting new therapeutic options against Staphylococcus aureus infections! // Planta Med. 2016 Dec; 81(S 01):S1–S381 22. Sutariya S., Patel H. Effect of hydrogen peroxide on improving the heat stability of whey protein isolate solutions // Food Chem. 2017 May 15;223:114–120. doi: 10.1016/j.foodchem.2016.12.013. 23. Tan L., Zhang X., Mei Z., Wang J., Li X., Huang W., Yang S. Fermented Chinese Formula Shuan-Tong-Ling Protects Brain Microvascular Endothelial Cells against Oxidative Stress Injury // Evid Based Complement Alternat Med. 2016;2016:5154290. doi: 10.1155/2016/5154290. 24. Watanabe Y, Ishimori K, Uchida T. Dual role of the active-center cysteine in human peroxiredoxin 1: Peroxidase activity and heme binding // Biochem Biophys Res Commun. 2017 Jan 10. pii: S0006–291X(17)30043–8. doi: 10.1016/j.bbrc.2017.01.034. 25. Zhao J., Zhou H., Sun L., Yang B., Zhang L., Shi H., Zheng Y. Selection of suitable reference genes for quantative real time PCR in trabecular meshwork cells under oxidative stress // Tru radic res. – 2017. – jan., 15: 1–20. Doi 10.1080/10715762.20171282612.
Актуальность. Отсутствие этиотропного лечения инфекционных заболеваний, вызванных опасными антибиотикорезистентными патогенами, частые случаи развития гипериммунных реакций и осложнений на фоне приёма дорогостоящих препаратов с огромным перечнем противопоказаний, отсутствие патогенетически обоснованного консервативного лечения онкобольных, свидетельствуют о том, что поиск альтернативных препаратов в стратегии консервативного лечения многих заболеваний на современном этапе является наиболее актуальным .
Изучение противомикробных веществ в настоящее время является одним из самых новых направлений исследований. Известно, что hydrogen peroxide убивает бактерии, предотвращает заболевание десен и образование зубного налета. Исследования показали, что сифилис, кандидоз и различные вирусные инфекции поддаются лечению перекисью водорода. Эмпирически применяют пероксид и при инсультах/инфарктах, а также эндокринной патологии.
Известно, что перекись водорода необходима для образования гормоноподобных веществ – простагландинов, которые регулируют энергетический обмен в организме. Под воздействием витамина С образуется дополнительное количество перекиси, которая, в свою очередь, активирует синтез простагландинов . Тем не менее, отсутствие принципов применения hydrogen peroxide терапии, а также незнание потенциальных осложнений и известные случаи эмболии с последующим применением интубации, диктуют разработку стратегии в дозировке препарата и выявления механизмов его воздействия на клетки для адекватного патогенетически обоснованного лечения, профилактики, реабилитации.
Токсикокинетика и токсикодинамика hydrogen peroxide практически не изучена . Тем не менее, имеющиеся немногочисленные исследования на мышах и птицах, а также клеточных культурах человека свидетельствуют о несомненных перспективах применения hydrogen peroxide в медицинской практике, что и явилось основанием для выбора нами направления исследований .
Цель исследования. Систематизация имеющихся данных о возможных механизмах биологического воздействия hydrogen peroxide на клетки организма человека в условиях различной патологии.
Задачами исследования явилось проведение анализа механизмов воздействия hydrogen peroxide на клетки в условиях ишемии и микробной контаминации.
Материалы и методы исследования
Материал для патоморфологических исследований получен в соответствии с приказом Минздравмедпрома РФ от 29.04.94 N 82 «О порядке проведения патологоанатомических вскрытий». Забор материала производился через сутки после клинической смерти, всего изучено 52 биопсии. В работе использован трупный материал мозга человека в период с сентября 2013 по февраль 2015 г.) с диагнозом – инсульт, инфаркт (25/27), который распределили с учётом возраста и пола. Выбор участков забора биоптатов основывался на том, что одними из регуляторов артериального давления (АД) являются паравентрикулярные нейросекреторные ядра гипоталамуса, участвующие в выработке АДГ (антидиуретического гормона) – вазопрессина. Биопсийный материал гипоталамуса фиксировался по прописи для подготовки к иммуногистохимическим исследованиям сразу после забора. Исключение возможных артефактов основано на данных, полученных при специальном исследовании на собаках, свидетельствующих, что при сохранении трупов при температуре 7°С до 4–6 часов в морфологии гипоталамо-гипофизарной нейросекреторной системы микроскопически видимых изменений не наблюдается, кроме некоторого снижения интенсивности специфических реакций на нейросекрет. Использованы классические гистологические методы исследования с окрашиванием гематоксилином и эозином для получения общей морфологической картины нейронов переднего гипоталамуса человека. Анализ материала проведён с помощью микроскопа Olympus – Bx82 и цифровой камеры CDх82 с фирменным программным обеспечением.
Результаты исследования и их обсуждение
Нами отмечено, что у части нейронов при хронической ишемии мозга, в зоне, удалённой от острой ишемии и развившегося инсульта, имеется светлоокрашенное перинуклеарное пространство, которое может свидетельствовать о вступлении клеток в апоптоз (рис. 1). При этом, в нашем исследовании в апоптоз вступают как нейроглиальные клетки, так и нейроны (рис. 2). Встречаются апоптические тельца – результат апоптических процессов в нервной ткани вследствие ишемии. Это свидетельствует о том, что локальные изменения в ткани мозга присутствуют, но сам процесс ишемии мозга следует считать генерализованным по отношению к ткани всего мозга.
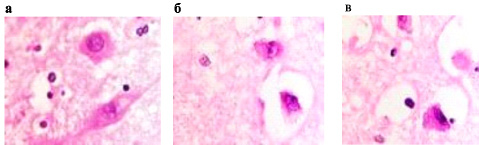
Рис. 1 а-в. Нейроны переднего гипоталамуса. Апоптоз глии и нейронов. Окраска г/э. Микрофото. Ув. х800
Структура ядер в нейронах переднего гипоталамуса свидетельствует о различном уровне дезорганизации хроматина, разрушении ядерной оболочки, апоптозе нейронов. Гранулы приобретают более тёмный коричневый цвет. В некоторых клетках вся цитоплазма заполнена гранулами, ядра не идентифицируются (рис. 2).
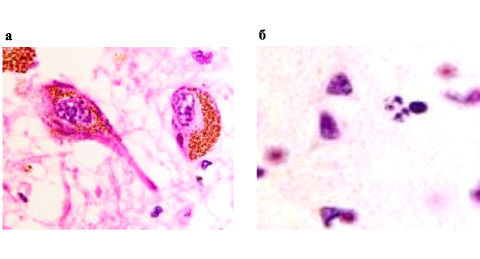
Рис. 2. Нейроны переднего гипоталамуса при ишемическом инсульте в области прецентральной извилины: а – гранулосодержащие нейроны; б – апоптическое тельце. Окраска г/э. Микрофото. Ув. х1000
Приобретение резкой базофилии окружающей нейроны глией также свидетельствует об апоптозе. Однако следует подчеркнуть, что патоморфологическое изменение нервных клеток наблюдается не только при ишемии мозга, но и при олигемических, аноксических, гипоксических и гипогликемических состояниях. Ишемическое изменение клеток характерно для хронической недостаточности кислорода, что характеризуется специфической морфологической картиной, свидетельствующей о проблеме ишемии ткани, как следствии нарушения в системе передачи кислорода клеткам гемоглобином. Вопрос включений в цитоплазме нервных клеток не закрыт, так как гранулы не изменяют цвет после проводки по спиртам, что может быть связано не с их возможной липофусциновой природой, а с наличием в них Fe3+.
Lago L., Nunes E.A., Vigato A.A., Souza V.C., Barbosa F.Jr., Sato J.R., Batista B.L., Cerchiaro G. (2017) отмечали нарушения содержания элементов металлов в головном мозге пациентов с нейродегенеративными заболеваниями . Авторами были проведены эксперименты с использованием двух способов доступа к окислительному стрессу: лечение клеток с Н2О2 или Ар-42 пептида в его олигомерной форме. Оба вида лечения вызвали накопление маркеров окислительного стресса, такие как окисленные белки и липиды, а также изменения в ДНК, что также отмечали Millonig G., Gansleben I., Peccerella T. et al. . Что касается микроэлементов, клетки, обработанные Н2О2, показали более высокие уровни Zn и более низких уровней Са в ядрах по сравнению с контрольными клетками, без каких-либо окислительных обработок. С другой стороны, клетки, обработанные с A – 42 пептида в олигомерной форме показали более высокие уровни Mg, Ca, Fe и Zn в ядрах по сравнению с контрольными клетками . Эти различия свидетельствуют, что поток металла в клеточных органеллах во время внутреннего и внешнего окислительного состояния (обработка Н2О2) отличается от результатов современных методов лечения нейродегенеративных заболеваний.
Singh S, Goo JI, Noh H, Lee SJ, Kim MW, Park H, Jalani HB, Lee K, Kim C, Kim WK, Ju C, Choi Y. (2017) основываясь на том, что астроциты играют ключевую роль в гомеостазе мозга, защищая нейроны от нейротоксических стимулов, в том числе окислительного стресса, рассматривают в качестве многообещающей стратегии для снижения повреждения головного мозга нейропротекторные терапевтические средства, которые повышают функциональность астроцитов путем усиления митохондриальной функции после воздействия H2O2 .
Zhao J., Zhou H., Sun L., Yang B., Zhang L., Shi H., Zheng Y. ( 2017), напротив, считают главным виновником индуцированной дисфункции в трабекулярном эндотелии (ТЭ) дренажной системы глаза, ведущим к глаукоме, Н2О2, являющейся наиболее широко используемым средством для индукции окисления в клетках ТЭ в пробирке. При этом авторы считают, что геном имеет разную чувствительность к окислительному стрессу, индуцированному экзогенным Н2О2 .
В анализах связывания лигандов на основе очищенной пентамерной Н2О2 обработанные СРБ связаны с иммобилизованными белками, включая IgG, бета-амилоид пептид 1–42, C4b-связывающий белок и фактор Н Ca2 + -независимым образом. Авторы пришли к выводу, что Н2О2 является биологическим модификатором функции и структуры лиганда распознавания СРБ .
De Santana F.R., Dalboni L.C., Nascimento K.F., Konno F.T., Alvares-Saraiva A.M., Correia M.S., Bomfim M.D., Casarin R.C., Perez E.C., Lallo M.A., Peres G.B., Laurenti M.D., Benites N.R., Buchi D.F., Bonamin L.V. (2017), изучая цитотоксическую активность макрофагов, наблюдали снижение миграции моноцитов и их фагоцитарной активности к месту инфекции под воздействием изменения электропотенциалов, которые объясняют клиническое ухудшение в естественных условиях при переходе 2–валентного железа в Fe3+, обладающим меньшей способностью отдавать кислород тканям . Большинство важнейших окислительно-восстановительных процессов протекает с участием иона металла, являющегося переносчиком одного электрона. Из этих реакций наиболее хорошо изучено взаимодействие перекиси водорода с ионом Fe2+. Реакцию открыл Фентон в 1894 г., а в 1932 г. Габер и Вайсс предложили механизм, который лишь с небольшими изменениями принят в настоящее время. Окисление органических соединений реактивом Фентона связано с генерированием гидроксильных радикалов. Однако предполагается, что гидроксильные радикалы участвуют в реакции Фентона, согласно которой перекись водорода в комбинации с солями железа окисляет альдозы до озонов . В ночное время в качестве основного «поставщика» радикалов гидроксила в жидкой фазе выступает реакция Фентона – разложение Н2О2 ионами железа (П). которую можно рассматривать как реакцию переноса электрона . Нерц и Вагнер высказали предположение, что кислород передается от перекиси водорода к ортофосфористой кислоте и что ион двухвалентного железа участвует в повторяющейся произвольное число раз цепи реакций, проходя соответствующие промежуточные степени окисления железа, причем ион двухвалентного железа регенерируется. Обрыв цепи вызывается превращением иона двухвалентного железа в ион трехвалентного железа, который не обладает способностью передавать кислород, что усугубляет ишемическое повреждение клеток .
Sutariya S., Patel H. (2017), наоборот, пришли к положительным результатам, воздействуя на изолят сывороточного белка (WPI) растворами различных концентраций H2O2 в диапазоне концентраций 0–0.144 в деионизированной воде. Образцы анализировали на термостабильность, реологические свойства, уровень денатурации -лактоглобулин (β-LG) и альфа-лактальбумина (α-LA) . Образцы, обработанные концентрации H2O2, превышающей 0,072, показали значительное улучшение в термостабильности, и снижение сывороточного белка к денатурации и агрегации. После обработки H2O2 (> 0,072 HTPR) раствор оставался в жидком состоянии после термической обработки при 120°С, в то время как контрольные образцы перешли в гель после термической обработки. Детальный анализ этих образцов позволил предположить, что улучшение тепловой стабильности после обработки раствора H2O2 было связано со значительным сокращением сульфгидрильной-дисульфид реакции обмена в процессе денатурации бета-LG и альфа-LA .
He Y., Del Valle A., Qian Y., Huang Y.F. (2017) предложили метод нанотерапии рака с помощью реакции Фентона на основе облучения светом тканей, что способствует переносу электронов к Fe (III) из FeOxH и ускоряет их реакцию с О2, образуя супероксидные анион-радикалы, которые затем подвергаются реакции диспропорционирования для производства Н2О2. Н2О2 затем реагирует с Fe (II) образуя FeOxH, как посредник в реакции Фентона, производя гидроксильные радикалы. Авторы показали, что GO-FeOxH может быть использован в качестве активируемого наноагента, обеспечивающего эффективную терапию рака .
Hydrogen peroxide открыт Луи Тенаром в 1818 г. Разлагается с выделением О2, поэтому высокие концентрации при наружном применении обеспечивают противомикробный антисептический эффект, при этом удлиняются сроки заживления из-за повреждения прилегающих к ране клеток, но при этом происходит образование рубцов из-за разрушения клеток кожи. При приёме внутрь летальная доза 30 % раствора пероксида водорода – 50–100 мл. При соприкосновении с тканями под влиянием содержащихся ферментов каталазы, раствор перекиси разлагается и выделяет молекулярный кислород, который окисляет органические вещества различных клеток . По данным исследований, период полураспада Н2О2 в крови человека – меньше одной десятой секунды; однако по сведениям, полученным Макнофтоном, полураспад перекиси может длиться до двух секунд и зависит от скорости смешивания с кровью. Чарльз Фарр обнаружил, что повышение содержания кислорода в тканях происходит только через 40–45 минут после инъекции перекиси.
Известно, что для выполнения фагоцитарной функции эффекторными иммуноцитами необходим каскад реакций с выделением hydrogen peroxide . Макрофаги способствуют поддержанию гомеостаза, очищая организм от стареющих и апоптотических клеток, восстанавливая ткани после инфекции и травмы, выполняя ведущую роль в защите организма. Для реализации этой функции они имеют набор распознающих рецепторов, кислородозависимые и кислородонезависимые механизмы киллинга микроорганизмов. Существенную роль в защите организма от инфекции играют макрофаги альвеолярные и фагоциты слизистой оболочки кишечника. Первые «работают» в относительно бедной опсонинами среде, поэтому они экспрессируют большое количество паттерн распознающих рецепторов, включая скавенджер-рецепторы, маннозные рецепторы, β-глюкан специфические рецепторы, дектин-1 и др. При микробной инфекции в очаг проникновения микробов дополнительно мигрирует большое число воспалительных моноцитов, способных дифференцироваться в различные клеточные линии в зависимости от цитокинового окружения. Ферментные системы НАДФ-Н-оксидазы, супероксиддисмутазы, NO-синтазы, генерируют активные формы неорганических окислителей, участвующих в деструкции фагоцитированного объекта: пероксид водорода (Н2О2), супероксид анион (О2–), синглетный кислород (1O2), радикал гидроксила (OH-), гипохлорид (OCl-), оксид азота (NO). Активация НАДФ-Н-оксидазы приводит к формированию так называемого «кислодородного взрыва». Первичным продуктом «кислородного взрыва» является супероксидный анион О2–, который образуется при переносе НАДФ-H-оксидазой электрона на кислород . Супероксидный анион обладает слабым бактерицидным эффектом и является недолговечным. В результате реакции, катализируемой ферментом супероксидисмутазой (СОД), из двух молекул супероксидного аниона формируется перекись водорода, обладающая сильным микробицидным эффектом. При окислении хлоридов перекисью водорода в присутствии миелопероксидазы (МПО) образуется мощный цитотоксический агент – гипохлорная кислота HOCl, при её окислении супероксидным радикалом – гидроксильный радикал ОН, при окислении гипохлорит-иона перекисью водорода формируется синглетный кислород 1О2, который является источником образования другого бактерицидного вещества – озона О3. При взаимодействии гипохлорной кислоты с аминогруппой формируется микробицидное производное монохлорамина – R-NHCl.
Заключение
Анализ собственных данных и данных литературы показал, что при поражениях мозга, когда повышается уровень «активной формы» железа, аскорбиновая кислота может стимулировать образование ОН радикала, выступая в роли прооксиданта. Тиолы в восстановленной форме в присутствии «активных форм» металлов переменной валентности могут образовывать реактивные соединения типа RS (тиоловый радикал) и ОН . При этом в качестве вторичных посредников принимают активное участие АФК (О2, Н2О2, ОН и гидроперекиси липидов), осуществляя регулирующую роль в процессах роста клеток, апоптозе, клеточной адгезии, свертывания крови и т.д. .
Имеются прямые доказательства того, что низкие (микромолярные) нано- концентрации Н2О2 могут увеличивать рост или усиливать ответ на стимуляцию роста во многих типах клеток млекопитающих, а антиоксиданты подавляют нормальную клеточную пролиферацию. Так низкие концентрации Н2О2 (100 мкМ) стимулируют рост фибробластов легких хомяков . Ингибирование СОД или глутатион пероксидазы увеличивает клеточную пролиферацию. Возможно, что ОН, генерируемый в реакции Фентона, может являться фактором, усиливающим клеточную пролиферацию и активность митоген-активируемой протеинкиназы (МАР-киназа). Это основано на том, что ловушки ОН (маннитол, диметилсульфоксид) и хелаторы железа тормозят стимулируемую Н2О2 пролиферацию клеток .
С АФК связана передача сигнала от тромбоцитарного фактора роста, эпидермального фактора роста, трансформирующего фактора роста Р-1, фактора некроза опухолей (ФНО-а) . Участие интерлейкина-1 и интерферона в сигнальной транедукции вязывают с образованием О2, а фактора некроза опухолей (ФНО-а) – с Н2О2. В астроцитах интерлейкин-lfl повышает генерацию Н2О2, что приводит к снижению фосфатазной активности и активации МАР-киназы. ФНО-а через повышение образования АФК активирует факторы транскрипции NF-kp и АР-1, процессы апоптоза .
Известно, что вазоактивный пептид (ангиотензин II) проявляет свое действие на процессы мышечного сокращения и клеточный рост гладких мышц сосудов через генерацию внутриклеточного О2 . Мнение об источниках О2 НАДН и НАДФН-оксидазы, активируемых ангиотензином, опровергается данными, что именно Н2О2 ответственна за рост клеток гладкой мускулатуры сосудов. Получены данные об участии Н2О2 в сигнальной трансдукции тромбоцитарного фактора роста (PQGF) и трансформирующего фактора роста TGF-*pi. Предполагают, что Н2О2 действует через инактивацию протеинтирозинфосфатаз, как и эпидермальный фактор роста.
Тем не менее, вопрос о значении роли Н2О2 в процессах внутриклеточной сигнализации далек от разрешения. Полученные данные противоречивы и неоднозначны . Только комплексный подход с учетом специфики и особенности функционирования конкретных клеток, исследования на уровне генома позволят с новых позиций оценить роль Н2О2 в механизмах регуляции функции клеток.
Учитывая то, что перекись водорода является недорогим веществом, которое не может быть запатентовано и не имеет никакой коммерческой стоимости, можно считать его наиболее перспективным для исследований механизмов его воздействия на гистофизиологию клеток с целью дальнейших стратегических решений в профилактике, лечении и реабилитации нейродегеративных повреждений мозга.
Работа выполнена при поддержке научного фонда ДВФУ, в рамках государственного задания 2014/36 от 03.02.2014 г.
Содержание
Библиографическая ссылка
Рева И.В., Ямамото Т., Гульков А.Н., Такафуджи Я., Балдаев С.Н., Пикула К.С., Индык М.В., Лемешко Т.Н., Багрянцев В.Н., Рева Г.В. БИОЛОГИЧЕСКИЕ И ХИМИЧЕСКИЕ ЭФФЕКТЫ ЭНДО- И ЭКЗОГЕННОГО HYDROGEN PEROXIDE НА КЛЕТОЧНЫЕ СТРУКТУРЫ ОРГАНИЗМА ЧЕЛОВЕКА. // Международный журнал прикладных и фундаментальных исследований. – 2017. – № 4-2. – С. 361-367;
URL: https://applied-research.ru/ru/article/view?id=11473 (дата обращения: 29.10.2020). Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Общая информация
Сорбат калия представляет собой калиевую соль сорбиновой кислоты. В пищевой промышленности маркируется как добавка E202 и используется в качестве консерванта.
Впервые сорбиновая кислота была получена из сока рябины в 1859 году. В 1939 году было открыто ее антимикробное действие. А уже в середине 50-х годов началось промышленное производство сорбиновой кислоты и ее использование в качестве консерванта.
Консервант E202 является наиболее растворимым из сорбатов. Растворимость сорбата калия при комнатной температуре составляет 138 грамм вещества в одном литре воды. Добавка E202 является природным консервантом. Чаще всего сорбат калия добывают из косточек некоторых растений. Также консервант E202 может быть получен синтетическим путем. Химическая формула сорбата калия: C6H7KO2.
Основные параметры пищевой добавки E202:
- Вкус – нет.
- Цвет – белый.
- Консистенция – гранулы или порошок.
Влияние на организм
Польза
Сорбиновая кислота, и ее соль сорбат калия в частности, входит в список наиболее популярных консервантов, вследствие ее безопасности для организма человека. При утверждении сорбата калия в качестве пищевой добавки E202 были произведены многочисленные исследования, показавшие что добавку можно считать безвредной в дозах не превышающих предельно-допустимую норму.
Пищевая добавка E202 не оказывает на организм ни канцерогенного, ни мутагенного воздействия, не является тератогеном. Предельно допустимая норма консерванта E202 в готовом изделии устанавливается отдельно для каждого вида продуктов и в среднем составляет от 0,02 до 0,2%. Точную дозировку для конкретного типа продуктов можно узнать в нормативных документах.
Вред
У людей с повышенной чувствительностью к различным компонентам сорбат калия может вызывать раздражение кожи и слизистых оболочек. Однако алергенность вещества незначительна.
Использование
Добавку E202 используют в пищевой промышленности в качестве консерванта:
- Основное применение — в производстве сыров и колбасных изделий (сорбат калия может останавливать рост плесневых грибов).
- В хлебобулочной промышленности – пищевую добавку E202 могут добавлять в тесто при производстве ржаного хлеба для предотвращения образования на продукте меловой плесени.
- В производстве шоколадных и кондитерских изделий – в качестве консерванта с нейтральным вкусом.
- В производстве консервировании овощей и соков.
- В приготовлении пряных и кислых соусов восточной кухни – сорбат калия является достаточно эффективным антимикробным средством при высоких значениях кислотности. Сорбат калия предотвращает образование дрожжей и грибов в данных продуктах.
Наиболее часто пищевую добавку E202 можно встретить в следующих видах продуктов: маргарины, майонезы, колбасные изделия, копчености, джемы, соки, безалкогольные напитки, вина, сахарные и мучные кондитерские изделия.
Законодательство
Пищевая добавка E202 входит в список разрешенных добавок во многих странах мира, в том числе в России.



