Диета при тромбоэмболии легочной артерии
Что касается течения, то симптоматика данного состояния может отличаться в каждом отдельном случае: возможны как бессимптомное протекание, так и эпизоды с яркой клинической картиной.
Как уже было сказано, патогномонических (присущих только ТЭЛА) симптомов нет. Несмотря на это, можно выделить несколько групп признаков, которые часто встречаются при возникновении тромбоэмболии.
Так, в структуре кардиального синдрома объединены различные сердечные нарушения. Очень часто проявляются симптомы лёгочного сердца: нехватка воздуха, набухание вен на шее, систолический шум над мечевидным отростком. Боль, напоминающая таковую при инфаркте миокарда, также является частой. Нередко к вышеупомянутым признакам добавляется ускоренное сердцебиение.
Для лёгочного синдрома характерны одышка, прежде всего проявляющаяся при попытке вдохнуть. Нехватка воздуха носит характер внезапной, беспокоит даже в состоянии покоя. Само дыхание учащённое. Больные жалуются на боль в груди, утомляющий непродуктивный кашель, иногда с прожилками крови. Из-за одышки лицо и шея синеют, в то время как нижняя часть тела сохраняет свой естественный цвет или бледнеет.
Потеря сознания или его нарушение и судороги являются симптомами церебрального синдрома.
Реже встречаются проявления абдоминального (боль в животе) и почечного (олигоурия) синдромов.
Если подытожить, то наиболее часто встречаются следующие симптомы: одышка, учащённое дыхание, учащённое сердцебиение и боль в грудной клетке.
Версия для печати
Тромбоэмболия легочной артерии (ТЭЛА) — это закупорка ее просвета тромбом, или реже, эмболом — «пробкой» другого состава, например, пузырьком воздуха, каплями жира или опухолевыми клетками. У наркоманов причиной может стать любое вещество, которое они вводят себе в вену, например, тальк.
Тромбоэмболия легочной артерии может развиться, когда фрагмент тромба из глубоких вен отрывается и оказывается с током крови в правых отделах сердца, и легочной артерии. Тромб закупоривает всю легочную артерию или одну из ее ветвей, что препятствует кровотоку к части легкого и вызывает ухудшение газообмена. Без лечения пораженный участок легкого погибает, и снижается доставка кислорода к жизненно важным органам, иногда даже развивается состояние, угрожающее жизни. Тромбы обычно образуются в глубоких венах ног, примерно в 90% случаев причиной ТЭЛА является тромб из подколенной вены, однако в 2-3% источником являются верхние конечности.
Факторы риска развития тромбоза глубоких вен — некоторые наследственные заболевания (дефициты факторов крови, препятствующих свертыванию), или провоцирующие факторы- например, тяжелые операции, травма, пожилой возраст, злокачественные опухоли, гиподинамия, курение, использование оральных контрацептивов, беременность. Диагностика венозных тромбоэмболий.
Очень часто тромбоз глубоких вен (ТГВ) протекает бессимптомно. В некоторых случаях пациент умирает от ТЭЛА внезапно, до того, как специалисты успевают принять какие-то меры. В одном исследовании, которое включало примерно 2400 протоколов вскрытия, обнаружилось, что ТЭЛА явилось причиной смерти примерно 10% стационарных больных, но только каждый пятый пациент имел симптомы тромбоза глубоких вен. Поэтому, в связи с низким уровнем диагностики тромбоза глубоких вен, необходим активный поиск симптомов этого заболевания, чтобы предупредить смертельную ТЭЛА, а именно:
- У пациента с тромбозом глубоких вен может быть отек, боль и чувство жара в одной ноге (обычно в области стопы), венозный застой и варикозное расширение вер, признаки хронической венозной недостаточности. Нужно обратить внимание на локальный отек, разницу в размере голени более 3 см, и ямки при надавливании пальцем (признак отека).
- При тромбоэмболии легочной артерии бывает одышка, кровохарканье, кашель, хрипы в легких, учащенное дыхание, чувство перебоев в сердце, тахикардия, головные боли, лихорадка. Может быть напряжение шейных вен, и выслушивается акцент второго тона и ритм галопа. При массивной ТЭЛА (когда поражается большой фрагмент легкого), у пациента развиваются гипотония, синкопальное состояние, тяжелая гипоксемия, или внезапная остановка сердца.
- Диагностика тромбоза глубоких вен или ТЭЛА должна включать в себя оценку факторов риска, клинические данные и результаты диагностических исследований.
- Объективное обследование при подозрении на тромбоз глубоких вен должно включать в себя осмотр нижних конечностей для выявления отека, покраснения, напряжения кожи . Однако даже массивный тромбоз вен ног может оказаться совершенно бессимптомным, а активная пальпация — спровоцировать смещение тромба и тромбоэмболию.
- Исследование крови на D-димер (продукт расщепления фибриногена, нормальное значение — до 500 нг/мл) позволяет исключить тромбоз глубоких вен — если результат отрицательный и пациент относится к группе низкого риска по тромбозу. Если у пациента средний или высокий клинический риск тромбоза глубоких вен и повышенный D-димер (более 50 нг/мл), то ему необходимо выполнить дуплексное ультразвуковое исследование вен нижних конечностей.
- Дуплексное ультразвуковое исследование для исключения тромбов в бедренной и подколенной венах позволяет с высокой точностью выявить проксимальный тромбоз глубоких вен. Если есть проблема в венах плюсны, то исследование будет менее точным и может дать ложноотрицательные результаты. УЗИ позволяет оценить проходимость вен и измерить скорость кровотока.
- Контрастная венография — это «золотой стандарт» диагностики тромбоза глубоких вен, однако это инвазивный метод, который сопровождается высокой лучевой нагрузкой. Данное исследование необходимо проводить при подозрении на тромбоз вен стопы и нижних отделов голени при сомнительных результатах ультразвукового исследования (6).
Содержание
- Диагностика тромбоэмболии легочной артерии
- Организация профилактики венозных тромбоэмболических осложнений
- Обучение пациента
- Краткая информация для пациентов
- Оценка риска венозных тромбоэмболических осложнений у пациента
- Таблица. Профилактика тромбоэмболических осложнений в зависимости от уровня риска
- Список литературы
- Фотоматериалы
Диагностика тромбоэмболии легочной артерии
Диагностические исследования для выявления ТЭЛА позволяют подтвердить наличие этой патологии, определить степень ее тяжести, и провести дифференциальную диагностику с другими состояниями, сходными с ТЭЛА, например, с инфарктом миокарда, пневмонией и пневмотораксом. Если врач подозревает у больного массивную ТЭЛА, то необходимо экстренно начать лечение, а затем дообследовать. Типичные исследования в этом случае:
- Рентгенография органов грудной клетки, которая позволяет исключить наиболее распространенные заболевания. Но при ТЭЛА обычно никаких изменений вначале не прослеживается.
- ЭКГ у пациента с ТЭЛА может показать неспецифические изменения сегмента ST и зубца Т. Обычно ЭКГ важна для исключения сердечных причин симптоматики.
- Анализ газов артериальной крови отражает вентиляционно — перфузионные отношения(V˙/Q˙) — при ТЭЛА будет низкое парциальное давление кислорода в крови. Нормальный показатель V˙/Q˙ в 0.8 отражает процесс нормальной альвеолярной вентиляции в сочетании с нормальной перфузией, а при ТЭЛА перфузия по отношению к вентиляции, поэтому показатель начинает расти. Если у пациента имеется нестабильность гемодинамики на фоне ТЭЛА, то результаты газов артериальной крови могут выявить метаболический ацидоз.
- Отрицательный результат исследования D-димера позволяет исключить ТЭЛА, но положительный результат не подтверждает это состояние, так как D -димер повышается при многих других заболеваниях.
- Спиральная компьютерная томография легочной артерии позволяет подтвердить диагноз ТЭЛА, или исключить другие причины патологии органов грудной клетки, например, расслаивающуюся аневризму аорты. Однако, это исследование доступно не во всех лечебных учреждениях, или состояние пациента может быть слишком тяжелым для его выполнения (8,9). Профилактика тромбоза глубоких вен и ТЭЛА после операций.
Риск развития ТГВ после операций зависит от вида выполненного хирургического вмешательства, и наличия других факторов риска. Любые операции, после которых бывает длительная неподвижность пациента, например нейрохирургические, операции на крупных сосудах, абдоминальные вмешательства и ортопедические операции (протезирование суставов нижних конечностей) сопровождаются особенно высоким риском венозных тромбоэмболических осложнений (8,10).
Последнее руководство Американской ассоциации (ACCP) рекомендует всем стационарам разработать формальную стратегию профилактики тромбоза глубоких вен, которая включает компьютеризированную систему принятия решения, стандартные схемы учета факторов риска и профилактики, регулярный контроль соблюдения этой стратегии (11).
В руководстве сделан акцент на нежелательность применения аспирина для профилактики венозных тромбоэмболических осложнений во всех группах пациентов. Ранняя и частая активизация больных — это главный способ профилактики в группах низкого риска при общехирургических вмешательствах. Лечение венозных тромбоэмболических осложнений.
Антикоагулянты, теплые компрессы и приподнятое положение больной конечности — вот первые меры помощи приТГВ. В соответствии с последними доказательными рекомендациями, раннее лечение острого ТГВ постельным режимом и антикоагулянтами должно быть по мере возможности заменено антикоагулянтами в сочетании с ранней активизацией больного.
Если у вашего пациента случилась ТЭЛА, то ему при малейших признаках дыхательной недостаточности потребуется оксигенотерапия. Этими признаками являются: учащенное дыхание, участие вспомогательных мышц в акте дыхания, низкая сатурация или сниженное парциальное давление кислорода при исследовании газов крови. Пациенту с тяжелой дыхательной недостаточностью может потребоваться интубация трахеи и перевод на ИВЛ. Также могут быть необходимы вмешательства, направленные на стабилизацию гемодинамики, инфузионная терапия и другие. По назначению врача вводят обезболивающие препараты.
У пациента с ТЭЛА и нестабильной гемодинамикой и отсутствием тяжелого кровотечения, врач может принять решение о проведении фибринолитичекой (растворяющей тромбы) терапии, например — активатора тканевого плазминогена, урокиназы, или стрептокиназы. Экстренная эмболэктомия, которую выполняют кардиохирурги — это метод спасения жизни при массивной тромбоэмболии, когда фибринолитическая терапия неэффективна или категорически противопоказана.
Фильтр, который устанавливают в нижнюю полую вену (кава-фильтр) нужен для того, чтобы уловить тромбы и не дать им оказаться в легочной артерии. Новые модели кава-фильтрав являются съемными и их можно ставить на период особенно высокого риска тромбозов, или затем оставить, как постоянный фильтр (7,8). Фильтр рекомендуется устанавливать пациентам с подтвержденным венозными тромбоэмболическими осложнениями, у которых имеются серьезные проблемы с приемом полных доз антикоагулянтов ( например, пациенты с кровотечениями или после недавно выполненной нейрохирургической операции). Съемные фильтры можно использовать у пациентов со временными противопоказаниями к терапии антикоагулянтами, например, при травме (12).
Организация профилактики венозных тромбоэмболических осложнений
Всем стационарным больным необходимо проводить рутинную оценку риска венозных тромбоэмболических осложнений при поступлении. Затем врач назначает профилактику, если она необходима, а медицинская сестра выполняет эти назначения. Задачи медсестры — измерение окружности голени пациента для побора компрессионного трикотажа и обучение пациента использованию этого средства профилактики. Помните, что свободные компрессионные чулки неэффективны, а очень тугие — затрудняют кровоток.
Объясните пациенту важность механической профилактики тромбоэмболических осложнений, например, пневматической компрессии. Убедитесь в том, что пневматические устройства работают правильно и используются в соответствии с инструкцией. Необходимо поощрять раннюю активизацию пациентов после хирургических вмешательств. Когда пациент лежит в кровати или сидит в кресле, приподнимайте ему ноги для профилактики венозного застоя.
Для больных хирургического профиля, которым показана профилактика нефракционированными гепаринами, нужно учитывать исходное значение активированного частичного тромбопластинового времени (АЧТВ), уровни гематокрита, и тромбоцитов в крови. Эти лабораторные исследования повторяют с частотой, которая обозначена врачом в назначениях. Пациенты, которые получают постоянно гепарин, должны проходить исследование АЧТВ каждые 4 часа. Уровень тромбоцитов контролируют каждые 2-3 дня.
Если пациенту требуется долговременная терапия антикоагулянтами (варфарин), то их прием начинают на 4-5 сутки от начала терапии гепаринами. Гепарины отменяют тогда, когда международное нормализованное отношение (МНО) достигнет терапевтического диапазона 2.0-2.30, причем такой результат должен быть получен при двух последовательных измерениях с интервалом в 24 часа (9). Необходимо отслеживать симптомы внутреннего кровотечения у пациента — это могут быть синяки, кровь в кале или в моче, боль в животе, гипотония, тахикардия. При выполнении венепункций нужно накладывать давящую повязку, и не массировать место введения. Внутримышечные инъекции выполнять нежелательно! Всегда нужно держать наготове витамин К (антидот варфарина) и протамина сульфат (антидот гепарина), чтобы быстро купировать действие антикоагулянтов при кровотечении. Помните, что протамин сульфат категорически противопоказан пациентам с аллергией на рыбу!
Обучение пациента
Пациенту необходимо рассказать о причинах венозных тромбоэмболических осложнений, и о том, как их можно предупредить. Объясните, что нужно сразу обращаться к врачу, если появятся признаки и симптомы ТГВ (отек одной ноги, покраснение кожи, боль и чувство распирания в голени), или ТЭЛА (внезапно наступившая одышка, боль в грудной клетке и кровохарканье). Если пациент выписывается домой на терапии варфарином, нужно дать ему следующую информацию:
- Ограничить потребление продуктов, богатых витамином К, и если они употребляются постоянно, не менять их количество (турнепс, репа, листовой салат, зеленая горчица, шпинат, брюссельская капуста, брокколи, белокочанная капуста, цветная капуста, спаржа, соя), чтобы не повлиять на МНО и не повысить риск кровотечения или тромбоза.
- Соблюдать график проверок МНО, которые назначает врач, так как у варфарина очень узкое терапевтическое окно — при низком МНО есть риск тромбоза, а при более высоком, чем нужно — кровотечения.
- Обязательно советоваться с врачом или фармацевтом перед началом приема любых витаминов, лекарственных трав, БАД и новых лекарств. Например, жень-шень, гингко, имбирь, чеснок, китайские травы, ромашка, анис, фенхель, и арника в сочетании с варфарином существенно повышают риск кровотечения. Зверобой и зеленый чай могут снижать эффективность варфарина, а безрецептурные лекарства, содержащие аспирин, напроксен, ибупрофен или кетопрофен — увеличивают риск кровотечения при совместном приеме с варфарином.
- Ограничить употребление алкоголя, так как при его избытке повышается риск кровотечения.
- Сообщать любому медицинскому работнику о лечении варфарином, особенно при лечении зубов, выполнении лабораторных исследований и операций.
- Беречься от травм, использовать электрические бритвы и мягкие зубные щетки, избегать тяжелого и травмоопасного физического труда, контактных видов спорта и всегда пользоваться перчатками при работе в саду.
- Немедленно обращаться за медицинской помощью при возникновении симптомов кровотечения. Это может быть — кровотечение из носа или десен, моча красного или коричневого цвета, темный стул или кал с примесью крови, боль в животе (часто является единственным признаком внутреннего кровотечения), изменение уровня сознания (что может указывать на кровоизлияние в мозг), и тяжелая или невыносимая головная боль, слабость, головокружение. Лучше всего носить при себе информацию о приеме варфарина (например, вложить в паспорт выписку).
- Бросить курить, сбросить лишний вес, пить много воды (если это не противопоказано) и регулярно заниматься посильными физическими упражнениями, например, ходить около двух километров в день.
- Женщинам, у которых был ТГВ или ТЭЛА, противопоказаны оральные контрацептивы.
Длительные перелеты или поездки в автомобиле также могут привести к ТГВ или даже смертельным случаям ТЭЛА, возможно, по причине снижения содержания кислорода артериальной крови в сочетании с обезвоживанием и длительным нахождением в положении сидя. Хотя такие путешествия повышают риск ТГВ в 2-4 раза, этого недостаточно, чтобы назначать профилактику всем подряд. Однако, в руководствах имеются рекомендации — если человек летит в самолете или едет в машине более 8 часов, ему нужно одевать компрессионный трикотаж, пить воду и стараться шевелиться — вставать, ходить по салону самолета или делать остановки в пути, на худой конец, если не встать и не остановиться — шевелить ногами и не сидеть в одной позе (9).
Люди с факторами риска венозных тромбоэмболических осложнений, которым предстоят длительные перелеты, должны советоваться с врачом о мерах профилактики — применения компрессионного трикотажа или антикоагулянтов (прием аспирина для профилактики венозных тромбоэмболических осложнений сейчас считается нецелесообразным). При высоком риске таких осложнений рекомендуется компрессионный трикотаж с компрессией 15-30 мм РТ.ст. или однократное введение низкомолекулярного гепарина в дозе по весу за 2 часа до вылета (9).
Краткая информация для пациентов
Что происходит при ТГВ и ТЭЛА?
При тромбозе глубоких вен прекращается кровоток, но может довольно быстро развиваться обходное кровообращение. В результате этого у пациента может не быть симптомов тромбоза, или же они очень слабо выражены. Когда появляются жалобы и симптомы, в их основе лежит местное воспаление и недостаток кислорода в тканях, это зависит от уровня тромбоза — чем он выше, тем хуже. Осложнения — это развитие хронической венозной недостаточности, которая сопровождается болью, отеками, изменениями окрашивания кожи и язвами на больной ноге и тромбоэмболия легочной артерии (6). ТЭЛА — это острое прекращение кровотока в легочной артерии из-за тромбов. В этом случае нарушается легочный газообмен и развивается дыхательная недостаточность.
При массивной тромбоэмболии легочной артерии значительно увеличивается нагрузка на правый желудочек сердца, как из-за препятствия кровотока, так и из-за спазма сосудов легких. В самых тяжелых случаях наблюдается развитие острой сердечной недостаточности.
Оценка риска венозных тромбоэмболических осложнений у пациента
Для этого применяются различные балльные системы, которые позволяют оценить вероятность развития венозных тромбоэмболических осложнений у того или иного пациента. В целом, они основаны на наличии тромбоза или эмболии в анамнезе, онкологического заболевания, недавно перенесенного хирургического вмешательства, иммобилизации, и оценке возраста и частоты сердечных сокращений. В зависимости от типа и числа факторов риска, степень риска венозных тромбоэмболических осложнений у пациента может быть низкой, средней, высокой (9). На основании этого может быть назначено адекватное профилактическое лечение. Оптимально включать оценку риска венозных тромбоэмболических осложнений в обследование пациента медицинской сестрой при поступлении в стационар (10). Ниже приведена таблица, с помощью которой можно оценить риск венозных тромбоэмболических осложнений у больного.
Таблица. Профилактика тромбоэмболических осложнений в зависимости от уровня риска
|
Степень риска |
Риск ТГВ в отсутствие профилактики |
Предполагаемая профилактика |
|
Низкая (пациент может ходит, предстоит малая операция, терапевтические больные, которые могут ходить) |
Менее 10% |
Специфическая профилактика не показана, ранняя и активная мобилизация больного |
|
Умеренная (общехирургические операции, полостные гинекологические и урологические операции, терапевтические больные в тяжелом состоянии) |
10-40% |
Низкомолекулярные гепарины (НМГ) в рекомендованных дозах, низкие дозы нефракционированного гепарина 2-3 раза в сутки, или фондапарин |
|
Умеренная плюс риск кровотечения |
10-40% |
Механическая профилактика – прерывистая пневматическая компрессия, или компрессионный трикотаж по назначению врача |
|
Высокая (артропластика тазобедренного или коленного сустава, операции в связи с переломом бедра, пациенты с тяжелыми травмами или повреждениями спинного мозга) |
40-80% |
Низкомолекулярные гепарины в рекомендованных дозах, фондапарин, оральные антикоагулянты с поддержанием МНО в интервале от 2 до 3 |
|
Высокая плюс высокий риск кровотечения |
40-80% |
Механическая профилактика – прерывистая пневматическая компрессия, или компрессионный трикотаж по назначению врача |
Список литературы
Фотоматериалы
Общее
Тромбоэмболия легочной артерии (ТЭЛА) – острая окклюзия тромбом или эмболом ствола, одной или нескольких ветвей легочной артерии. ТЭЛА – составная часть синдрома тромбоза системы верхней и нижней полых вен (чаще тромбоза вен малого таза и глубоких вен нижних конечностей), поэтому в зарубежной практике эти два заболевания объединяют под общим названием – «венозный тромбоэмболизм» .
ТЭЛА – интернациональная проблема практической медицины: в структуре летальности от сердечно–сосудистых заболеваний она занимает третье место после инфаркта миокарда (ИМ) и инсульта. В экономически развитых странах 0,1% населения ежегодно погибает от ТЭЛА . Диагностика ТЭЛА – трудная задача для практикующих врачей в связи с тем, что клиническая картина ассоциируется с обострением основного заболевания (ИБС, ХСН, ХЗЛ) или является одним из осложнений онкологических заболеваний, травм, обширных хирургических вмешательств, а специфические методы диагностики, такие как ангиопульмонография, сцинтиграфия, перфузионно–вентиляционные исследования с изотопами, спиральная компьютерная и магнито–резонансная томография, осуществимы в единичных научно–медицинских центрах. При жизни диагноз ТЭЛА устанавливается менее чем в 70% наблюдений. Летальность среди пациентов без патогенетической терапии, по данным различных авторов, составляет 40% и более, при массивной тромбоэмболии достигает 70%, а при своевременно начатой терапии колеблется от 2 до 8% .
Эпидемиология. В европейских странах, в частности, во Франции, ТЭЛА регистрируется до 100000 случаев, в Англии и Шотландии с ТЭЛА госпитализируется 65000, а в Италии – 60000 пациентов ежегодно . В США в год выявляют до 150000 больных, переносящих ТЭЛА, как осложнение различных заболеваний. Среди госпитализированных пациентов 70% приходится на долю терапевтических больных . По данным Фрамингемского исследования, ТЭЛА составляет 15,6% от всей внутригоспитальной летальности, причем на хирургических больных приходилось 18%, а 82% составили больные с терапевтической патологией .
Planes A. с сотрудниками (1996) указывают, что ТЭЛА является причиной 5% летальных исходов после общехирургических и 23,7% – после ортопедических операций. Легочная эмболия занимает одно из ведущих мест в акушерской практике: смертность от этого осложнения колеблется от 1,5 до 2,7% на 10000 родов, а в структуре материнской смертности составляет 2,8–9,2% .
Подобный разброс эпидемиологических данных обусловлен отсутствием точной статистики распространенности ТЭЛА, что объясняется объективными причинами:
- почти в 50% случаев эпизоды ТЭЛА остаются незамеченными;
- в большинстве случаев при аутопсии только тщательное исследование легочных артерий позволяет обнаружить тромбы или остаточные признаки перенесенной ТЭЛА;
- клиническая симптоматика ТЭЛА во многих случаях схожа с заболеваниями легких и сердечно–сосудистой системы;
- инструментальные методы обследования больных с ТЭЛА, имеющие высокую диагностическую специфичность, доступны узкому кругу медицинских учреждений.
Этиология. Принципиально венозный тромбоз любой локализации может осложниться развитием ТЭЛА. Наиболее эмболоопасной его локализацией является бассейн нижней полой вены, с которым связано около 90% всех ТЭЛА . Чаще всего первичный тромб находится в илиокавальных сегментах или проксимальных отделах вен нижних конечностей (подколенно–бедренный сегмент) . Подобная локализация венозного тромбоза осложняется ТЭЛА в 50% случаев. Венозный тромбоз с локализацией в дистальных отделах глубоких вен нижних конечностей (голень) осложняется ТЭЛА от 1до 5% .
В последнее время появились сообщения об учащении случаев ТЭЛА из бассейна верхней полой вены (до3,5%) в результате постановки венозных катетеров в отделениях реанимации и блоках интенсивной терапии .
Значительно реже к ТЭЛА приводят тромбы с локализацией в правом предсердии при условии его дилатации или мерцательной аритмии.
Патогенез тромбоза вен определяется триадой Вирхова: 1 – повреждение эндотелия (чаще воспаление – флебит); 2 – замедление венозного кровотока; 3 – гиперкоагуляционный синдром. Факторы, определяющие реализацию триады Вирхова, представлены в таблице 1.

Наиболее опасными для развития ТЭЛА являются «флотирующие тромбы», имеющие точку фиксации в дистальном отделе венозного русла; остальная его часть расположена свободно и на всем протяжении не связана со стенками вены, причем их протяженность может колебаться от 5 до 20 см. «Флотирующий тромб» обычно формируется в венах меньшего калибра, и процесс тромбообразования распространяется проксимально в более крупные: из глубоких вен голени – в подколенную вену, затем в глубокую и общую бедренную артерию, из внутренней – в общую подвздошную, из общей подвздошной – в нижнюю полую вену .
Размеры тромбоэмболов определяют их локализацию в сосудах легочной артерии, обычно они фиксируются в местах деления сосудов легкого. По данным различных авторов, эмболизация ствола и главных ветвей легочной артерии имеет место в 50%, долевых и сегментарных – в 22%, мелких ветвей – в 30% случаев (рис. 1). Одновременное поражение артерий обоих легких достигает 65% из всех случаев ТЭЛА, в 20% – поражается только правое, в 10% – только левое легкое, нижние доли поражаются в 4 раза чаще, чем верхние доли .
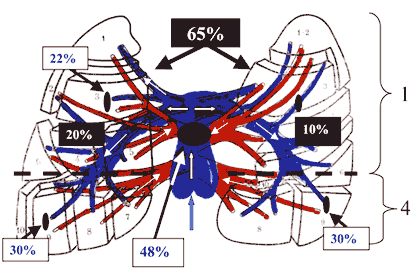
Рис.1 Частота локализации тромбоэмболов в системе легочной артерии
Патогенез клинических проявлений при ТЭЛА. При возникновении ТЭЛА имеют место два механизма патологического процесса: «механическая» обструкция сосудистого русла и гуморальные нарушения, возникающие в результате выброса биологически активных субстанций.
Обширная тромбоэмболическая обструкция артериального русла легких (уменьшение общей площади просвета артериального русла на 40–50%, что соответствует включению в патологический процесс 2–3 ветвей легочной артерии) увеличивает общее легочное сосудистое сопротивление (ОЛСС), препятствующее выбросу крови из правого желудочка, уменьшает наполнение левого желудочка, что суммарно приводит к снижению минутного объема (МО) крови и падению АД.
ОЛСС увеличивается и за счет вазоконстрикции в результате высвобождения биологически активных веществ из агрегатов тромбоцитов в тромбе (тромбоксаны, гистамин, серотонин), это подтверждается данными клинических и экспериментальных наблюдений . При диагностическом зондировании или мониторировании центральной гемодинамики (ЦГ) у больных инфарктом миокарда (ИМ) после введения катетера (зонд Swan–Ganz), который по диаметру сопоставим с размерами тромбэмболов, в правые отделы сердца и систему легочной артерии до сегментарных сосудов, клиники ТЭЛА не наблюдается. В эксперименте при инфузии сыворотки крови животных, переносящих ТЭЛА, здоровым животным зарегистрированы гемодинамические и клинические признаки, характерные для ТЭЛА.
В результате окклюзии ветвей легочной артерии появляются неперфузируемые, но вентилируемые участки легочной ткани – «мертвое пространство», манифистируемое увеличением вентиляционно–перфузионного отношения > 1 (в норме V/Q = 1). Выброс биологически активных веществ способствует локальной бронхообструкции в зоне поражения, с последующим снижением выработки альвеолярного сурфактанта и развитию ателектаза легочной ткани, который появляется на 2–е сутки после прекращения легочного кровотока.
Увеличение ОЛСС сопровождается развитием легочной гипертензии, открытием бронхолегочных шунтов и увеличением сброса крови справа – налево. Возникшая артериальная гипоксемия может усугубляться сбросом крови справа – налево на уровне предсердий через овальное окно в результате повышения давления в правом желудочке и предсердии.
Снижение доставки кислорода к легочной ткани через систему легочных, бронхиальных артерий и воздухоносных путей может явиться причиной развития инфаркта легкого.
Классификация ТЭЛА. Европейским кардиологическим обществом предложено классифицировать ТЭЛА по объему поражения легочных сосудов (массивная и немассивная), по остроте развития патологического процесса (острая, подострая и хроническая рецидивирующая) .
ТЭЛА расценивается, как массивная, если у пациентов развиваются явления кардиогенного шока или гипотония (не связанная с гиповолемией, сепсисом, аритмией).
Немассивная ТЭЛА диагностируется у пациентов с относительно стабильной гемодинамикой без выраженных признаков правожелудочковой недостаточности.
По клинической симптоматике ряд авторов выделяют три варианта ТЭЛА:
1. «Инфарктная пневмония» (соответствует тромбоэмболии мелких ветвей легочной артерии) – манифестирует остро возникшей одышкой, усугубляющейся при переходе пациента в вертикальное положение, кровохарканьем, тахикардией, периферическими болями в грудной клетке (место поражения легкого) в результате вовлечения в патологический процесс плевры.
2. «Острое легочное сердце» (соответствует тромбоэмболии крупных ветвей легочной артерии) – внезапно возникшая одышка, кардиогенный шок или гипотензия, загрудинная стенокардитическая боль.
3. «Немотивированная одышка» (соответствует рецидивирующей ТЭЛА мелких ветвей) – эпизоды внезапно возникшей, быстро проходящей одышки, которые после некоторого времени могут проявиться клиникой хронического легочного сердца. У пациентов с таким течением заболевания в анамнезе обычно отсутствуют хронические кардио–пульмональные заболевания, а развитие хронического легочного сердца является следствием кумуляции предшествующих эпизодов ТЭЛА .
Клинические признаки тромбоэмболии. Клиническая картина ТЭЛА определяется объемом поражения легочных артерий и преэмболическим кардио–пульмональным статусом пациента (ХСН, ХНЗЛ). Частота (в %) основных жалоб пациентов при ТЭЛА, по данным различных авторов , представлена в таблице 2.
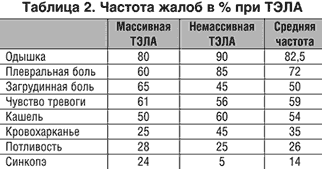
Внезапно возникшая одышка – наиболее частая жалоба при ТЭЛА, усиливающаяся при переходе пациента в положение сидя или стоя, когда уменьшается приток крови к правым отделам сердца. При наличии блока кровотока в легком уменьшается наполнение левого желудочка, что способствует снижению МО и падению АД. При СН одышка уменьшается при ортопозиции пациента, а при пневмонии или ХНЗЛ она не меняется при изменении положения больного.
Периферическая боль в грудной клетке при ТЭЛА, наиболее характерная для поражения мелких ветвей легочной артерии, обусловлена включением в воспалительный процесс висцеральных листков плевры. Боль в правом подреберье свидетельствует об остром увеличении печени и растяжении Глиссоновой капсулы. Загрудинная стенокардитическая боль характерна для эмболии крупных ветвей легочной артерии, возникает в результате острого расширения правых отделов сердца, приводящего к сдавлению коронарных артерий между перикардом и расширенными правыми отделами сердца. Наиболее часто загрудинная боль имеет место у пациентов ИБС, переносящих ТЭЛА.
Кровохарканье при инфарктной пневмонии в результате ТЭЛА в виде кровяных полосок в мокроте отличается от кровохарканья при стенозе митрального клапана – кровяная мокрота.
Физикальные признаки (%) ТЭЛА представлены в таблице 3.
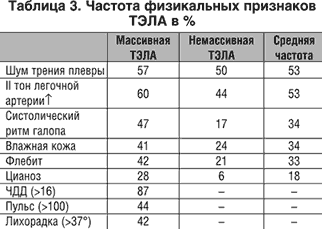
Усиление II тона над легочной артерией и появление систолического ритма галопа при ТЭЛА свидетельствуют о повышении давления в системе легочной артерии и гиперфункции правого желудочка.
Тахипноэ при ТЭЛА чаще всего превышает 20 дыхательных движений в 1 мин. и характеризуется стойкостью и поверхностным характером дыхания.
Уровень тахикардии при ТЭЛА находится в прямой зависимости от размеров поражения сосудов, выраженности нарушений центральной гемодинамики, дыхательной и циркуляторной гипоксемии.
Повышенная потливость имеет место в 34% случаев среди пациентов преимущественно с массивной ТЭЛА, является следствием повышенной симпатической активности, сопровождающейся чувством тревоги и кардиопульмональным дистрессом.
Основные принципы диагностики ТЭЛА. При подозрении ТЭЛА на основе жалоб больного и оценки факторов риска венозного тромбоза необходимо провести рутинные методы инструментального обследования: ЭКГ, рентгенографию, ЭхоКГ, клинический и биохимический анализы крови.
M.Rodger и P.S. Wells (2001) предложили предварительную балльную оценку вероятности ТЭЛА:
– наличие клинических симптомов тромбоза глубоких вен конечностей – 3 балла;
– при проведении дифференциальной диагностики ТЭЛА наиболее вероятна – 3 балла;
– вынужденный постельный режим на протяжении последних 3–5 дней – 1,5 балла;
– ТЭЛА в анамнезе – 1,5 балла;
– кровохарканье – 1 балл;
– онкопроцесс – 1 балл.
К низкой вероятности наличия ТЭЛА относятся пациенты с суммой < 2–х баллов, к умеренной – от 2 до 6 баллов, к высокой – более 6 баллов.
ЭКГ признаки ТЭЛА (рис. 2А): в 60–70% случаев на ЭКГ регистрируется появление «триады» – SI, QIII, TIII (отрицательный зубец). В правых грудных отведениях ЭКГ при массивной ТЭЛА имеет место снижение сегмента ST, что свидетельствует о систолической перегрузке (высокое давление) правого желудочка, диастолическая перегрузка – дилатация манифестируется блокадой правой ножки пучка Гиса, возможно появление легочного зубца Р.

Рис. 2. ЭКГ (А) и рентгенографические признаки ТЭЛА (Б)
Рентгенографические признаки ТЭЛА, которые были описаны Fleichner , непостоянны и малоспецифичны (рис. 2Б):
I – Высокое и малоподвижное стояние купола диафрагмы в области поражения легкого имеет место в 40% случаев и возникает вследствие уменьшения легочного объема в результате появления ателектазов и воспалительных инфильтратов.
II – Обеднение легочного рисунка (симптом Вестермарка).
III – Дисковидные ателектазы.
IV – Инфильтраты легочной ткани – характерно для инфарктной пневмонии.
V – Расширение тени верхней полой вены вследствие повышения давления наполнения правых отделов сердца.
VI – Выбухание второй дуги по левому контуру сердечной тени.
С учетом клинических симптомов, ЭКГ и рентгенологических признаков американскими исследователями была предложена формула, позволяющая подтвердить или исключить ТЭЛА :
ТЭЛА(Да/Нет) = = (>0,5/<0,35)
где: А – набухание шейных вен – да–1, нет–0;
Б – одышка – да–1, нет–0;
В – тромбоз глубоких вен нижних конечностей – да–1, нет–0;
Г – ЭКГ–признаки перегрузки правых отделов сердца – да–1, нет–0;
Д – рентгенографические признаки – да–1, нет–0.
Лабораторные признаки:
1. Появление лейкоцитоза до 10000 без палочко–ядерного сдвига влево. При пневмонии – лейкоцитоз более выражен (>10000) с палочко–ядерным сдвигом влево, при ИМ – лейкоцитоз <10000 в сочетании с эозинофилией.
2. Определение сывороточных энзимов: глутамин–оксалат трансаминазы (ГОТ), лактатдегидрогеназы (ЛДГ) в сочетании с уровнем билирубина. Увеличение уровней указанных сывороточных энзимов в сочетании с повышением билирубина более типично для ХСН, нормальный уровень ферментов не исключает ТЭЛА.
3. Определение уровня продуктов деградации фибриногена (ПДФ) и, в частности, D–димера фибрина. Увеличение ПДФ (N <10 мкг/мл) и концентрации D–димера более 0,5 мг/л свидетельствуют о спонтанной активации фибринолитической системы крови в ответ на тромбообразование в венозной системе .
Для верификации диагноза ТЭЛА при технической оснащенности медицинского учреждения, где находится пациент, необходимо проведение сцинтиграфии и ангиопульмонографии для оценки объема, локализации и тяжести течения ТЭЛА.
Лечение ТЭЛА. При постановке диагноза ТЭЛА:
1 – необходимо исключить из программы лечения препараты, вызывающие снижение ЦВД за счет венозной вазодилатации (морфин, диуретики, нитроглицерин);
2 – обеспечить адекватный приток крови к правым отделам сердца посредством инфузии растворов с высокой молекулярной массой, способствующих улучшению реологических свойств крови;
3 – проведение тромболитической терапии (не позже 10 суток от начала заболевания) в течение 1–3 дней;
4 – назначение прямых антикоагулянтов (гепарина, низкомолекулярных гепаринов) в течение 7 дней;
5 – за 2–е суток до отмены прямых антикоагулянтов необходимо назначить непрямые антикоагулянты на период не менее 3–х месяцев.
Инфузионная терапия растворами на основе декстранов, благодаря их высокому онкотическому давлению, способствует удержанию жидкой части крови в сосудистом русле. Уменьшение гематокрита и вязкости крови улучшает текучесть крови, способствует эффективному прохождению крови через измененное сосудистое русло малого круга кровообращения, снижает постнагрузку для правых отделов сердца.
Тромболитическая терапия является стандартом лечения при ТЭЛА, показана с целью максимально быстрого восстановления кровотока через окклюзированные легочные артерии, уменьшения давления в легочной артерии и снижения постнагрузки для правого желудочка .
Механизм действия тромболитиков един – активация неактивного комплекса плазминогена в активный комплекс плазмин, являющийся естественным фибринолитиком (рис. 3).

Рис. 3. Механизм действия тромболитиков: I — не обладающих сродством к фибрину; II — обладающих сродством к фибрину
В настоящее время в клинической практике при лечении ТЭЛА используют две группы тромболитических препаратов:
I – не обладающие сродством к фибрину (стрептокиназа, урокиназа, АПСАК – анизоилированный плазминоген–стрептокиназный активаторный комплекс), создающие системный фибринолиз;
II – обладающие сродством к фибрину тромба (ТАП – тканевой активатор плазминогена, альтеплаза, проурокиназа), которые «работают» только на тромбе, за счет наличия Sh радикала, афинного к фибрину.
Противопоказаниями для проведения тромболитической терапии являются:
– возраст > 80 лет;
– мозговые инсульты, перенесенные накануне;
– язвы ЖКТ;
– накануне перенесенные операции;
– обширные травмы.
Тромболитическая терапия при ТЭЛА проводится в течение 24–72 часов.
Режимы введения тромболитиков:
Стрептокиназа – болюсом внутривенно 250000 ЕД на 50 мл 5% глюкозы в течение 30 мин, затем постоянная инфузия из расчета 100000 ЕД/час, или 1500000 в течение 2–х часов;
Урокиназа – 100000 ЕД болюсно в течение 10 мин, затем 4400 ЕД/кг/час в течение 12–24 часов;
ТАП – 15 мг болюсно в течение 5 минут, затем 0,75 мг/кг за 30 мин, далее 0,5 мг/кг за 60 минут. Общая доза 100 мг.
После окончания тромболитической терапии проводится гепаринотерапия в течение 7 дней из расчета 1 000 ЕД в час.
При отсутствии тромболитиков лечение ТЭЛА необходимо начинать с внутривенного введения гепарина в дозе 5000–10000 ЕД болюсно, затем с последующей внутривенной инфузией из расчета 1000–1500 ЕД в час в течение 7 дней. Контроль адекватности гепаринотерапии осуществляется определением активированного парциального тромбопластинового времени (АПТВ – N=28–38 сек), которое должно быть в 1,5–2,5 раза выше нормальных значений.
Необходимо помнить, что при лечении гепарином возможно появление гепарин–индуцированной тромбоцитопении, сопровождающейся рецидивом венозных тромбозов. Поэтому необходимо контролировать уровень тромбоцитов в крови, а при их снижении менее 150000 / мкл необходимо отменить гепарин.
С учетом побочных эффектов гепарина в последние годы при лечении ТЭЛА с успехом используют низкомолекулярные гепарины (НМГ), которые вводят подкожно 1–2 раза в сутки в течение 10 дней: надропарин – 0,1 мл на 10 кг массы тела больного, дальтепарин по 100 МЕ/кг, эноксапарин по 100 МЕ/кг.
За 1–2 суток отмены прямых антикоагулянтов необходимо назначить непрямые антикоагулянты в течение не менее 3–х месяцев под контролем МНО в диапазоне 2,0–3,0. МНО – международное нормализованное отношение = (ПВ больного/ПВ стандартной плазмы)МИН, где ПВ – протромбиновое время, МИЧ – международный индекс чувствительности, соотносящий активность тканевого фактора из животных источников со стандартом тканевого фактора у человека.
Использование МНО рекомендовано ВОЗ для достижения более точного контроля при лечении непрямыми антикоагулянтами и сравнимости результатов лечения.
Хирургическое лечение. При рецидивирующей ТЭЛА рекомендована постановка фильтра в нижнюю полую вену , при массивной (ствол, главные ветви легочной артерии) ТЭЛА – тромбоэмболэктомия .
Альтернативой хирургическому вмешательству в некоторых ситуациях может быть бужирование тромбоэмбола в легочной артерии с помощью катетера Фогерти. После пульмоноангиографии, установления локализации и размера тромбоэмбола, под контролем рентгеноскопии вводится зонд с баллоном на конце и производится механическая фрагментация тромба с регистрацией кривых давления дистальнее и проксимальнее тромба, с последующим введением тромболитиков (рис. 4).

Рис. 4. Кривые давления в правой ветви легочной артерии до и после бужирования
Таким образом, при подозрении на наличие ТЭЛА диагноз устанавливается на основании: комплексной оценки клинических симптомов, данных неинвазивных инструментальных и лабораторных методов исследований, а при их недостаточной информативности диагноз должен быть верифицирован с помощью сцинтиграфии или ангиопульмонографии. Своевременно поставленный диагноз ТЭЛА и начатая адекватная терапия снижают летальность при ТЭЛА от 40% до 5% в среднем (по данным различных медицинских центров). Основными средствами лечения ТЭЛА являются тромболитики, гепарин и низкомолекулярные гепарины, непрямые антикоагулянты. При рецидивирующей ТЭЛА у больных с высоким риском (флотирующий или протяженный венотромбоз) рекомендована имплантация фильтра в нижнюю полую вену. Профилактикой ТЭЛА является назначение низкомолекулярных гепаринов и непрямых антикоагулянтов у пациентов с высоким риском флеботромбоза.
1. Котельников М.В. Тромбоэмболия легочной артерии (современные подходы к диагностике и лечению). – М., 2002.
3. Российский Консенсус «Профилактика послеоперационных венозных тромбоэмболических осложнений». – М., 2000. – 20 с.
4. Савельев В.С., Яблоков Е.Г., Кириенко А.И., Тромбоэмболия легочных артерий. – М.: Медицина, 1979. – 264с.
6. Яковлев В.Б. Тромбоэмболия легочной артерии в многопрофильном клиническом стационаре (распространенность, диагностика, лечение, организация специализированной медицинской помощи): Дисс. д–ра мед. наук. – М., 1995.
8. Beall A.C. Pulmonary embolectomy // Ann. Thorac. Surg. – 1991– Vol. 51.– P.179.
12. Rodger M., Wells P.S. Diagnosis of Pulmonary Embolism // Thromb. Res. – 2001– Vol. 103.– P.225–238.
Внедрение эффективной системы лечения и реабилитации больных тромбозом глубоких вен (ТГВ) является одной из наиболее актуальных проблем современной клинической медицины. Это связано с неуклонным ростом частоты ТГВ, которая достигает 160 случаев на 100 000 населения в год. Столь высокая заболеваемость обусловлена изменением образа жизни современного человека (гиподинамией, характером питания, избыточной массой тела и др.), увеличением травматизма, все более частым возникновением наследственных и приобретенных нарушений системы гемостаза, распространенностью онкологических заболеваний, неконтролируемым приемом гормональных препаратов и др. Венозный тромбоз при неадекватном лечении приводит к тяжелой хронической венозной недостаточности (ХВН) нижних конечностей и инвалидности. Кроме этого, реальную угрозу жизни многих пациентов, находящихся на лечении в стационарах различного профиля, представляет тромбоэмболия легочных артерий (ТЭЛА) – наиболее опасное осложнение ТГВ.
4) внедрение в амбулаторную практику комплекса реабилитационных мероприятий, проведение которых показано всем больным, перенесшим тромбоз.
Подозрение на ТГВ является абсолютным показанием к срочной госпитализации пациента. Если позволяют условия, больной должен быть помещен в специализированный ангиохирургический стационар. В тех случаях, когда это невозможно, лечение ТГВ может быть проведено в хирургическом или в крайнем случае в терапевтическом отделении.
Полиморфизм клинических проявлений ТГВ часто требует проведения дифференциального диагноза с заболеваниями, протекающими со сходной симптоматикой (межмышечные гематомы, миозиты, растяжения мышц, травмы ахилова сухожилия, артрозы, артриты и др.). В связи с этим возникает необходимость привлечения дополнительных, инструментальных методов обследования. Наиболее информативными являются дуплексное УЗ-сканирование сосудов и рентгеноконтрастная флебография. Ультразвуковая допплерография при ТГВ не имеет самостоятельного диагностического значения, поскольку дает большой процент ложноотрицательных заключений при неокклюзивных формах тромбоза.
Прекращение роста и распространения тромба может быть достигнуто благодаря антикоагулянтной терапии, которая подразумевает последовательное применение прямых (гепарин) и непрямых (фенилин, аценокумарол и др.) антикоагулянтов.
При отсутствии противопоказаний обычный (нефракционированный) гепарин назначают в суточной дозе 450 ЕД на 1 кг массы тела пациента. В зависимости от пути введения рассчитывают однократную дозу путем деления суточной дозы на количество инъекций (8 инъекций при внутривенном, дробном введении с интервалом в 3 ч; 3 – при подкожном введении с периодичностью 8 ч). Для достижения максимально быстрого антикоагуляционного эффекта целесообразно первоначальное внутривенное введение 5000 ЕД гепарина струйно, а затем остаток суточной дозы с помощью инфузомата.
Продолжительность гепаринотерапии индивидуальна и в среднем составляет 7 – 10 сут. При этом дозу гепарина следует корригировать с учетом временных показателей свертывания крови (оптимально их удлинение в 1,5 – 2 раза от нормы), которые ежедневно оценивают перед очередным введением препарата.
В настоящее время для антикоагулянтной терапии ТГВ широко используют низкомолекулярные гепарины (НМГ). Их селективное преимущественно анти-Ха действие пролонгирует антитромботический эффект и снижает частоту геморрагических осложнений. В международной практике наибольшее распространение получил эноксапарин. Эноксапарин назначают в дозе 1 мг/кг 2 раза в сутки под кожу живота. Следует подчеркнуть, что при использовании НМГ ежедневный лабораторный контроль за системой гемостаза необязателен, что создает благоприятные предпосылки для амбулаторного лечения эмболонеопасных ТГВ.
За 3 – 4 дня до предполагаемой отмены гепарина необходимо назначить непрямые антикоагулянты. Их эффективая суточная доза контролируется по уровню индекса протромбина, величина которого должна быть стабилизирована в пределах 45 – 60%.
В последние годы для стандартизированного контроля за эффективностью антикоагулянтной терапии стал использоваться международный индекс INR, представляющий собой отношение между протромбиновым временем пациента (PTp) и контрольным протромбиновым временем (PTcontr.). Антикоагуляционный эффект считается достигнутым, если INR составляет более 1,5. Продолжительность приема непрямых антикоагулянтов обычно составляет 3 – 6 мес, поскольку именно в эти сроки чаще всего наблюдаются рецидивы ТГВ. При тромбофилических состояниях терапия непрямыми антикоагулянтами должна быть более длительной.
Наряду с антикоагулянтами в терапии ТГВ целесообразно использовать гемореологически активные препараты (реополиглюкин, производные пентоксифиллина и никотиновой кислоты) и неспецифические противовоспалительные средства (НПВС) парентерально или ректально (в свечах). Необходимость применения НПВС (предпочтительно производных диклофенака и кетопрофена) обусловлена наличием воспалительной реакции со стороны венозной стенки, а также болевым синдромом, затрудняющим активизацию пациента. В последующем на 4–6 нед, следует назначить препараты с преимущественным противовоспалительным действием на венозную стенку (рутозид, троксерутин).
Что касается антибиотиков, то их применение при неосложненном ТГВ является бессмысленным, так же, как и при варикотромбофлебите. Исключение может быть сделано в случае гнойничковых поражений кожи или наличия «входных ворот» для инфекции (открытые переломы, операционные раны и др.), а также для пациентов с высоким риском септических осложнений (сахарный диабет, ВИЧ и др.).
Для профилактики ТЭЛА, помимо антикоагулянтной терапии, которая в определенной мере предотвращает ее, препятствуя прогрессированию тромбоза, при эмболоопасных (флотирующих) тромбах применяют различные хирургические методы: тромбэктомию, имплантацию кава-фильтра или пликацию нижней полой вены механическим швом.
Полностью восстановить проходимость вены в случаях рано диагностированного (давностью 3 – 5 сут) сегментарного ТГВ иногда удается с помощью прямого хирургического вмешательства (тромбэктомии) или тромболитической терапии.
Период активного тромбообразования в среднем продолжается около 3 нед. Он укорачивается при адекватной терапии либо может затягиваться, если лечение проводится неправильно. Итогом ТГВ в подавляющем большинстве случаев являются посттромбофлебитические изменения венозной системы нижних конечностей.
В зависимости от пути эволюции тромба может произойти реканализация просвета вены или его стойкая облитерация. В ряде случаев реканализованные сегменты вены чередуются с окклюзированными.
После ТГВ пациент переходит в качественно иное патологическое состояние, называемое посттромбофлебитической болезнью (ПТФБ). Она характеризуется развитием синдрома хронической венозной недостаточности и быстрым прогрессированием трофических нарушений кожи, что обусловливает необходимость комплексной реабилитационной программы при ТГВ.
В основе профилактики рецидивов ТГВ лежит нивелирование провоцирующих тромбообразование факторов, которые были обобщены Робертом Вирховым еще в середине прошлого столетия: повреждение сосудистой стенки, замедление кровотока и нарушение физико-химических свойств крови.
Повреждение стенки вены может быть следствием разнообразных травм, хирургических вмешательств и эндовазальных процедур. В соответствии с этим планируют и превентивные мероприятия. Флебопротективным действием обладает ряд фармацевтических препаратов (анавенол, рутозид, диосмин, троксерутин и др.). Для ускорения потока крови необходимы периодические сокращения мышц нижних конечностей. То есть пациентам рекомендуют активный двигательный режим с ограничением статического пребывания в вертикальном положении. Рациональная динамическая нагрузка необходима всем пациентам, перенесшим ТГВ.
Во-первых, физические упражнения способствуют компенсации деятельности сердечно-сосудистой системы вообще и венозного оттока из конечностей в частности.
Во-вторых, сокращение мышц обеспечивает рост концентрации важного антитромботического фактора – тканевого плазминогена.
Среди врачей и пациентов часто бытует мнение, что любые физические упражнения после ТГВ противопоказаны. Эта позиция ошибочна. Специальная гимнастика в горизонтальном положении благоприятно сказывается на реабилитации больных. Необходимо исключить лишь те ее виды, где присутствует статический компонент или которые могут провоцировать травмы ног. Кроме этого, все упражнения следует выполнять в условиях эластической компрессии нижних конечностей.
Наращивание нагрузки должно происходить постепенно. Для начала достаточно ежедневной 1,5-часовой прогулки с периодическим отдыхом. Если пораженная конечность не реагирует болевым или судорожным синдромом, продолжительность и кратность прогулок может быть увеличена. Через 2 – 3 мес физические упражнения можно расширить за счет гимнастики, направленной на улучшение венозного оттока из конечности. Это упражнения в положении лежа на спине с приподнятыми ногами («березка», «ножницы», «велосипед» и др.). В дальнейшем могут быть подключены упражнения на велотренажере, бег трусцой, беговые лыжи. Кроме этого, на всех этапах реабилитации целесообразно занятие плаванием, которое является оптимальным видом спорта для больных с патологией венозной системы.
Важным фактором, улучшающим флебогемодинамические показатели, является адекватная, постоянная эластическая компрессия. В частности, достигнутое с ее помощью уменьшение диаметра вены в 2 раза приводит к 5-кратному возрастанию скорости кровотока.
Компрессионное лечение назначают на длительный, а в ряде случаев даже пожизненный срок всем больным, перенесшим ТГВ. При этом могут быть использованы специальные эластические бинты ограниченной степени растяжимости или медицинский компрессионный трикотаж.
Эластические бинты, пригодные для длительного ношения, должны быть сделаны из плотной ткани с содержанием хлопка не менее 50%. Их отличительным признаком является растяжимость только в одном направлении – по длине. Ширина должна оставаться постоянной. Технике наложения компрессионного бандажа должен быть обучен каждый пациент. Бинтование конечности следует проводить в горизонтальном положении (до подъема с постели) от пальцев стопы, с обязательным захватом пятки в виде гамачка, а каждый последующий тур бинта должен накрывать предыдущий на 2/3. Верхняя граница эластического бандажа должна по возможности на 10 – 15 см перекрывать проксимальную границу пораженного венозного сегмента.
Посттромботическое поражение подвздошных и нижней полой вен определяет необходимость использования специальных медицинских колгот II и чулок III компрессионных классов, обеспечивающих создание лечебного давления в диапазоне от 40 – 50 мм рт.ст. и более.
Пациенты часто задают вопрос: нужна ли эластическая компрессия только для пораженной ноги или необходимо бинтовать обе? Распространение тромба на нижнюю полую вену, состояния после имплантации кава-фильтра или кава-пликации, вызывающие флебогипертензию в обеих конечностях, являются абсолютным показанием к двустороннему эластическому бандажу. Кроме этого, на период реабилитации, когда пациент подсознательно щадит пораженную ногу, целесообразна эластическая компрессионная поддержка здоровой ноги.
Перспективно использование систем переменного пневмомассажа конечностей. Создавая под контролем компьютера эффект «бегущей воздушной волны», эти аппараты обеспечивают эффективное опорожнение вен и лимфатических коллекторов. Накладываемый после этой процедуры компрессионный бандаж закрепляет лечебный результат. Курс лечения обычно включает 20 – 30 сеансов.
Физико-химические нарушения системы гемостаза являются следствием различных врожденных (генетический дефицит антитромбина III, протеинов C и S, эритремия и др.) и приобретенных (печеночная недостаточность, гипопротеинемия, гиповолемия и др.) патологических состояний. Тромботическую готовность системы гемостаза и ТГВ провоцируют различные онкологические заболевания.
Перенесенный ТГВ является абсолютным противопоказанием к гормональной контрацепции, а вопрос о гормонотерапии по медицинским показаниям должен быть решен строго индивидуально.
ТГВ независимо от его причины создает гемодинамические предпосылки для рецидива. Его риск многократно возрастает в случае травмы, при хирургическом вмешательстве, тяжелом инфекционном или соматическом заболевании. Во всех этих ситуациях возникают показания к превентивной гепаринотерапии, с предпочтительным использованием НМГ (эноксапарин, фраксипарин и др.).
Отдельного обсуждения заслуживает проблема последствий ТГВ и беременности. Среди врачей и пациентов бытует мнение, что флеботромбоз категорически исключает беременность и роды. Действительно, с медицинской точки зрения в первый год после ТГВ беременность нежелательна. В последующем решение о ней должно приниматься женщиной после консультации с акушером-гинекологом и ангиохирургом. Если ТГВ не был спровоцирован тяжелыми нарушениями системы гемостаза, не сопровождался массивной тромбоэмболией легочной артерии, не повлек выраженных нарушений гемодинамики (например, вследствие окклюзии НПВ), то принципиальных противопоказаний к беременности нет, хотя риск тромбоэмболических осложнений во время нее возрастает.
В связи с этим всю беременность пациентки должны находиться под пристальным наблюдением акушера-гинеколога и флеболога. С первой половины беременности назначают лечебно-охранительный режим и постоянный эластический бандаж (лучше всего специальные эластические колготы II компрессионного класса). По мере увеличения срока беременности, начиная со 2-го триместра, и в зависимости от выраженности венозной недостаточности может быть решен вопрос о медикаментозной терапии. Оптимальными являются поливалентные флеботонизирующие препараты, такие как диосмин и троксерутин, в сочетании с антиагрегантами (трентал, аспирин-кардио и др.). Беременные с высоким риском тромбоэмболических осложнений должны быть госпитализированы в стационар за несколько недель до родов. Вопрос о способе родоразрешения (естественным путем или через кесарево сечение) решается индивидуально во время совместного с сосудистым хирургом консилиума. В ближайшем послеоперационном периоде может оказаться необходимым превентивное назначение антикоагулянтов.
Базисная фармакотерапия острого венозного тромбоза основана на проведении в условиях стационара курса гепаринотерапии с последующим подбором адекватной дозы непрямых антикоагулянтов. После этого больных выписывают под наблюдение хирурга поликлиники. На этапе амбулаторного лечения дозу непрямых антикоагулянтов следует корригировать. Дело в том, что изменения характера питания и бытовых условий могут повлиять на различные компоненты коагуляционного каскада. В связи с этим продолжение терапии непрямыми антикоагулянтами следует проводить при условии хотя бы еженедельного контроля индекса протромбина и общего анализа мочи. Продолжительность приема непрямых антикоагулянтов, как уже упоминалось, не должна быть менее 3 мес.
В настоящее время нет единого мнения о целесообразности комбинации непрямых антикоагулянтов с гемореологически активными препаратами и флебопротекторами в амбулаторных условиях. Находясь на стационарном лечении, больные с ТГВ обычно получают широкий спектр различных медикаментов. Поэтому для профилактики разнообразных желудочно-кишечных и аллергических реакций после выписки целесообразно сделать 2 – 3-месячный перерыв, во время которого пациент принимает лишь непрямые антикоагулянты.
Грубой ошибкой, часто допускаемой врачами поликлиники и пациентами, является ранняя отмена непрямых антикоагулянтов и их повторное назначение короткими курсами от 3–5 дней до 2–3 нед. При этом повышение индекса протромбина до 90 – 100% без каких-либо клинических симптомов рассматривается как проявление тромбоза. Необходимо четко представлять, что высокий уровень протромбина сам по себе не свидетельствует о флеботромбозе, а является лишь маркером белково-синтетической функции печени. В клинических условиях этот показатель может колебаться в широких пределах. Назначение непрямых антикоагулянтов короткими курсами с быстрой их отменой «расшатывает» систему гемостаза и создает предпосылки для «рикошетных» тромбозов.
После завершения приема непрямых антикоагулянтов планируется программа медикаментозного лечения, направленная на улучшение гемореологии, микроциркуляции и лимфатического оттока, а также купирование симптомов венозной недостаточности, снижающих качество жизни. Врач, планирующий лечение, должен четко представлять, что ТГВ приводит к необратимым изменениям венозного русла. Поэтому фармакотерапию подавляющему большинству пациентов необходимо проводить длительное время, в течение нескольких лет, а иногда и пожизненно. Об этом должен быть информирован и пациент.
Медикаментозное лечение должно быть курсовым, со средней продолжительностью 2,5 – 3 мес, предусматривать комбинацию различных по механизму действия лекарственных средств. В зависимости от тяжести заболевания курсы лечения следует проводить не реже 2 – 3 раз в году, при этом для профилактики осложнений со стороны желудочно-кишечного тракта часть препаратов целесообразно вводить парентеральным путем или в виде свечей.
Фармакотерапию чаще всего проводят амбулаторно. Между тем пациентам с тяжелыми формами заболевания, перенесшими массивную тромбоэмболию легочной артерии или тромбоз нижней полой вены, целесообразна ежегодная госпитализация в терапевтическое или кардиологическое отделение сроком на 2 – 3 нед для проведения инфузионной гемореологической и кардиотонической терапии.
Для консервативной терапии пациентам, перенесшим ТГВ, кроме традиционных производных пентоксифиллина, рутозида и экстракта конского каштана, следует широко использовать современные флеботонические препараты. Это диосмин, троксерутин, диовенор, цикло-3 форт, эндотелон. Их комплексное действие допускает назначение в виде монотерапии, что снижает лекарственную нагрузку на организм пациента и связанный с этим риск различных аллергических и гастроэнтерологических расстройств. Например, высокая степень очистки и специальная технология микронизации сделали возможным длительный (до 6 мес и более) безопасный прием детралекса, что благоприятно сказалось на качестве реабилитации пациентов с ТГВ.
Планируя программу консервативного лечения, необходимо помнить о сезонности течения болезни. Подавляющее большинство пациентов отмечают ухудшение в летний период когда жара и связанное с этим нарушение компрессионного режима приводят к декомпенсации венозного оттока. Нивелировать последствия в некоторой мере позволяет курс медикаментозной терапии.
Физиотерапевтическое и санаторно-курортное лечение при реабилитации больных с последствиями ТГВ имеют вспомогательное значение. Из физиотерапевтических процедур наиболее эффективным является воздействие магнитным полем. Для чего используют стационарные установки типа «Полюс» или специальные пластины – магнитофоры, крепящиеся на голени или используемые в виде стелек. Кроме этого, могут быть использованы токи Бернара или д’Арсонваля. Физиотерапевтические процедуры целесообразно проводить между курсами медикаментозного лечения не реже 2 раз в год.
Санаторно-курортное лечение планируют для закрепления результатов фармакотерапии. Для больных, перенесших ТГВ, оптимальны лечебницы с радоновыми (Пятигорск) и сероводородными (Кисловодск, Пятигорск, Сочи, Сергиевские Минеральные Воды) термальными водами.
Лечебные нафталановая и иловая грязи снимают стойкий болевой и отечный синдром у большинства больных с последствиями ТГВ.
К рекомендациям общего характера относится рациональное питание – важный фактор, позволяющий контролировать массу тела, избыток которой усугубляет венозную недостаточность. Пациентам, перенесшим ТГВ и страдающим ожирением, рекомендовано предпринять меры, в том числе и медикаментозные, по похуданию. Из общего рациона питания следует исключить острую, жирную и соленую пищу, ограничить мучные и сладкие продукты. Целесообразно разнообразить меню нежирными сортами рыбы и мяса, большим количеством овощей и фруктов, употреблять преимущественно растительное масло.
Некоторые особенности диеты должны быть учтены при лечении непрямыми антикоагулянтами (фенилин, аценокумарол и др). Из рациона следует исключить продукты, богатые витамином К (капуста, шпинат, щавель, печень, кофе и др.).
Колебания внутрибрюшного давления во время акта дефекации отрицательно действуют на стенку вены. Вот почему важной частью диеты являются продукты, оказывающие послабляющий эффект (растительное масло, свекла, чернослив, инжир, бананы и др.).
Определенные требования должны предъявляться к личной гигиене. Постоянная флебогипертензия приводит к нарушению кровоснабжения кожи и перегрузке лимфатической системы. В этих условиях значительно снижается толерантность кожных покровов к различным повреждающим факторам, в том числе и микробным.
Одежда должна быть достаточно просторной и комфортной. В нижнем белье не следует использовать узкие трусы в виде «плавок», сдавливающие на уровне паховой складки коллатеральные пути венозного оттока. По тем же причинам не рекомендуется ношение плотно облегающих брюк из грубой ткани. Обувь должна быть удобной, на невысоком устойчивом каблуке.
Гигиенический душ необходимо принимать ежедневно. При этом целесообразно в течение 10 – 15 мин обливать каждую ногу тугой струей теплой и прохладной воды попеременно.
Постоянный эластический бандаж, как правило, приводит к повышенной сухости кожи, сопровождается ее шелушением и образованием микротрещин, являющихся «воротами» для инфекции. Для профилактики гиперкератоза следует применять питательные кремы и лосьоны. Кроме этого, необходимо предотвращать образование мозолей. Важной является профилактика и своевременное лечение микотических поражений кожи стоп и ногтей.
Необходимо ограничить использование тех видов эпиляции, которые сопровождаются нагревом конечности (парафиновая), значительным нарушением целостности кожи (механическая) или воздействием повреждающих физических факторов (лазерная, электрическая).
Все пациенты, перенесшие ТГВ, нуждаются в диспансеризации и освидетельствовании на ВТЭК. В идеале они должны быть прикреплены к специализированным флебологическим или ангиологическим центрам. В течение первого года после ТГВ пациент должен посетить врача не менее 3 раз. В последующем при отсутствии жалоб – 1 раз в год. Во время контрольных осмотров врач оценивает течение заболевания, проводит контрольное ультразвуковое обследование, корригирует лечебную программу и дает рекомендации по освидетельствовании на ВТЭК.
ВТЭК занимает важное место в реабилитации пациентов. При ее проведении необходимо учитывать тот факт, что больным, перенесшим ТГВ, противопоказана работа, связанная с тяжелыми физическими нагрузками, длительным пребыванием в статическом положении (стоя или сидя), воздействием неблагоприятных факторов (горячие цеха, различные виды облучения, резкие перепады температуры и др.), высоким риском травмы конечности. То есть, подавляющее большинство пациентов в первые годы после неосложненного ТГВ нуждаются в освидетельствовании ВТЭК по признаку стойкой утраты трудоспособности с присвоением II рабочей или III группы инвалидности. В зависимости от течения заболевания и соблюдения пациентом программы реабилитации трудовая деятельность может быть расширена, а группа инвалидности снята.
В заключение необходимо подчеркнуть, что рациональные лечебная и реабилитационная программы, подобранные индивидуально, в каждом конкретном случае ТГВ, позволяют эффективно воздействовать на тромботический процесс, препятствуют рецидиву заболевания, способствуют восстановлению пациентом социальной и бытовой активности.
Приложения к статье
Внедрение эффективной системы лечения и реабилитации больных тромбозом глубоких вен является одной из наиболее актуальных проблем современной клинической медицины
В основе профилактики рецидивов ТГВ лежит нивелирование провоцирующих тромбообразование факторов. Они были обобщены Робертом Вирховым еще в середине прошлого столетия: повреждение сосудистой стенки, замедление кровотока и нарушение физико-химических свойств крови
Если ТГВ не был спровоцирован тяжелыми нарушениями системы гемостаза, не сопровождался массивной тромбоэмболией легочной артерии, не повлек выраженных нарушений гемодинамики, то принципиальных противопоказаний к беременности нет
Медикаментозное лечение должно быть курсовым, со средней продолжительностью 2,5 – 3 мес, предусматривать комбинацию лекарственных средств
Все пациенты, перенесшие ТГВ, нуждаются в диспансеризации и освидетельствовании на ВТЭК. В идеале они должны быть прикреплены к специализированным флебологическим или ангиологическим центрам