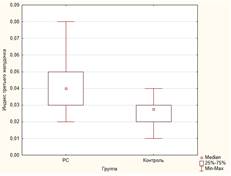
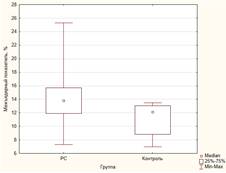
Атрофия мозга
Рассеянный склероз занимает второе место среди причин неврологической инвалидизации молодых людей после травм: около 50% пациентов спустя 15 лет от дебюта заболевания испытывают затруднения при ходьбе, еще 30% пациентов — не могут передвигаться самостоятельно и нуждаются в инвалидном кресле или оказываются прикованными к постели. При высокой активности заболевания указанные сроки появления осложнений могут быть значительно меньше.
В России по разным оценкам в целом от 85 до 120 тыс. пациентов страдают рассеянным склерозом, а во всем мире на 2016 год насчитывается более 2,3 млн пациентов. У каждого из них — индивидуальный характер проявления РС, в зависимости от того, какие участки центральной нервной системы были поражены.
Так как рассеянный склероз имеет хроническое течение и сопровождает пациента всю оставшуюся жизнь, важно отслеживать степень прогрессирования заболевания. Уже на ранних стадиях болезни у пациентов наблюдаются нейродегенеративные изменения (гибель нейронов и потеря аксонов). Аксональное повреждение может наблюдаться и в активных, и в хронических очагах РС у пациентов с длительностью заболевания от 2 недель до 27 лет. В хронических очагах плотность аксонов снижается до 80%. В совокупности эти и другие процессы (такие как демиелинизация, глиоз) приводят к атрофии (уменьшения объема) головного мозга (ГМ). Оценка ее степени считается перспективным способом измерения нейропротективных и восстановительных эффектов терапии РС.
Атрофия головного мозга – один из процессов, развивающихся в том числе с возрастом (наряду с изменениями в белом веществе, микроангиопатией, «немыми» инфарктами мозга, расширением периваскулярных пространств). Но скорость атрофии головного мозга у пациентов с РС выше, чем у здоровых людей. Так, пациенты с ремиттирующим рассеянным склерозом в среднем теряют в год 0,5-1,35% объема ГМ, а здоровые люди – всего 0,1-0,3%.
Атрофия головного мозга отмечается уже на ранних стадиях РС, даже в отсутствии клинических проявлений заболевания. Считается, что скорость атрофии определяет прогрессирование инвалидизации при РС, а также коррелирует с нарушением когнитивных функций. Оценка атрофии отдельных зон головного мозга позволяет определить функциональные нарушения, специфичные для конкретной стадии.
Оценка атрофии ГМ осуществляется с помощью МРТ исследований (единовременных или длительного наблюдения). Остается важный вопрос, какую скорость атрофии ГМ считать обусловленной развитием РС, а не возрастными физиологическими процессами. Было предложено использовать значение 0,4% в год для отличия атрофии, связанной с РС, от нормальной атрофии.
Хачанова Наталья Валерьевна, к.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики ФГБОУ ВО РНИМУ им. Н.И. Пирогова, врач невролог высшей категории межокружного отделения рассеянного склероза ГКБ №24, Москва, отметила: «Оценка скорости атрофии головного мозга может стать одним из ключевых инструментов в оценке состояния пациента и дать дополнительную информацию о конкретных аспектах течения РС, патологических характеристиках и новых средствах терапии заболевания. Кроме того, в настоящее время обсуждается возможность использования данных по скорости атрофии головного мозга для прогнозирования развития заболевания и скорости инвалидизации пациента, а также в качестве объективного фактора для оценки эффективности проводимого лечения».
СИБИРСКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ № 32008 (выпуск 2)
ОБЗОРЫ И ЛЕКЦИИ
УДК 616.12-008.331.1:615.22
Н.В. Белокопытова, В.Ф. Мордовин,
А.Ю. Фальковская, И.Ю. Ефимова,
Т.Е. Суслова, А.Г. Сыркина
E-mail: nvb76@mail.ru
ОСОБЕННОСТИ СТРУКТУРНЫХ ИЗМЕНЕНИЙ ГОЛОВНОГО МОЗГА И ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ ИЗМЕНЕНИЯ ЦЕРЕБРАЛЬНОЙ МИКРОЦИРКУЛЯЦИИ У ПАЦИЕНТОВ С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ И САХАРНЫМ ДИАБЕТОМ 2 ТИПА
ГУ НИИ кардиологии ТНЦ СО РАМН, г Томск
ВВЕДЕНИЕ
В последние годы проблема артериальной гипертонии (АГ) в сочетании с сахарным диабетом (СД)
2 типа находится в центре внимания исследователей всего мира из-за высокого риска развития сердечно-сосудистых осложнений, инвалидизации и смертности . Вместе с тем СД является самостоятельным фактором риска возникновения сосудисто-мозговых нарушений, обусловленных формированием диабетических ангиопатий .
Как известно, поражение головного мозга при сахарном диабете связано, во-первых, с нарушением метаболизма в нервной ткани за счет нарушения обмена фруктозы, в результате которого в нервной ткани накапливается избыточное количество сорбито-ла, разрушающе действующего в первую очередь на нервные проводники (т.н. «полиоловый шунт»), и снижения усвоения глюкозы с развитием энергетического дефицита в поврежденных клетках . Во-вторых, энцефалопатия может возникать за счет поражения сосудов и ухудшения кровоснабжения мозговой ткани. Выделяют особую — ангиопатиче-скую — форму диабетической энцефалопатии, развивающуюся вследствие поражения преимущественно артериол и капилляров головного мозга . В ряде исследований была выявлена ассоциация между сахарным диабетом и глубиной локализации очагов поражения ткани мозга, что указывает на развитие специфических диабетических поражений мелких сосудов головного мозга по типу цереб-
ральной микроангиопатии : отмечается резкое утолщение, расщепление, гомогенизация, появление мелкозернистости базальной мембраны капилляров, сужение просвета микрососудов в результате некроза эндотелиальных клеток и выбухания цитоплазмы эндотелиоцитов.
Наряду с изменениями сосудов головного мозга у больных сахарным диабетом выявлены расстройства цереброваскулярной регуляции, проявляющиеся снижением адекватного ответа мозгового кровотока на соответствующие стимулы , что также может существенно ограничивать компенсаторно-приспособительные возможности церебрального кровообращения и иметь значение для развития синдрома хронической цереброваскулярной недостаточности. В экспериментах было отмечено более выраженное снижение скорости регионарного мозгового кровотока у больных сахарным диабетом как молодого, так и пожилого возраста, по сравнению с показателями у лиц аналогичных возрастных групп без сахарного диабета , также отмечено снижение скорости кровотока в мозге у животных как с острой, так и с хронической гипергликемией .
По данным литературы, с показателями церебральной перфузии во всех регионах головного мозга негативно коррелирует продолжительность заболевания сахарным диабетом (при длительности заболевания более пяти лет). При этом, в большей степени обеднение кровотока имеет место в лобной и теменно-затылочной областях . Нарушение перфузии глубинных отделов мозга способствует снижению резерва ауторегуляции, т.е. вазодилатации в ответ на ишемию, что приводит к развитию мозговых инсультов, которые в 4-7 раз чаще встречаются у больных с СД, даже без гемодинамически значимых стенозов экстракраниаль-ных артерий .
Тем не менее, следует отметить, что особенности формирования гипертензивной энцефалопатии у пациентов с АГ в сочетании с СД 2 типа до настоящего времени остаются недостаточно изученными . В связи с этим целью данной работы стало изучение особенностей формирования цереброваскулярных нарушений и факторов, определяющих изменения церебральной микроциркуляции, у больных артериальной гипертонией, ассоциированной с сахарным диабетом 2 типа.
МАТЕРИАЛ И МЕТОДЫ
В исследование был включен 51 пациент с верифицированным диагнозом эссенциальной АГ 1-
3 степени по классификации ВОЗ (1999), ассоциированной с СД 2 типа в стадии компенсации и субкомпенсации, без гемодинамически значимых стенозов магистральных артерий головы и признаков очаговой неврологической симптоматики: 11 мужчин и 40 женщин в возрасте 51,7±4,6 года. Длительность АГ на момент исследования составляла 9,3±0,9,
СД — 4,5±0,5 года. Критериями исключения были наличие признаков обострения хронической ИБС (ОИМ, нестабильная стенокардия), перенесенные ОНМК и ТИА вне зависимости от срока давности. Коррекцию гипергликемии у 6 пациентов проводили диетическими мероприятиями, у 43 пациентов
— пероральными сахароснижающими средствами (препараты из группы сульфаниламидов второй генерации — у 22 пациентов, препараты из группы би-гуанидов — у 10 пациентов, у 11 больных использовали комбинацию сульфаниламидов и бигуанидов), два пациента (4%) на момент включения в исследование получали инсулинотерапию в комбинации с препаратом из группы сульфаниламидов второй генерации. За 14 дней до включения в исследование всем пациентам отменялась гипотензивная терапия (т.н. период «вымывания»), кроме нифедипина (ко-ринфар) или каптоприла (капотен), которые пациенты принимали по мере необходимости.
Пациентам определяли уровень базальной и пост-прандиальной гликемии, общего холестерина, гли-козилированного гемоглобина, оксида азота, активности фактора Виллебранда (vWF) в плазме крови.
Суточное мониторирование артериального давления (СМ АД) (ABPM-04 («Meditech», Hungary) проводили в течение 24 часов с интервалами 15 мин во время бодрствования и сна. Период ночного сна определялся индивидуально по дневникам монито-рирования. Учитывались данные, включающие в себя не менее 80% эффективных измерений.
Для оценки состояния церебральных структур и выявления очагов ишемического повреждения головного была использована магнитно-резонансная томография (МРТ) головного мозга (магнитно-резонансный томограф «Magnetom-OPEN» («Siemens AG», Германия). Анализ томограмм заключался в определении наличия МРТ-признаков внутричерепной гипертензии, нарушения ликвородинамики и участков цереброваскулярной ишемии. За нормальные размеры структур головного мозга принимались данные группы здоровых лиц по результатам исследования Абрамовой Н.Н. .
С целью определения состояния церебральной микроциркуляции была проведена однофотонная эмиссионная компьютерная томография (ОЭКТ) головного мозга (гамма-камера «Омега 500» («Technicare», США-Германия) с использованием 99т-Тс-гексаметилпропиленаминоксима (ГМПАО), коммерческое название «Церетек» (препарат «Сеrеtеc», производства фирмы «Amersham Ltd», Великобритания). Исследование проводили в покое и после внутривенного введения АТФ. Анализ изображений производился с использованием компьютерной системы «Сцинти» производства НПО «Гелмос» (Россия). За относительно гипопер-фузируемые сектора (ГС) принимали те, в которых накопление индикатора составило менее 95% по сравнению с контрлатеральной стороной.
Транскраниальную допплерографию средних мозговых артерий (СМА) проводили на аппарате HDI 5000 Sono CT (Philips, Германия) с помощью темпорального датчика 2,5-4 мГц по стандартной методике. Определяли линейные скоростные параметры и спектральные характеристики кровотока по СМА.
Статистическую обработку полученных данных осуществляли с помощью пакета прикладных программ «STATISTICA», ver. 6.0 (StatSoft Inc., США). Гипотезу о нормальности распределения выборки проверяли с помощью теста Колмогорова-Смирнова. Для выявления возможных взаимосвязей проводили корреляционный анализ с использованием непараметрического рангового критерия Спирмена и коэффициента парных корреляций Пирсона. Статистическую значимость различий качественных признаков оценивали с помощью критерия согласия X2. Для оценки индивидуального, независимого от других включенных в анализ факторов вклада независимых переменных в вариабельность исследуемой величины был использован метод множественной линейной регрессии. Для определения взаимосвязи между отдельными качественными признаками и отдельными количественными признаками проводили одно- и многофакторный дисперсионный анализ. Критический уровень значимости р при проверке статистических гипотез в данном исследовании принимали равным 0,05.
РЕЗУЛЬТАТЫ
При анализе МРТ-изображений было отмечено, что у большинства пациентов с артериальной гипертензией и сахарным диабетом 2 типа имеют место выраженные структурно-функциональные нарушения головного мозга. Так, нарушения ликворо-динамики (НЛД) были диагностированы у 98% пациентов (n=50). Выраженность этих изменений оценивалась по 3 степеням: 0 — отсутствие НЛД, 1 -расширение боковых желудочков (БЖ) головного мозга или субарахноидальных пространств (САП), 2 — расширение и БЖ, и САП. У 92% пациентов (n=47) были выявлены признаки НЛД 2 степени, при этом расширение обоих БЖ мозга отмечалось у 43 (84%) пациентов. Средние линейные размеры тел боковых желудочков составили 0,87±0,29 см, передних рогов — 0,49±0,20 см, задних рогов —
0,95±0,25 см. САП были расширены преимущественно за счёт фронтальных — 0,25±0,10 см и париетальных — 0,39±0,18 см областей.
Признаками внутричерепной гипертензии (ВЧГ) являлись перивентрикулярный отёк (ПВО), расширение борозд (РБ) коры головного мозга и нарушение дифференциации белого и серого вещества (НДБСВ) головного мозга. У 65% пациентов (n=33) имела место ВЧГ 2 степени (сочетание 2 признаков в любой комбинации): у 31 из них было сочетание ПВО и РБ. Феномен лейкоареоза или
перивентрикулярного отека в области рогов БЖ определялся у 37 (71%) пациентов.
С помощью метода множественной линейной регрессии мы выявили факторы, оказывающие независимое влияние на прогрессирование перивен-трикулярного отека у данной категории пациентов. В регрессионную модель были включены длительность АГ и СД, показатели профиля АД, а также показатели углеводного обмена, уровень оксида азота. Было отмечено, что независимо от длительности заболевания АГ и СД, значимый вклад в увеличение степени перивентрикулярного отека вносят повышенные уровни среднесуточного систолического (более 145,7±1,6 мм рт. ст.) и пульсового (более 60,4±1,3 мм рт. ст.) АД, базальной гликемии (более 7,3±0,4 ммоль/л) и сниженный уровень оксида азота (5,97±0,3 мкмоль/л) (параметры линейной модели: R=0,60, R2=0,37, р=0,018) (табл. 1).
Таблица 1
Показатели СМ АД и метаболические показатели, оказывающие независимое влияние на прогрессирование перивентрикулярного отека
При анализе МРТ-изображений в подавляющем большинстве случаев (п=48; 94%) обнаруживались фокальные повреждения белого вещества головного мозга (ФПБВ). В 33% (п=17) случаев ФПБВ встречались во всех трех регионах головного мозга: субкортикальная область (кора головного мозга, подкорковое белое вещество, мозжечок); область базальных ганглиев (таламус, внутренняя капсула, базальные ганглии); область ствола головного мозга (ножки мозга, мост, продолговатый мозг). Было отмечено, что ФПБВ выявляются уже на ранних стадиях заболевания сахарным диабетом, а именно, через 5 лет с момента верификации диагноза ФПБВ статистически значимо выявлялись как минимум в 2 регионах головного мозга (%2=13,07, р=0,041).
При анализе результатов перфузионной томо-сцинтиграфии головного мозга было отмечено, что из проанализированных 720 зон интереса в 138
(19%) отмечалось снижение аккумуляции радиофармпрепарата (РФП) по сравнению с контрлатеральной стороной. Наиболее часто обеднение кровотока имело место в височной области (34%). Гипоперфузируемые сектора (ГС) чаще обнаруживались в левом полушарии головного мозга (п=105 против п=33 с противоположной стороны, х2=41,55, р<0,001), межполушарная асимметрия составила 31%. В ответ на проведение аденозиновой пробы общее число ГС в целом уменьшалось незначительно (до 136). Отрицательная динамика в виде увеличения количества гипоперфузируемых секторов на 41% наблюдалась в лобной области (с п=32 до п=45, Х2=3,32, р=0,068). Корреляционный анализ показателей СМ АД и данных перфузионной сцинтигра-фии головного мозга в условиях покоя выявил наличие статистически значимых обратных связей между количеством гипоперфузируемых участков, в частности, в височной области мозга, и суточными индексами систолического и диастолического АД ^=-0,454, р=0,025 и R=-0,419, р=0,041 соответственно). В условиях нагрузочного тестирования отмечались единичные связи между количеством ГС в затылочной области мозга и среднедневной вариабельностью диастолического АД ^=0,584; р=0,006). Также было отмечено, что повышение внутрисосудистого сопротивления и снижение скоростных показателей кровотока в СМА способствует ухудшению перфузии головного мозга у данной категории пациентов. На это указывало наличие обратной взаимосвязи между снижением конечной диастолической скорости кровотока в СМА (слева R=-0,536; р= 0,039) и увеличением зон гипоперфузии в затылочной области на ипсилатеральной стороне, а также прямая зависимость между пульсовым индексом и количеством секторов в теменной области ^=0,549; р=0,041).
При анализе результатов перфузии головного мозга и данных МРТ головного мозга была обнаружена тесная связь между количеством гипопер-фузируемых секторов и признаками НЛД, в частности, ухудшение перфузии в теменных долях головного мозга сопровождалось увеличением субарах-ноидальных пространств в париетальных областях ^=0,512; р=0,021). Была также установлена обратная связь между состоянием церебрального ге-модинамического резерва головного мозга и состоянием эндотелия сосудов, в частности, между количеством гипоперфузируемых секторов в лобной доле при пробе с АТФ и процентом прироста диаметра плечевой артерии при пробе с реактивной гиперемией (г=-0,448; р=0,047). Кроме того, проведенный многофакторный анализ показал, что повышение уровня vWF в плазме крови (от 145,5±10,5%) также сопровождается увеличением количества зон гипоперфузии, в частности, в затылочной области ^2=0,623, а£(7,12), F=2,918, р=0,049).
Показатели Коэффициенты парциальной корреляции Р
Длительность АГ 0,337 0,136
Длительность СД 0,179 0,526
Средне-суточное САД 0,478 0,013
Средне -суточно е пульсовое АД 0,451 0,014
Средне-ночное САД 0,780 0,003
Базальная гликемия 0,363 0,034
Уровень оксида азота -0,523 0,006
ОБСУЖДЕНИЕ
Исходя из вышеизложенного можно отметить, что признаки церебральных нарушений у пациентов с артериальной гипертонией, ассоциированной с сахарным диабетом 2 типа встречаются уже на ранних стадиях заболевания. В подавляющем большинстве случаев (94%) выявляются фокальные повреждения белого вещества (ФПБВ) головного мозга, что, согласно данным проводимых ранее исследований , превышает частоту их выявления у пациентов с АГ без нарушений углеводного обмена. В настоящее время ФПБВ, наряду с лакунарными инфарктами мозга, рассматриваются в качестве предикторов мозговых катастроф, поскольку рядом крупных проспективных исследований была установлена ассоциация ФПБВ с повышенным риском ишемического инсульта и сосудистой деменции . Таким образом, ранее выявление и распространенность такого рода повреждений белого вещества мозга у пациентов с АГ и СД свидетельствуют о высокой вероятности развития у них острых мозговых сосудистых катастроф.
В исследуемой нами группе пациентов по данным перфузионной ОЭКТ головного мозга участки нарушения перфузии выявлялись во всех регионах, и, в первую очередь, в височной области, что согласуется с данными ряда авторов и обусловлено поражением корково-медуллярных артерий, кровоснабжающих эти сегменты и наиболее подверженных изменениям . Отмеченное в работе увеличение числа гипоперфузируемых зон или отсутствие спазмолитической реакции в ответ на аденозиновую пробу свидетельствовали о той или иной степени истощения цереброваскулярного резерва, обусловленного сосудистым ремоделированием. Также обращало внимание, что чаще гипоперфузируемые сектора обнаруживались в левом полушарии головного мозга (р<0,001), а межполушарная асимметрия составила 31%. С нашей точки зрения это объясняется следующим образом: у здоровых людей наблюдается асимметрия кровоснабжения полушарий головного мозга в зависимости от функционального преобладания правой или левой половины тела. Ранее выявлено перераспределение межполушарного кровоснабжения при выполнении разных видов деятельности . Не исключено, что у пациентов данной группы, вследствие нарушения механизмов регуляции церебральной гемодинамики, такая функциональная асимметрия приобретает патологический характер и может служить дополнительным фактором, объясняющим раннее развитие структурных изменений головного мозга.
Отмечено, что степень снижения перфузии головного мозга в большей степени зависит от степени нарушения суточного ритма АД, на это указывало наличие статистически значимых обратных связей между количеством гипоперфузируемых участков и величиной суточного индекса систолического и 108
диастолического АД. По данным литературы, к числу факторов, определяющих изменение перфузии головного мозга, относится и эндотелиальная дисфункция церебральных сосудов , что в нашей работе было подтверждено результатами многофакторного анализа, показавшего, что повышение уровня vWF в плазме крови сопровождается увеличением количества зон гипоперфузии , в частности, в затылочной области. Повышение внутрисо-судистого сопротивления и снижение скоростных показателей в магистральных артериях головы, обусловленное прежде всего структурным ремоделированием церебрального сосудистого русла под влиянием АГ и метаболических изменений, также способствует ухудшению перфузии головного мозга у данной категории пациентов .
Таким образом, результаты исследования показали, что между морфофункциональными признаками гипертензивной энцефалопатии по данным МР-томографии, нарушениями микроциркуляции в мозговой ткани по данным перфузионной сцинтиграфии мозга, нарушением суточного профиля АД, показателями сосудистой реактивности, маркерами эндотелиальной дисфункции, метаболическими нарушениями существует тесная корреляционная связь.
ВЫВОДЫ
1. У больных артериальной гипертензией, ассоциированной с сахарным диабетом 2 типа, частота выявления структурных признаков цереброваскулярных поражений достигает 98%. Участки нарушения перфузии мозга среди обследованных пациентов выявляются в 100% случаев и имеют распространенный характер.
2. Факторами, влияющими на степень выраженности цереброваскулярных поражений и нарушения перфузии, являются показатели мониторирования артериального давления, особенно уровень среднесуточного систолического артериального давления, признаки эндотелиальной дисфункции в виде повышения содержания фактора Виллебранда в плазме крови и состояние углеводного обмена.
3. Определение содержания в крови фактора Виллебранда, оксида азота и показателей суточного профиля артериального давления позволяет оценивать степень выраженности цереброваскулярных нарушений у больных с артериальной гипертонией и сахарным диабетом 2 типа. ©
ЛИТЕРАТУРА
2. Оганов Р.Г. Проблема контроля артериальной гипертонии среди населения // Кардиология. — 1994. — № 4.
— С. 80-83.
4. Мычка В.Б., Чазова И.Е. Сердечно-сосудистые осложнения сахарного диабета типа 2 // Consilium Medicum.-2003. — № 9, Том 5.
6. Bell D.S. Stroke in the diabetic patients // Diabetes Care.
— 1994. — Vol. 17. — P. 213-219.
7. Kern T.S., Engerman R.L. Microvascular metabolism in diabetes // Metabolism. — 1986. — Vol. 35 (4 Suppl 1). -P. 24-27.
9. Прихожан В.М. Классификация диабетической невропатии // Проблемы эндокринологии. — 1987. — № 3.
— С. 79-85.
— 2003. — № 2. Том 5.
15. Duckrow R.B. Effect of hemodilution on regional cerebral blood flow during chronic hyperglycemia in rats // Stroke.
— 1990. — Vol. 21. — Р 1072-1076.
17. Гончарук В.Д., Баюс РМ. Функционально-морфологический статус супрахиазмального ядра гипоталамуса при первичной гипертензии: отношение к нарушениям суточных ритмов гемодинамики // Кардиология. — 2000.
— № 4. — С. 36-39.
— С. 3-8.
19. Абрамова Н.Н. Клиническое применение магнитнорезонансной ангиографии в диагностике поражений экстра- и интракраниальных артерий у больных с артериальными гипертониями: Автореф. дисс. к.м.н., Москва, 1994.
20. Семке Г. В. Артериальная гипертония и поражение органов-мишеней. Автореф.дисс. д. м.н., Томск, 2002.
21. Чазова Е.И. Лечение артериальной гипертонии как профилактика инсульта//Инсульт. — 2001. — № 3. — С. 3-7.
22. Шмырев В.И., Мартынов А.И., Гулевская Т.С. и др. Поражение белого вещества головного мозга (лейкоа-
реоз): частота, факторы риска, патогенез, клиническая значимость // Неврологический журнал. — 2000. — № 3.
— С. 21-24.
— 2003. — Vol. 34. — P 1126-1129.
24. Keating G.M., Jarvis B. Carvedilol: a review of its use in chronic heart failure // Drugs. — 2003. — Vol. 63 (16). -P. 1697-1741.
27. Брагина Н.Н., Доброхотова Т.А. Функциональные асимметрии человека. — М.: Медицина, 1988. — 180 с.
28. Rubany G.M. The role of endothelium in cardiovascular homeostasis and diseases // J. Cardiovas. Pharmacol. — 1993.
— Vol. 22 . — P. 81-814.
29. Ruggery Z.M., Ware J. Von Willebrand factor // FASEB J. — 1993. — Vol. 52, № 9120. — Р 1005-1011.
— С. 32-36.
N.V. Belokopytova, V.F. Mordovin,
A.Yu. Fal’kovskya, I.Yu. Efimova, T.Ye. Souslova, A.G. Syrkina
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Жукова А.Р. 1 Логинова С.В. 1 Сумцова Н.В. 1 Рождественский А.С. 1 Игнатьев Ю.Т. 1 Смяловский В.Э. 1 Делов Р.А. 1 Маркс Е.А. 1 1 ФГБОУ ВО Омский государственный медицинский университет Новые сведения о нейродегенеративном компоненте первично демиелинизирующего заболевания способствовали поиску новых клинико-радиологических взаимосвязей. Церебральная атрофия в настоящее время считается суррогатным маркером прогрессирования рассеянного склероза (РС) и отражает деструктивный необратимый процесс. Оценка общей атрофии головного мозга является одним из наиболее перспективных направлений для клинических исследований нейропротективных и репаративных стратегий при рассеянном склерозе, мишенью которых служит нейродегенеративный компонент заболевания. Обследованы 135 больных РС и 55 здоровых добровольцев. Неврологический дефицит оценивался по шкале Курцке. Выполнена магнитно-резонансная томография головного мозга, определены показатели общей церебральной атрофии. Показаны значимые различия параметров общей атрофии головного мозга между группой больных РС и контрольной группой. Показатели атрофического процесса у больных РС были связаны с мозжечковыми нарушениями, нарушениями высших мозговых функций и степенью инвалидизации по шкале EDSS прямой корреляционной связью. Наиболее выраженные взаимосвязи с неврологическим дефицитом у больных РС демонстрируют ширина третьего желудочка и межъядерный показатель. Последние являются простыми линейными способами оценки атрофического процесса головного мозга, не требующими специального программного обеспечения, и могут быть использованы в клинической практике.  336 KB рассеянный склероз магнитно-резонансная томография головной мозг атрофия 1. Fu L., Matthews P.M., De Stefano N., Worsley K.J., Narayanan S., Francis G.S., Antel J.P., Wolfson C., Arnold D.L. Imaging axonal damage of normal-appearing white matter in multiple sclerosis. Brain. 1998. Vol. 121. Pt 1. P.103-113. 2. Fugger L., Friese M.A., Bell J.I. From genes to function: the next challenge to understanding multiple sclerosis. Nat. Rev. Immunol. 2009. vol. 9. no 6. P. 408-417. DOI: 10.1038/nri2554. 3. Friese M.A., Schattling B., Fugger L. Mechanisms of neurodegeneration and axonal dysfunction in multiple sclerosis. Nat. Rev. Neurol. 2014. vol. 10. no. 4. P. 225-238. DOI: 10.1038/nrneurol.2014.37. 4. Кротенкова И.А., Брюхов В.В., Переседова А.В., Кротенкова М.В. Атрофия центральной нервной системы при рассеянном склерозе: данные МРТ-морфометрии // Журнал неврологии и психиатрии им.С.С. Корсакова. 2014. №10. вып.2. С. 50-56. 5. Eshaghi A., Prados F., Brownlee W.J., Altmann D.R., Tur C., Cardoso M.J., De Angelis F., van de Pavert S.H., Cawley N.,. De Stefano N, Stromillo M.L., Battaglini M., Ruggieri S., Gasperini C., Filippi M., Rocca M.A., Rovira A., Sastre-Garriga J., Vrenken H., Leurs C.E., Killestein J., Pirpamer L., Enzinger C., Ourselin S., Wheeler-Kingshott C.A.M.G., Chard D., Thompson A.J., Alexander D.C., Barkhof F., Ciccarelli O., MAGNIMS study group. Deep gray matter volume loss drives disability worsening in multiple sclerosis. Ann. Neurol. 2018. vol. 83. no. 2. P. 210-222. DOI: https://doi.org/10.1002/ana.25145. 6. Столяров И.Д., Петров А.М., Вотинцева М.В. Атрофия головного мозга и эффективность препаратов патогенетической терапии при рассеянном склерозе // Нервные болезни. 2017. №4. с. 10-15. 7. Гусев Е.И., Бойко А.Н., Столяров И.Д. Рассеянный склероз. Справочник терминов. М.: Здоровье человека. 2015. 448 c. 8. Barkhof F., Calabresi P. A., Miller D. H. Imaging outcomes for neuroprotection and repair in multiple sclerosis trials. Nat. Rev. Neurol. 2009. vol. 5. no. 5. P. 256-266. DOI: 10.1038/nrneurol.2009.41. 9. Lutz T., Bellenberg B., Schneider R., Weiler F., Koster O., Lukas C. Central Atrophy Early in Multiple Sclerosis: Third Ventricle Volumetry versus Planimetry. J. Neuroimaging. 2017. vol. 27. no. 3. P. 348-354. DOI: 10.1111/jon.12410. 10. Artemiadis A., Anagnostouli M., Zalonis I., Chairopoulos K., Triantafyllou N. Structural MRI correlates of cognitive function in multiple sclerosis. Mult. Scler. Relat. Disord. 2018. vol. 21. P. 1-8. DOI: 10.1016/j.msard.2018.02.003. 11. Bermel R.A., Bakshi R., Tjoa C., Puli S.R., Jacobs L. Bicaudate ratio as a magnetic resonance imaging marker of brain atrophy in multiple sclerosis. Arch. Neurol. 2002. vol. 59. no. 2. P. 275-280. DOI: 10.1001/archneur.59.2.275. 12. Aylward E.H., Schwartz J., Machlin S. Bicaudate ratio as a measure of caudate volume on MR images. Am. J. Neuroradiol. 1991. vol.12. no. 6. P. 1217-1222. 13. Алифирова В.М., Мусина Н.Ф. Когнитивные нарушения у больных рассеянным склерозом: сопряженность нейропсихологических, нейрофизиологических и нейровизуализационных показателей // Журнал неврологии и психиатрии им. С.С. Корсакова. 2013. Т.113. №2. вып. 2. с. 57-60. 14. Jasperse B., Valsasina P., Neacsu V., Knol D. L., De Stefano N., Enzinger C., Smith S. M., Ropele S., Korteweg T., Giorgio A., Anderson V., Polman C. H., Filippi M., Miller D. H., Rovaris M., Barkhof F., Vrenken H., Magnetic Imaging in Multiple Sclerosis (MAGNIMS) study groupIntercenter agreement of brain atrophy measurement in multiple sclerosis patients using manually-edited SIENA and SIENAX. J. Magn. Reson. Imaging. 2007. vol. 26. no. 4. P. 881–885. DOI: 10.1002/jmri.21101.
336 KB рассеянный склероз магнитно-резонансная томография головной мозг атрофия 1. Fu L., Matthews P.M., De Stefano N., Worsley K.J., Narayanan S., Francis G.S., Antel J.P., Wolfson C., Arnold D.L. Imaging axonal damage of normal-appearing white matter in multiple sclerosis. Brain. 1998. Vol. 121. Pt 1. P.103-113. 2. Fugger L., Friese M.A., Bell J.I. From genes to function: the next challenge to understanding multiple sclerosis. Nat. Rev. Immunol. 2009. vol. 9. no 6. P. 408-417. DOI: 10.1038/nri2554. 3. Friese M.A., Schattling B., Fugger L. Mechanisms of neurodegeneration and axonal dysfunction in multiple sclerosis. Nat. Rev. Neurol. 2014. vol. 10. no. 4. P. 225-238. DOI: 10.1038/nrneurol.2014.37. 4. Кротенкова И.А., Брюхов В.В., Переседова А.В., Кротенкова М.В. Атрофия центральной нервной системы при рассеянном склерозе: данные МРТ-морфометрии // Журнал неврологии и психиатрии им.С.С. Корсакова. 2014. №10. вып.2. С. 50-56. 5. Eshaghi A., Prados F., Brownlee W.J., Altmann D.R., Tur C., Cardoso M.J., De Angelis F., van de Pavert S.H., Cawley N.,. De Stefano N, Stromillo M.L., Battaglini M., Ruggieri S., Gasperini C., Filippi M., Rocca M.A., Rovira A., Sastre-Garriga J., Vrenken H., Leurs C.E., Killestein J., Pirpamer L., Enzinger C., Ourselin S., Wheeler-Kingshott C.A.M.G., Chard D., Thompson A.J., Alexander D.C., Barkhof F., Ciccarelli O., MAGNIMS study group. Deep gray matter volume loss drives disability worsening in multiple sclerosis. Ann. Neurol. 2018. vol. 83. no. 2. P. 210-222. DOI: https://doi.org/10.1002/ana.25145. 6. Столяров И.Д., Петров А.М., Вотинцева М.В. Атрофия головного мозга и эффективность препаратов патогенетической терапии при рассеянном склерозе // Нервные болезни. 2017. №4. с. 10-15. 7. Гусев Е.И., Бойко А.Н., Столяров И.Д. Рассеянный склероз. Справочник терминов. М.: Здоровье человека. 2015. 448 c. 8. Barkhof F., Calabresi P. A., Miller D. H. Imaging outcomes for neuroprotection and repair in multiple sclerosis trials. Nat. Rev. Neurol. 2009. vol. 5. no. 5. P. 256-266. DOI: 10.1038/nrneurol.2009.41. 9. Lutz T., Bellenberg B., Schneider R., Weiler F., Koster O., Lukas C. Central Atrophy Early in Multiple Sclerosis: Third Ventricle Volumetry versus Planimetry. J. Neuroimaging. 2017. vol. 27. no. 3. P. 348-354. DOI: 10.1111/jon.12410. 10. Artemiadis A., Anagnostouli M., Zalonis I., Chairopoulos K., Triantafyllou N. Structural MRI correlates of cognitive function in multiple sclerosis. Mult. Scler. Relat. Disord. 2018. vol. 21. P. 1-8. DOI: 10.1016/j.msard.2018.02.003. 11. Bermel R.A., Bakshi R., Tjoa C., Puli S.R., Jacobs L. Bicaudate ratio as a magnetic resonance imaging marker of brain atrophy in multiple sclerosis. Arch. Neurol. 2002. vol. 59. no. 2. P. 275-280. DOI: 10.1001/archneur.59.2.275. 12. Aylward E.H., Schwartz J., Machlin S. Bicaudate ratio as a measure of caudate volume on MR images. Am. J. Neuroradiol. 1991. vol.12. no. 6. P. 1217-1222. 13. Алифирова В.М., Мусина Н.Ф. Когнитивные нарушения у больных рассеянным склерозом: сопряженность нейропсихологических, нейрофизиологических и нейровизуализационных показателей // Журнал неврологии и психиатрии им. С.С. Корсакова. 2013. Т.113. №2. вып. 2. с. 57-60. 14. Jasperse B., Valsasina P., Neacsu V., Knol D. L., De Stefano N., Enzinger C., Smith S. M., Ropele S., Korteweg T., Giorgio A., Anderson V., Polman C. H., Filippi M., Miller D. H., Rovaris M., Barkhof F., Vrenken H., Magnetic Imaging in Multiple Sclerosis (MAGNIMS) study groupIntercenter agreement of brain atrophy measurement in multiple sclerosis patients using manually-edited SIENA and SIENAX. J. Magn. Reson. Imaging. 2007. vol. 26. no. 4. P. 881–885. DOI: 10.1002/jmri.21101.
Рассеянный склероз – хроническое аутоиммунное заболевание центральной нервной системы (ЦНС), характеризующееся недостаточно изученным этиопатогенезом, вариабельностью неврологической картины и малопредсказуемым прогнозом. Весомый вклад в понимание природы РС внес метод магнитно-резонансной томографии (МРТ), позволяющий проследить in vivo динамику повреждения головного и спинного мозга. Стало ясно, что очаги в белом веществе – это только часть всего спектра нейровизуализационных проявлений РС. Данные МР-спектроскопии подтвердили более ранние наблюдения о том, что не только миелиновая оболочка, но и аксоны и нейроны поражаются при РС . Новые сведения о нейродегенеративном компоненте первично демиелинизирующего заболевания способствовали поиску новых клинико-радиологических взаимосвязей. Было показано, что развитие необратимой инвалидизации связано с дегенеративным процессом . Eshanghi A. и соавт. в своем исследовании пришли к выводу, что уменьшение объема глубокого (а не коркового) серого вещества связано с нарастанием степени инвалидизации, оцениваемой по шкале EDSS . В настоящее время церебральная атрофия считается суррогатным маркером прогрессирования РС и отражает деструктивный необратимый процесс. Основу атрофии мозга при РС предположительно составляют как потеря миелина, олигодендроцитов, так и дегенерация аксонов и нейронов .
Различают общую (увеличение желудочков мозга и субарахноидальных пространств) и регионарную (уменьшение отдельных структур мозга) церебральную атрофию. Для оценки атрофического процесса используют планиметрические (линейные измерения) и волюметрические (измерение объемов) подходы. В повседневной клинической практике дифференцированно оценить поражение серого и белого вещества затруднительно в силу материальных, временных и технических причин. По мнению F. Barkhof и соавт., оценка общей атрофии головного мозга является одним из наиболее перспективных направлений для клинических исследований нейропротективных и репаративных стратегий при рассеянном склерозе, мишенью которых является нейродегенеративный компонент заболевания . Таким образом, необходимость оценки атрофии ЦНС продиктована ее прогностической значимостью. Однако оценке церебральной атрофии в рутинной клинической практике отводится недостаточное внимание.
Цель исследования – изучить взаимосвязь атрофического процесса головного мозга и степени инвалидизации пациентов с рассеянным склерозом.
Материал и методы
В исследование были включены 135 пациентов с установленным диагнозом РС согласно критериям MAGNIMS 2016 и 55 здоровых добровольцев. Оценка клинического статуса у больных рассеянным склерозом проводилась по общепринятой методике с использованием шкалы неврологического дефицита Курцке для оценки нарушений основных неврологических функций. Степень инвалидизации определена по шкале EDSS (expanded disability status scalе). Пациенты, страдающие заболеваниями, сопровождающимися многоочаговым поражением ЦНС, исключались из исследования.
Магнитно-резонансная томография была выполнена на томографе EXСELART Vantage Atlas-X, Toshiba, с напряженностью магнитного поля 1,5 Тл с толщиной среза 5 мм. Для анализа томограмм использовались данные в DICOM 3.0 формате. Оценка изображений проводилась с использованием возможностей графической станции «e-Film Workstation 4.1», Merge. При обнаружении гадолинийнакапливающих очагов демиелинизации пациент исключался из дальнейшего исследования. Для оценки атрофического процесса головного мозга определялись следующие показатели на аксиальных МР-томограммах в режиме Т1-взвешенных изображений:
– ширина третьего желудочка (ШТЖ) в его середине;
– индекс третьего желудочка (ИТЖ) – отношение ШТЖ к расстоянию между наиболее удаленными внутренними поверхностями костей черепа;
– ширина передних рогов боковых желудочков (ШПР) на уровне хвостатых ядер;
– ширина боковых желудочков на уровне тел (ШТБЖ);
– индекс боковых желудочков (ИБЖ) – отношение расстояния между наружными стенками боковых желудочков к расстоянию между наиболее удаленными внутренними поверхностями костей черепа;
– межъядерный показатель (МП) – отношение наименьшего расстояния между медиальными границами хвостатых ядер к расстоянию между границами мозга вдоль той же линии.
Статистический анализ полученных данных выполнен с помощью пакета прикладных программ Statistica 6.0 («Statsoft») и возможностей Microsoft Office Excel. Характер распределения количественных признаков определялся с помощью критерия Шапиро–Уилка. Полученные данные представлены в виде медианы (Me) и верхнего и нижнего квартилей (Р25; Р75). Для сравнения двух независимых групп применялся непараметрический U-критерий Манна–Уитни. С целью выявления связи между исследуемыми признаками был применен корреляционный анализ с помощью непараметрического критерия Спирмена. Влияние одного фактора на другой оценивалось методом корреляционно-регрессионного анализа. Результаты считались статистически значимыми при р < 0,05.
Результаты и обсуждение
По возрасту и половому составу группа контроля и группа больных РС были сопоставимы. Сравнительная характеристика пациентов с РС и здоровых добровольцев из группы контроля по изучаемым параметрам МР-картины головного мозга отражена в таблице 1.
Таблица 1
Характеристика атрофического процесса головного мозга в группе пациентов с РС и контрольной группе, Ме (Р25; Р75).
*– значения р, достигшие статистической значимости различий.
Примечание. ШТЖ – ширина третьего желудочка, ИТЖ – индекс третьего желудочка, ШПР – ширина передних рогов боковых желудочков, ШТБЖ – ширина боковых желудочков на уровне тел, ИБЖ – индекс боковых желудочков, МП – межъядерный показатель.
Как видно из таблицы 1, у пациентов с РС значения измеряемых показателей атрофии были значимо выше, чем в группе здоровых добровольцев (рис. 1). Различия в значениях индекса боковых желудочков не достигли статистической значимости, однако медианы и интерквартильный размах демонстрируют тенденцию к различию.
|
А) |
Б) |
|
В) |
|
Рис. 1. Некоторые показатели атрофического процесса головного мозга в группе больных РС и контрольной группе: А) ширина третьего желудочка; Б) индекс третьего желудочка; В) межъядерный показатель
С помощью метода ранговой корреляции Спирмена были проанализированы взаимосвязи между измеряемыми показателями общей атрофии головного мозга у больных РС и степенью неврологического дефицита, оцениваемой по шкале Курцке (табл. 2).
Таблица 2
Анализ взаимосвязей показателей атрофии и неврологического дефицита
по шкале Курцке, коэффициент Спирмена R/ p-value
*– значения р, достигшие статистической значимости различий, полужирным выделены умеренной силы корреляционные связи.
Примечание. ФС1 – зрительные функции, ФС2 – стволовые функции, ФС3 – пирамидные функции, ФС4 – мозжечковые функции, ФС5 – чувствительная сфера, ФС6 – функции тазовых органов, ФС7 – высшие мозговые функции, EDSS – expanded disability status scalе.
Как видно из таблицы 2, между показателями атрофического процесса головного мозга и оценкой неврологического дефицита по ФС1 (зрительные функции) и ФС2 (стволовые функции) корреляционных связей не выявлено. Для остальных функциональных систем и оценки EDSS многие корреляционные связи с показателями атрофии достигли уровня статистической значимости. Наиболее убедительные связи с клиническими симптомами установлены для ШТЖ, ИТЖ и МП. Нарушения высших мозговых функций (ФС7), мозжечковые нарушения (ФС4) и степень инвалидизации показали умеренной силы прямые корреляционные связи с атрофическим процессом головного мозга. ИТЖ продемонстрировал несколько более слабые взаимосвязи с неврологическим дефицитом, чем абсолютное значение ШТЖ. Межъядерный показатель выявил наибольшее количество корреляционных связей с параметрами неврологического дефицита. Следует отметить, что все выявленные умеренной силы корреляционные связи имели достаточно высокий уровень статистической значимости – р=0,002 и менее. В целом наиболее выраженную взаимосвязь с неврологическим дефицитом демонстрируют МП и ШТЖ.
Планиметрические измерения ШТЖ по МРТ показывают сильнейшую связь с объемом третьего желудочка (R=0,74, p<0,01), но при этом ШТЖ измерить проще и быстрее, чем объем . Поэтому ШТЖ рекомендуется исследователями как наиболее эффективный и надежный биомаркер при количественной оценке атрофии головного мозга у больных РС . Межъядерный показатель (МП) используется для оценки степени субкортикальной атрофии головного мозга у пациентов с РС . Вычисление МП не требует специального программного обеспечения, легко воспроизводимо при адекватной МР-визуализации хвостатых ядер и передних рогов боковых желудочков. При рассеянном склерозе величина МП выше у пациентов с быстро прогрессирующим течением, что свидетельствует о более выраженной степени атрофии головного мозга в сравнении с мягким вариантом течения .
Обнаружены прямые корреляционные связи нарушений высших мозговых функций (ФС7) практически со всеми показателями атрофии, за исключением ШТБЖ и ИБЖ (табл. 2). Ряд зарубежных и отечественных исследований выявил связь когнитивных нарушений при РС с общей атрофией головного мозга, что, возможно, является отражением нейродегенеративного компонента заболевания . Когнитивные тесты в рамках настоящего исследования не проводились, но выявленные взаимосвязи могут стать ориентиром дальнейшего научного поиска.
Выявлены корреляционные связи степени инвалидизации больных РС по шкале EDSS практически со всеми параметрами атрофического процесса, но только для ШТЖ и МП эти взаимосвязи достигли умеренной силы (табл. 2). Чем тяжелее была степень инвалидизации пациентов, тем более выражены были признаки общей атрофии головного мозга (рис. 2).
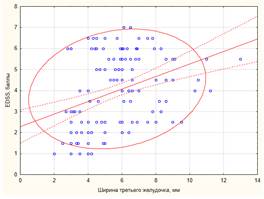
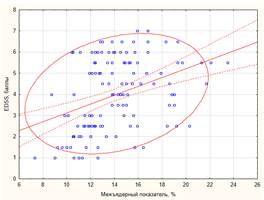
А) Б)
p < 0,01; r2 = 0,10) и величины межъядерного показателя (Б, y = 1,29 + 0,2*x; r = 0,34;
p < 0,01; r2 =0,12) Примечание. EDSS – expanded disability status scalе
Ряд исследований показал, что у пациентов со стойким прогрессированием нетрудоспособности по шкале EDSS скорость атрофического процесса в ЦНС значительно выше, чем у пациентов со стабильным течением РС . Нейровизуализационные данные, описывающие атрофический процесс головного мозга (атрофический нейродегенеративный компонент заболевания), необходимы для выявления особенностей течения рассеянного склероза и должны учитываться при оценке эффекта проводимого лечения.
Таким образом, в проведенном исследовании показаны более выраженные признаки общей церебральной атрофии у больных РС по сравнению с группой контроля. Показатели церебральной атрофии коррелируют с мозжечковыми нарушениями, нарушениями высших мозговых функций и степенью инвалидизации пациентов. Наиболее выраженные взаимосвязи с неврологическим дефицитом в нашем исследовании демонстрируют ШТЖ и МП. Последние являются простыми линейными способами оценки атрофического процесса головного мозга, не требующими специального программного обеспечения, и могут быть использованы в клинической практике.
Жукова А.Р., Логинова С.В., Сумцова Н.В., Рождественский А.С., Игнатьев Ю.Т., Смяловский В.Э., Делов Р.А., Маркс Е.А. ВЗАИМОСВЯЗЬ КЛИНИЧЕСКОЙ КАРТИНЫ И АТРОФИЧЕСКИХ ИЗМЕНЕНИЙ ГОЛОВНОГО МОЗГА У БОЛЬНЫХ РАССЕЯННЫМ СКЛЕРОЗОМ // Современные проблемы науки и образования. – 2018. – № 5.;
URL: http://www.science-education.ru/ru/article/view?id=28090 (дата обращения: 29.10.2020).

 Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания» (Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления) «Современные проблемы науки и образования» список ВАК ИФ РИНЦ = 0.791 «Фундаментальные исследования» список ВАК ИФ РИНЦ = 1.074 «Современные наукоемкие технологии» список ВАК ИФ РИНЦ = 0.909 «Успехи современного естествознания» список ВАК ИФ РИНЦ = 0.736 «Международный журнал прикладных и фундаментальных исследований» ИФ РИНЦ = 0.570 «Международный журнал экспериментального образования» ИФ РИНЦ = 0.431 «Научное Обозрение. Биологические Науки» ИФ РИНЦ = 0.303 «Научное Обозрение. Медицинские Науки» ИФ РИНЦ = 0.380 «Научное Обозрение. Экономические Науки» ИФ РИНЦ = 0.600 «Научное Обозрение. Педагогические Науки» ИФ РИНЦ = 0.308 «European journal of natural history» ИФ РИНЦ = 1.369 Издание научной и учебно-методической литературы ISBN РИНЦ DOI
Особую проблему в неврологии представляют нейродегенеративные заболевания, при которых происходит постепенная гибель клеток мозга. Чаще всего это сопровождается потерей памяти, изменениями психики и расстройствами движения. В эту группу входят болезнь Паркинсона и болезнь Альцгеймера, а также другие менее распространенные патологии. При этом точные механизмы, приводящие к гибели клеток, пока неясны, что затрудняет разработку патогенетических методов лечения.
Попытку разрешить эту проблему предприняли ученые из Королевского колледжа Лондона (King’s College London). По мнению Манолиса Фанто (Manolis Fanto) и его коллег, гибель нейронов может быть связана с нарушением аутофагии – процесса поглощения гибнущих и уже погибших клеток здоровыми. В норме аутофагия необходима для очищения ткани мозга от шлаков и токсинов, образующихся после гибели нейронов. В своей работе, опубликованной в журнале Current Biology, они приводят экспериментальные результаты, демонстрирующие состоятельность предложенной гипотезы.
Выяснилось, что у мышей, а также в культуре человеческих клеток остановка аутофагии приводила к увеличению концентрации токсических продуктов обмена и распада в ткани. Это, в свою очередь, негативно воздействовало на здоровые клетки. Они начинали выбрасывать во внешнюю среду жизненно необходимые соединения и накапливать в себе токсины, что приводило к нарушению их функции и гибели.
«Мы показали, как остановка аутофагии способствует гибели клеток. Раньше этот механизм не изучался», – прокомментировал Фанто результаты проведенной работы. Новая теория может объяснить, почему при некоторых нейродегенеративных заболеваниях использование лекарственных средств, усиливающих клеточный транспорт, могут привести к ухудшению симптоматики. Она также может способствовать разработке новых лекарств, блокирующих этот патологический путь.
Больше новостей и статей, посвященных нейродегенеративным заболеваниям и болезни Паркинсона, нашего портала.
Приведенные данные позволяют считать КН одним из наиболее частых видов неврологической патологии. Наличие и специфические особенности КН необходимо учитывать при постановке синдромального, топического и нозологического диагноза неврологическим пациентам.
В прошлом основной интерес клиницистов и исследователей был направлен на деменцию и другие виды тяжелых КН. В настоящее время в связи с расширением возможностей диагностики и лечения ранних стадий церебральной патологии все большее внимание уделяется КН без деменции, к которым относятся легкие и умеренные КН.
Умеренные когнитивные нарушения (УКН) – приобретенные объективные нарушения одной или нескольких когнитивных функций в результате органического поражения головного мозга, не приводящие к утрате пациентом независимости и самостоятельности в повседневной жизни. При умеренных КН отсутствует бытовая, социальная и профессиональная дезадаптация, однако могут отмечаться затруднения при осуществлении сложных видов деятельности и обучении .
Легкие когнитивные нарушения (ЛКН) – приобретенное субъективное или объективное снижение когнитивных функций различного характера, обусловленное возрастными или патологическими изменениями головного мозга, не влияющее на бытовую, профессиональную и социальную деятельность, даже наиболее сложные ее формы .
Причины когнитивной дисфункции в пожилом возрасте многообразны. В основе легких КН могут лежать естественные инволютивные изменения головного мозга, которые развиваются в процессе нормального старения. В то же время возраст является наиболее значимым фактором риска сосудистых и дегенеративных заболеваний головного мозга с клиникой КН . К таким заболеваниям относятся прежде всего болезнь Альцгеймера (БА) и цереброваскулярные расстройства. Также свой вклад в развитие легких и умеренных КН могут вносить эмоциональные расстройства и различные соматические заболевания. Нередко КН имеют многофакторную этиологию, когда начальные стадии первичного церебрального заболевания сочетаются с нарушениями дисметаболического и психогенного характера. В каждом конкретном случае КН необходимо уточнить роль каждого из основных патогенетических факторов для целенаправленного терапевтического воздействия (табл. 1).
Основными принципами ведения пациентов с КН, которые определяют эффективность медицинской помощи данной категории больных, являются:
– ранняя диагностика КН;
– установление точного нозологического диагноза;
– раннее начало патогенетической и симптоматической терапии;
– профилактика прогрессирования КН: воздействие на потенциально корригируемые факторы риска возникновения деменции;
– адекватное лечение сопутствующих соматических, неврологических и психических нарушений;
– динамическое наблюдение за пациентами с КН, корректировка проводимой терапии.
Ранняя диагностика КН. Одной из наиболее актуальных проблем ведения пациентов с КН является запоздалое выявление нарушений. Это происходит из–за недостаточной информированности врачей и населения в целом о данной проблеме. Многие полагают, что снижение памяти и других когнитивных функций представляет собой норму в пожилом и старческом возрасте. Пациенты и их родственники могут не обращаться к врачу вплоть до этапа развития крайне тяжелых нарушений, когда утрачиваются навыки самообслуживания или нарушается узнавание окружающих. Очевидно, что при подобной выраженности нарушений возможности эффективной помощи очень ограничены.
У неврологов, психиатров и врачей других специальностей должна присутствовать определенная настороженность в отношении КН при консультировании пациентов пожилого возраста. При жалобах на снижение памяти или умственной работоспособности для объективизации нарушений следует использовать нейропсихологические методы исследования. Для повседневной клинической практики можно рекомендовать простые психометрические методики, такие как КШОПС и тест рисования часов . При этом следует учитывать, что даже нормальные результаты тестирования при наличии активных жалоб на снижение памяти не исключают наличия легких КН и требуют наблюдения в динамике.
Нозологическая диагностика. КН могут развиваться в результате разнообразных неврологических и соматических заболеваний. Существует около 100 заболеваний, в рамках которых развиваются КН . Точная нозологическая диагностика необходима для правильного выбора терапии и определения прогноза заболевания. Диагностика базируется на совокупности анамнестических, клинических и инструментальных данных. Наиболее распространенные заболевания, приводящие к КН, приведены в таблице 2.
Лечение сопутствующих заболеваний. Сопутствующие соматические и эндокринные заболевания могут усугублять выраженность КН или быть их самостоятельной причиной вследствие системных дисметаболических расстройств. Наиболее распространенными в клинической практике дисметаболическими состояниями, которые отрицательно влияют на когнитивные функции, являются гипотиреоз, печеночная и почечная энцефалопатия, дефицит витамина В12 и фолиевой кислоты, хроническая гипоксия, сердечно–легочная недостаточность, экзогенные интоксикации, в том числе бытовые (алкоголизм) и лекарственные (холинолитики, бензодиазепины, нейролептики и др.) . Необходимо отметить, что в случае своевременной диагностики и полной коррекции КН дисметаболической природы являются обратимыми.
Большое значение в отношении прогноза КН имеет адекватное лечение сопутствующих сердечно–сосудистых нарушений. Следует отметить, что сердечно–сосудистые заболевания являются значимым фактором риска развития деменции. Напротив, лечение сердечно–сосудистых заболеваний уменьшает данный риск. В настоящее время имеются убедительные доказательства профилактического эффекта антигипертензивных средств в отношении прогрессирования КН. Такой эффект был показан у блокатора кальциевых каналов нитрендипина, при использовании комбинации периндоприла и индапамида и у блокатора рецепторов к ангиотензину–II эпросартана . Следует оговориться, что нормализации артериального давления следует добиваться планомерно и постепенно. Особенно опасно выраженное и быстрое снижение артериального давления при наличии гемодинамически значимого атеросклероза магистральных артерий головы.
Многочисленные наблюдения свидетельствуют, что выраженность КН значительно уменьшается при нормализации эмоционального состояния пациента. Между тем депрессия весьма распространена в пожилом возрасте, что может быть обусловлено актуальной ситуацией либо иметь органическую природу. Частыми причинами депрессии являются изменения социального статуса, утрата близких родственников, наступление инвалидизации в результате хронических заболеваний. Органическая природа депрессии отмечается при таких состояниях, как сосудистая мозговая недостаточность, болезнь Паркинсона, БА и многие другие. Депрессия может усугублять имеющиеся КН или сама по себе быть их причиной. В терапии депрессии у пожилых лиц следует избегать препаратов с выраженным холинолитическим действием, например, трициклических антидепрессантов, поскольку данные препараты могут усугублять КН. Напротив, современные антидепрессанты из группы селективных ингибиторов обратного захвата серотонина (флуоксетин, пароксетин, флувоксамин и др.) оказывают положительный эффект в отношении когнитивных функций .
Профилактика прогрессирования КН. КН в большинстве случаев являются прогрессирующим состоянием. Долговременные наблюдения свидетельствуют, что умеренные КН в большинстве случаев трансформируются в деменцию, будучи разными стадиями единого патологического процесса . В ведении пациентов с легкими и умеренными КН профилактика деменции является более важной задачей, чем уменьшение выраженности уже имеющихся КН. Основной мишенью профилактических мероприятий должны быть потенциально корригируемые факторы риска деменции (табл. 3) .
Выше уже говорилось, что профилактический эффект в отношении прогрессирования КН оказывает лечение сопутствующих сердечно–сосудистых заболеваний, поскольку хроническая недостаточность кровоснабжения головного мозга сама по себе вызывает КН, а также способствует увеличению темпов дегенеративного процесса. С целью оптимизации церебральной микроциркуляции и внутриклеточного метаболизма широко применяются препараты с полимодальным действием. В настоящее время большой интерес клиницистов и исследователей вызывает профилактический эффект препарата Танакан, обладающего широким спектром действия. В 2001 году были опубликованы результаты многолетнего наблюдения EPIDOS, которое проводилось французскими учеными. В исследовании участвовали 7598 женщин старше 75 лет, которые наблюдались на протяжении нескольких лет. Результаты исследования показали, что длительная терапия Танакана у пожилых пациенток приводила к более значительному снижению темпов прогрессирования КН по сравнению с группами больных, которым были назначены другие сосудистые препараты или не получавшие лечение вовсе . В настоящее время продолжаются проспективные исследования профилактического эффекта Танакана с участием большого числа пациентов. Так, в исследовании GuidAge, которое проводится на юге Франции, участвуют 2800 пациентов, а в исследовании GEM в США – 3000 пациентов с легкими или умеренными КН. Указанные исследования планируется завершить к 2010 году.
Большое внимание уделяется немедикаментозным методам профилактики деменции, к которым относятся средиземноморская диета, тренировка памяти и внимания и рациональные физические упражнения. Средиземноморская диета предусматривает использование в рационе оливкового масла, овощей (не реже 5 раз в неделю), морепродуктов (не реже 2 раз в неделю), а также небольшие (не более 150 г в день) дозы красного вина. Профилактический эффект подобной диеты в отношении нарушений памяти и внимания в пожилом возрасте был подтвержден в ходе целого ряда ретроспективных исследований .
Эпидемиологические исследования свидетельствуют, что лица напряженного интеллектуального труда реже заболевают БА и другими формами деменции. Высокий исходный интеллектуальный уровень удлиняет путь до клинической манифестации патологического процесса. Пациенты высокого интеллектуального уровня обладают более развитыми навыками когнитивной деятельности, которые позволяют им успешнее преодолевать трудности, появляющиеся в начале заболевания .
Как здоровым пожилым, так и при легких и умеренных КН показаны систематические упражнения по тренировке памяти и внимания. Целесообразность таких упражнений базируется на представлении о когнитивных функциях как об активных динамических функциональных системах, которые формируются прижизненно. Человек в процессе жизнедеятельности обучается стратегиям и навыкам восприятия, обработки, запоминания и воспроизведения информации. Человеческая память не является простым «хранилищем», куда складывается информация. Поэтому эффективность мнестической деятельности зависит не от объема памяти, который безграничен и мало меняется даже при тяжелых поражениях мозга, а от используемых стратегий запоминания и воспроизведения .
Программы тренировки памяти включают повышение мотивации пациента к запоминанию и воспроизведению, обучение эффективным стратегиям запоминания (так называемым «мнемоническим приемам»), развитие способности длительно поддерживать надлежащий уровень внимания, активное включение эмоциональной поддержки (как известно, эмоционально окрашенная информация запоминается лучше) и воображения. Эффективность систематической тренировки памяти и внимания доказана у пациентов с КН без деменции и даже при легкой деменции .
Эпидемиологические наблюдения свидетельствуют, что регулярная физическая активность также способствует уменьшению заболеваемости деменцией. В ряде аналитических работ было показано, что лица, регулярно выполняющие физические упражнения, имеют меньший риск развития деменции в пожилом возрасте. Вероятно, в основе данного феномена лежит благоприятное влияние физически активного образа жизни на сердечно–сосудистую систему .
Симптоматическая терапия КН. Для уменьшения выраженности уже имеющихся КН в клинической практике используется три основных подхода:
– воздействие на церебральные нейротрансмиттерные системы;
– вазоактивная терапия;
– нейрометаболическая терапия.
Воздействие на церебральные нейротрансмиттерные системы наиболее хорошо зарекомендовало себя на стадии деменции, однако также весьма перспективно при легких и умеренных КН. В лечение деменции активно используются ингибиторы ацетилхолинэстеразы (ривастигмин, галантамин, ипидакрин) и блокаторы NMDA–рецепторов к глутамату (мемантин) . Недавно предпринимались попытки применения ацетилхолинергических препаратов на стадии УКН, которые, однако, привели к противоречивым результатам . Вероятно, развитие ацетилхолинергического дефицита является достаточно поздним событием патогенеза когнитивных расстройств. Предполагается, что при ЛКН и УКН более перспективно воздействие на другие нейротрансмиттерные системы. С этой целью, в частности, используется пирибедил, который увеличивает дофаминергическую и норадренергическую церебральную активность . Изучается также эффективность мемантина при КН без деменции.
Как при цереброваскулярной патологии, так и при нейродегенеративном процессе патогенетически обоснованной является оптимизация церебральной микроциркуляции, которая имеет как профилактическое значение, так и способствует уменьшению выраженности уже имеющихся КН. С целью оптимизации микроциркуляции используются так называемые сосудистые препараты, к которым относятся Танакан, пентоксифиллин, винпоцетин, циннаризин и некоторые другие.
К настоящему времени накоплен богатый практический опыт применения при легких и умеренных КН препаратов, оптимизирующих нейрональные метаболические процессы. С этой целью используются производные пирролидона (пирацетам, прамирацетам, анирацетам, 4–фенил–пирацетам и др.), аминокислотные (глицин) и пептидергические (церебролизин, актовегин) препараты, а также предшественники ацетилхолина .
Несмотря на значительную длительность применения, точный механизм действия нейрометаболических препаратов остается неизвестным. Однако в эксперименте показано, что под влиянием нейрометаболической терапии в нервных клетках происходит увеличение числа рибосом, интенсифицируется синтез белка, выработка ацетилхолина и других нейротрансмиттеров, что, в конечном итоге, благоприятно влияет на активность нейронов и их способность к установлению новых функциональных связей (так называемая нейрональная пластичность). В клинической практике эффективность нейрометаболической терапии была показана при хронической сосудистой мозговой недостаточности, на начальных стадиях дегенеративного процесса, при возрастном снижении памяти и внимания, а также в восстановительном периоде после острого церебрального повреждения (инсульт, черепно–мозговая травма и др.) .
Одним из наиболее хорошо изученных сосудистых препаратов является Танакан. Выше уже упоминалось о вероятном профилактическом эффекте данного препарата в отношении прогрессирования КН. Кроме того, данный препарат обладает выраженным симптоматическим эффектом в отношении уменьшения выраженности уже имеющихся нарушений, что доказано в многочисленных плацебо–контролируемых исследованиях. Так, в 80–90–е гг. ХХ века в европейских странах и США был проведен ряд серьезных рандомизированных исследований эффективности Танакана при легких и умеренных КН в пожилом возрасте, а также при сосудистой деменции и деменции альцгеймеровского типа. Полученные данные указывают на то, что данный препарат оказывает клинически значимый эффект на всех стадиях когнитивного дефицита . Причем, по свидетельству M. Mazza и соавт., при БА эффективность Танакана сопоставима с эффективностью ингибитора ацетилхолинэстеразы донепизила . В то же время следует отметить, что безопасность Танакана у пациентов пожилого и старческого возраста на порядок выше.
В России и в Украине недавно было завершено многоцентровое несравнительное исследование эффективности Танакана при ЛКН и УКН сосудистой, дегенеративной и смешанной (сосудисто–дегенеративной) этиологии. 129 пациентов пожилого возраста получали Танакан в дозе 240 мг/сут. в течение 6 месяцев. На фоне данной терапии было отмечено статистически значимое улучшение когнитивных функций. Выявлено снижение выраженности КН в целом, улучшение внимания, памяти, речевых функций и психомоторных функций. Статистически значимые изменения показателей нейропсихологических тестов были выявлены к 12–й неделе от начала терапии и в дальнейшем продолжали нарастать .
Динамическое наблюдение. Пациенты с КН подлежат обязательному наблюдению в динамике для оценки эффективности и корректировки проводимой терапии. При неэффективности лечения следует повторно вернуться к рассмотрению диагноза. По опыту зарубежных специализированных «клиник памяти», в первые два года наблюдения за пациентами с КН диагноз может быть изменен, что связано с недостаточной надежностью существующих на сегодняшний день клинических и инструментальных диагностических критериев . Кроме того, даже при одинаковом диагнозе существует значительная вариабельность индивидуального терапевтического ответа на проводимое лечение. При этом модификация терапии нередко приводит к значительному повышению ее эффективности.
Таким образом, КН сегодня являются частично курабельным состоянием. Существуют возможности эффективной помощи пациентам на всех стадиях КН. Однако наиболее перспективно лечение легких и умеренных КН, не достигающих стадии деменции. Ведение пациентов с КН должно быть направлено на профилактику прогрессирования и трансформации в деменцию и уменьшение выраженности уже имеющихся КН.
Литература
1. Гаврилова С.И. Фармакотерапия болезни Альцгеймера. //Москва: изд–во «Пульс». –2003. –115С.
2. Дамулин И.В. Болезнь Альцгеймера и сосудистая деменция. // Под ред. Н.Н.Яхно. –М. –2002, 86 с.
3. Захаров В.В., И.В.Дамулин, Н.Н.Яхно. Медикаментозная терапия деменций. Клиническая фармакология и терапия. –1994. –Т.3. –№ 4. –С.69–75.
4. Захаров В.В. Применение танакана в нейрогериатрической практике. // Неврологический журнал. –1997. –Т.5. –С.42–49.
5. Захаров В. В., Яхно Н. Н. Нарушения памяти. // Москва: ГеотарМед. – 2003. – С. 110–111.
6. Захаров В.В. Всероссийская программа исследований эпидемиологии и терапии когнитивных расстройств в пожилом возрасте («Прометей»). //Неврологический журнал. –2006. –Т.11. –С.27–32.
7. Яхно Н.Н., Захаров В.В. Легкие когнитивные нарушения в пожилом возрасте. // Неврологический журнал. –2004. –№ 1. – С. 4 – 8.
8. Яхно Н.Н., Локшина А.Б., Захаров В.В. Легкие и умеренные когнитивные расстройства при дисциркуляторной энцефалопатии. //Клиническая геронтология. –2005. –Т.11. –№ 9. –С.38–39.
9. Яхно Н.Н., Захаров В.В., Локшина А.Б. Синдром умеренных когнитивных нарушений при дисциркуляторной энцефалопатии. // Ж Неврол Психиатр. –2005. –Т.105. –№2. –С.13–17.
10. Яхно Н.Н., Коберская Н.Н., Дамулин И.В., Захаров В.В., Мхитарян Э.А. Организация помощи пациентам с нарушениями памяти и других когнитивных функций. //Неврологический журнал. –2006. –Т.11. –Приложение № 1. –С.75–79.
11. Яхно Н.Н. Когнитивные расстройства в неврологической клинике. // Неврологический журнал. – 2006. – Т. 11. – Приложение № 1. – С. 4 – 12.
12. Яхно Н.Н., Захаров В.В., Локшина А.Б. и соавт. Танакан в терапии умеренных когнитивных нарушений (мультицентровое исследование). //Ж неврологии и психиатрии им. С.С.Корсакова. –2006. –Т.106. –№ 12. –С.41–46.
13. Amaducci L., L.Andrea. The epidemiology of the dementia in Europe. In : A.Culebras, J.Matias Cuiu, G.Roman (eds) : New concepts in vascular dementia .//Barselona: Prous Science Publishers.–1993. –Р.19–27.
14. Andrieux S., Amouyal K., Renish W. и соавт. The consumption of vasodilators and Ginkgo biloba (Egb 761) in a population of 7598 women over the age of 75 years. // Research and practice in Alzheimer’s disease. –2001. –V.5. –P.57–68.
15. Bars P., Katz M., Berman N., Itil T., Freedman A., Schatzberg A. A placebo–controlled, double–blind, randomized trial of an extract of ginkgo biloba for dementia. // JAMA. – 1997. –Vol.278, N.16. –P.1327–1332.
16. DiCarlo A., Baldereschi M., Amaducci L. Et al. Cognitive impairment without dementia in older people: prevalence, vascular risk factors, impact on disability. The Italian Longitudinal Study on Aging. //J Am Ger Soc. –2000. –V.48. –P.775–782.
17. Erminin–Funfschililling D., Meier D. Memory training: an important constituent of milieu therapy in senile dementia. //Z Gerontol Geriatr. –1995. –V.28. –N.3. –P.190–194.
18. Franco L., G.Cuny, F.M.C.Nancy. Multicentre study of the efficacy of TANAKAN (Egb 761) in the treatment of age–associated memory impairment. //Rev de Geriatrie. –1991. –V.4. –P.233–236.
19. Friedland R.P., Smyth K.A., Rowland D.Y. et al. Pre–morbid activities are reduced in patients with Alzheimer’s disease as compared to age and sex–matched controls: results of a case–control study. //In: «Alzheimer’s disease: biology, diagnosis and therapeutics”. Iqbal K., B.Winblad, T.Nishumura, , N.Takeda, H.Wishewski (eds). –J.Willey and sons ltd. –1997. –P.33–37.
20. Golomb J., Kluger A., Garrard P., Ferris S. Clinician,s manual on mild cognitive impairment // London: Science Press, 2001.
21. Graham J.E., Rockwood K., Beattie E.L. et al. Prevalence and severity of cognitive impairment with and without dementia in an elderly population. //Lancet. –1997. –V.349. –V.1793–1796.
22. Israel L., Melac M., Milinkevitch D., Dubos G. Drug therapy and memory training programs: a double blind randomized trial of general practice patients with age–associated memory impairment. //Int Psychogeriatr. –1994. –V.6. –N.2. –P.155–170.
23. Kanowski S. Proof of efficacy of the Ginkgo biloba special extract (Egb 761) in outpatients suffering from primary degenerative dementia of the Alzheimer’s type and multi–infarct dementia. //In: Y.Christen, Y.Courtois, M.T.Droy–Lefaix (eds): Effects of Ginkgo biloba extract (EGb 761) on aging and age–related disorders. Advances in Ginkgo biloba Extract Research.–V.4. Elsevier, Paris. –1995. –P.149–158.
24. Kivipelto M., Helkala E.L., Laakso M. et al. Middle life vascular risk factors and Alzheimer’s disease in later life: longitudinal population based study. //Br Med J. –2001. –V.322. –P.14447–1451.
25. Jelic V., Kivipelto M., Winblad B. Clinical trials in mild cognitive impairment: lessons for the future. //J Neurology Neurosurgery Psychiatry. –2006. –V.77. –N.7. –P.892.
26. Hill R.D., Sheikh I., Yesavage S. The effect of memory training on perceived recall confidence in the elderly. //Exp Aging Res. –1987. –V.13. –N.4. –P.185–188.
27. Hill R.D., Allen C., Gregory K. Self–generated mnemonics for enhancing free recall perfomance in older learners. //Exp Aging Res. –1990. –V.16. –N.3. –P.141–145.
28. Lachman M.E., Weaver S.L., Bandura M. et al. Improving memory and control belief through cognitive restructing and self–generated strategies. //J Gerontol. ––992. –V.47. –N.5. –P.293–299.
29. Lauteschlayer N.T., Almeida O.P. Physical activity and cognition in old age. //Curr Opin Psych. –2006. –V.19. –N.2. –P.190–193.
30. Lovenstone S., Gauthier S. Management of dementia. London: Martin Dunitz, 2001.
31. Mazza M., Capuana A., Bria P., Mazza S. Ginkgo biloba and donepizil: a comparison in the treatment of Alzheimer’s disease in a randomized placebo–controlled double blind study. //Eur J Neurol. –2006. –V.13. –N.9. –P.981–985.
32. Petersen R. S., Smith G. E., Waring S. C. et al Aging, memory and mild cognitive impairment // Int. Psychogeriatr. – 1997. – Vol. 9. – P. 37 – 43.
33. Rovio S., Kareholt I., Helkala E.L. et al. Leisure–time physical activity at midlife and the risk of dementia and Alzheimer’s disease. //Lancet Neurol. –2005. –V.4. –N.11. –P.705–711.
34. Scogin F., Bienas J.L. A three–year follow–up of older adult participants in a memory–skills training program. //Psychol Aging. –1988. –V.3. –N.4. –P.334–337.
35. Scrader J., Luder S., Kulschevski A. et al. Morbidity and mortality after stroke – Eprosartan compared with nitrendipine for secondary prevention (MOSES). //Stroke. –2005. –V.36. –P.1218–1226.
36. Skoog I., Gustafson D. Clinical trials for primary prevention in dementia. //In: «Dementia therapeutic research”. K.Rockwood, S.Gauthier (eds). –London a New York: Taylor a Francis. –2006. –P.189–212.
37. Storandt M. Memory–skills training for older adults. //Nebr Symp Motiv. –1991. –V.39. –P.39–62.
38. Sturman M.T., Morris M.C., Mendes de Leon C.F. et al. Physical activity, cognitive activity and cognitive decline in biracial community population. //Arch Neurol. –2005. –V.62. –N.11. –P.1750–1754.
39. Warsama Jama J., Launer L., Witteman J. et al. Dietary antioxidants and cognitive function in a population–based sample of older persons. The Rotterdam Study. //Am J Epidemiol. –1996. –V.144. –P.275–280.