Аспирационная пневмония у новорожденных
Содержание
Нарушения дыхания (Часть 3)
Malcolm I. Levene, David I. Tudehope, M. John Thearle
Главы из книги «Essencials of Neonatal Medicine»
Пневмония
Пневмония у новорожденных младенцев достаточно обычное явление и может возникать из-за вирусных, бактериальных или других агентов. Младенец может заразиться пневмонией in utero , и она может проявиться при рождении (конгениальная), или новорожденный может приобрести ее после рождения (внутрибольничная). Конгенитальная пневмония может быть обусловлена восходящей инфекцией при длительном разрыве плодного пузыря или, менее часто, трансплацентарной инфекцией (см. след. публикации). Предположение данного диагноза строится, исходя из истории болезни матери, клинического обследования и радиографии грудной клетки, и подтверждается бактериологическими культурами крови и содержимого трахеи.
Этиология
Пневмония у новорожденных обычно имеет бактериальную природу и наиболее часто бактериальными патогенами, обуславливающими конгенитальную или приобретенную пневмонии, являются Грам-отрицательные бациллы ( Eschrichia coli , Klebsiella, Pseudomonas, Serratia sp.), β-гемолитические стрептококки группы В и Staphilococcus sp .
Более редкая бактериальная инфекция включает Listeria monocytogenes и анаэробные бациллы. Иногда пневмония обуславливается Chlamidia trachomatis , Mycoplasma pnemoniae или оппортунистическими патогенами, такими как Candida albicans и Pnemocystis carini . Случаи вирусной пневмонии редки, но все же встречаются и вызываются цитомегаловирусом (СМВ), вирусом Coxsackie , респираторным хориовирусом и рубеллой.
Клинические признаки
Ранние клинические признаки и симптомы часто неспецифичны и могут включать летаргию, апноэ, брадикардию, нестабильность температуры и непереносимость кормления. При рождении может быть трудно отличить пневмонию от других форм легочных заболеваний. В других случаях типичные признаки респираторного дистресса могут иметь место от рождения. История матери и ребенка может выявить факторы, предрасполагающие к неонатальной инфекции.
Аускультация грудной клетки может показать сниженное поступление воздуха вокруг областей консолидации и выпота. При вдохе могут быть слышны добавочные дыхательные звуки.
Радиология
Картина является неспецифичной, и пневмония может быть трудно отличима радиологически от аспирационного синдрома и даже ТТН. На протяжении всех легких могут наблюдаться очаговые затемнения или более сливающиеся области радиологической плотности. Долевая пневмония редко видна у новорожденных.
Лечение
- Антибиотики. Широкого спектра после взятия поверхностных и глубоких культур.
- Физиотерапия . Изменение положения для постурального дренажа и активная физиотерапия грудной клетки для областей консолидации.
- Респираторная поддержка (см. след. публикации).
Синдром утечки воздуха
Это состояние обычно наблюдается у новорожденных младенцев и имеет несколько типов:
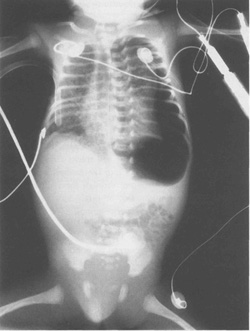
- Пневмоторакс – воздух в плевральной полости (рис.10.4).
- Пневмомедиастинум – воздух в клетчатке средостения (рис.10.5).
- Пневмоперикардиум – воздух в перикардиальном пространстве.
- Легочная интерстициальная эмфизема (ЛИЭ) – воздух в интерстициальном пространстве легких (рис.10.6).
- Пневмоперитонеум – воздух в области брюшины.
- Воздушная эмболия – проникновение воздуха в легочные вены и распространение по кровотоку.
 |
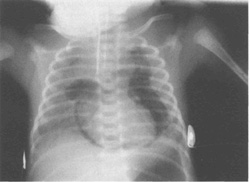 |
| Рис.10.4. Ретнген грудной клетки, показывающий левосторонний напряженный пневмоторакс. | Рис.10.5. Рентген грудной клетки, показывающий пневмомедиастинум. Контуры сердца и тимуса выделяются на фоне газа. |
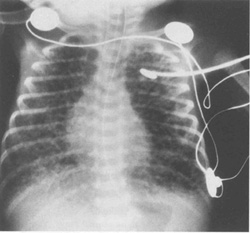
Рис.10.6. Рентген грудной клетки, показывающий обширную ЛИЭ. Заметьте перераздутие грудной клетки и уплощение диафрагмы.
Патофизиология этих состояний одинакова в том, что альвеолы, становясь перераздутыми, лопаются. Воздух затем выходит в интерстициальное пространство легких (ЛИЭ) и продвигается вдоль периваскулярных пространств в средостение (пневмомедиастинум) через висцеральную плевру (пневмоторакс) или реже в перикардиум (пневмоперикардиум).
Спонтанный пневмоторакс возникает приблизительно в 1% случаев влагалищных родов и в 1.5% кесаревых сечений. Многие из них имеют только малые (слабые) симптомы и обнаруживаются неожиданно на рентгене грудной клетки.
Реанимация с вентиляцией положительным давлением делает возникновение пневмоторакса намного более вероятной. Терапия сурфактантом значительно снижает частоту синдрома утечки газа у вентилируемых младенцев.
Пневмоторакс обычно возникает в следующих условиях:
- жесткие легкие, напр. болезнь геалиновых мембран;
- перераздутие легких, напр. аспирация меконием;
- недоразвитые (гипопластические) легкие, напр. синдром Поттера, диафрагмальная грыжа;
- искусственная вентиляция или НПДДП предрасполагают к синдрому утечки воздуха у 10% вентилируемых младенцев. Длительное время вдоха и высокое давление в конце выдоха являются особенно вероятными причинами пневмоторакса. Активный выдох против «дыхания» вентилятора также может быть вероятной причиной (см. след. публикации).
Клинические признаки
У младенцев с пневмотораксом напряжения очевидны признаки тяжелого респираторного дистресса. Часто синдром утечки воздуха возникает у ребенка, который уже имеет респираторный дистресс и может наблюдаться внезапное ухудшение с цианозом, недостаточной периферической перфузией и брадикардией. Специфическими признаками пневмоторакса напряжения являются сдвиг средостения к противоположной стороне, ассиметричное расширение грудной клетки, ассиметричный вход воздуха и слабый периферический пульс. Выступающая грудина позволяет предположить пневмомедиастинум.
Иногда развивается односторонняя ЛИЭ, как результат клапанного эффекта в главных бронхах. Легкое, пораженное эмфиземой, может обусловить компрессию более здорового легкого, следовательно, еще сильнее затрудняя вентиляцию (рис. 10.7)
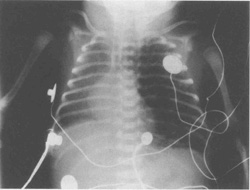
Рис.10.7. Рентген грудной клетки, показывающий левовтроннюю ЛИЭ. Средостение и правое легкое компрессированы перераздутым левым легким.
Диагноз
Постановка определенного диагноза осуществляется с помощью передне-задней проекции на рентгене. Чтобы обнаружить небольшой пневмоторакс потребуется вертикальная пленка, тогда как латеральная пленка будет необходима для диагностики наличия воздуха в переднем средостении. Когда имеет место пневмомедиастенум, на рентгене грудной клетки виден морской знак или спиннакер. У младенцев, находящихся в критическом состоянии и имеющих пневмоторакс напряжения, с целью подтверждения диагноза может быть предпринята диафоноскопия (трансиллюминация) грудной клетки. Иногда введение иглы-бабочки калибра 21G с лабораторной бюреткой и шприцем может спасти жизнь при подозрении на пневмоторакс напряжения. Эта срочная процедура диагностики и терапии проводится у критически больных младенцев в тех случаях, когда может быть задержка в получении результатов рентгеновского исследования. Слепое прокалывание иглой грудной клетки может обусловить пневмоторакс и должно предприниматься исключительно в срочных случаях.
Лечение
Для облегчения пневмоторакса напряжения можно ввести межреберный катетер во второе межреберное пространство по среднеключичной линии и соединить его с затвором подводного дренажа или клапаном однопроходного вибратора Хеймлиха . Иногда эвакуация из пневмоторакса будет неполной с помощью этого катетера, и тогда катетер необходимо поместить более назад в шестое межреберное пространство по среднеподмышечной линии. Для ненапряженного пневмоторакса у доношенных младенцев дыхание 100% кислородом в течение до 12 часов может ускорить реабсорбцию пневмоторакса. Изредка наличие большого плеврального или лимфатического выпота может потребовать торакосемтез.
ЛИЭ лучше всего лечить вентиляцией с быстрой частотой (см. след. публикации) или высокочастотной осциляторной вентиляцией. Тяжелую ЛИЭ с компрессией другого легкого можно лечить путем селективной интубации более здорового легкого, таким образом, позволяя легкому, пораженному эмфиземой, находиться в состоянии коллапса. (Brooks et al., 1977). Спустя 24-48 часа при условии, что наступило улучшение, подтвержденное радиологически, трубка должна быть удалена.
Синдром аспирации мекония
Синдром аспирации мекония является серьезной причиной респираторного дистресса у новорожденных, которую потенциально можно предотвратить. Меконий, подкрашенный амниотической жидкостью, почти всегда встречается у доношенных или переношенных младенцев и наблюдается приблизительно в 13% родов. Пассаж мекония часто указывает на дистресс плода, но при тазовом предлежании плода может быть нормальным явлением. Является ли это признаком дистресса плода или нет, возможность его аспирации в легкие должна быть серьезно принята во внимание. Аспирация мекония может возникнуть во время родов или при начале дыхания новорожденного. Ответом младенца на аспирацию во время родов является затрудненное дыхание, а если меконий попал в дыхательные пути, он будет аспирирован глубоко в бронхи. Как только начинается дыхание, возникает дистальная миграция мекония в малые (нижние) дыхательные пути.
Клинические признаки
Имеется широкий спектр проявлений этого состояния от тяжелой асфиксии, требующей активной реанимации, через раннее наступление респираторного дистресса до обычного состояния энергичного ребенка, не имеющего больших проблем. Типичным признаком этого состояния является то, что младенец рождается, покрытый ликвором, подкрашенным меконием, и имеет меконий, осажденный на пуповине, коже и ногтях. Грудная клетка перераздута, а грудина может резко выступать. Респираторный дистресс может сначала быть легким, быстро становясь более и более тяжелым спустя нескольких часов. У ребенка также могут появиться признаки церебральной раздражимости (чувствительности).
Патогенез и этиология
Меконий обуславливает закупорку дыхательных путей с последующим ателектазом. Он также приводит к обструкции по клапанному эффекту, сопровождающейся перераздутием легких и высоким риском синдрома утечки воздуха. Меконий раздражает дыхательные пути, обуславливая химическую пневмонию, иногда возникает вторичная бактериальная инфекция. У младенцев с тяжелым аспирационным синдромом развивается заметная вентиляционно-перфузионная неравномерность, приводящая к шунту справа налево и легочной гипертензии.
Радиология
На рентгене грудной клетки видно перераздутие (плоские диафрагмы, расширение реберных пространств) с диффузными затемнениями по всем полям обоих легких (рис.10.8). Может быть также виден пневмоторакс или пневмомедиастинум.
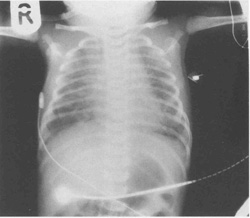
Рис.10.8. Рентген грудной клетки, показывающий синдром аспирации мекония. Наблюдается обширное дискретное затенение через оба легочных поля.
Профилактическое ведение
Заболеваемость и смертность от синдрома аспирации мекония может быть предотвращена или минимизирована оптимальным перинатальным ведением. Ведется дискуссия о том, должен ли неонатальный педиатр посещать все роды, при которых имеет место меконий, окрашивающий ликвор. Очень важно, однако, чтобы опытный неонатолог присутствовал при родах, если наблюдается толстый меконий. В этих условиях должно быть предпринято следующее:
- как только показалась голова и до появления плечей, акушерка должна быстро очистить (отсосать) ротоглотку младенца. Пуповина должна быть дважды пережата для анализа артериальных газов;
- после родов ребенок должен быть перемещен в реанимационную тележку, где реаниматолог аспирационным катетером отсасывает содержимое из ротоглотки под прямым ларингоскопическим контролем (обзором);
- если ребенок угнетен и если меконий виден в задней глотке, на или за голосовыми связками, ребенка необходимо интубировать эндотрахеальной трубкой с широким отверстием (просветом) и чисто отсосать трахею. Отсасывание облегчается использованием аспиратора для мекония. Отсасывание ртом из эндотрахеальной трубки не должно практиковаться. Дальнейшее отсасывание применяется непосредственно через эндотрахеальную трубку, до тех пор, пока ее не удалят. Если после экстубации в эндотрахеальной трубке находится большое количество мекония, ребенок должен быть реинтубирован и должно быть проведено дальнейшее трахеальное отсасывание. Желудок должен быть аспирирован вслед за интубацией и если там находится умеренное или большое количество мекония, желудочный зонд должен быть оставлен in situ для промывания, которое должно быть проведено позже;
- если ребенок энергичен и находится в хорошем состоянии, и только тонкий меконий отсасывается из задней глотки, нет необходимости проводить трахеальную интубацию;
- все дети, родившиеся с толстым меконием в ликворе, должны быть внимательно осмотрены, и у них должен проводиться регулярный мониторинг с тем, чтобы своевременно выявить признаки синдрома аспирации мекония.
Лечение подтвержденного синдрома аспирации мекония
Лечение будет таким же, как и при респираторном дистрессе (см. след. публикации). Особенные акценты должны быть сделаны на следующем:
- увлажнение вдыхаемого воздуха
- постуральный дренаж путем изменения положения, отсасывание из дыхательных путей и перкуссия грудной клетки
- антибиотики: обычно даются, хотя их эффективность не была установлена
Современные классификации, в зависимости от условий возникновения заболевания, подразделяют пневмонии на две большие группы: внебольничные и нозокомиальные (госпитальные) пневмонии . Такой подход обоснован различными причинными факторами пневмоний и различными подходами к выбору антибактериальной терапии. Кроме того, принято отдельно рассматривать пневмонии у больных с тяжелыми дефектами иммунитета и аспирационные пневмонии, так как такая классификация пневмоний имеет большое практическое значение с точки зрения ведения больных .
Аспирация из ротовой полости и носоглотки является одним из наиболее частых путей проникновения микроорганизмов в дыхательные пути, другие механизмы (ингаляция, гематогенное распространение, контактное проникновение из очага инфекции) играют гораздо меньшую роль в генезе пневмоний. Несмотря на то, что аспирация является основным механизмом поступления патогена в дыхательные пути как при внебольничных, так и госпитальных пневмониях, аспирационными пневмониями (АП) принято называть только пневмонии у больных после документированного эпизода массивной аспирации или у больных, имеющих факторы риска для развития аспирации.
Аспирация содержимого ротовой полости и носоглотки является частым событием у здоровых людей во время сна. В нескольких исследованиях при ирригации носоглотки раствором с радиоактивной меткой, аспирация была документирована у 45–50% здоровых лиц и у 70% больных с нарушением уровня сознания . Однако не каждая аспирация ведет к развитию пневмонии. Возникновение пневмонии зависит от числа бактерий, достигающих терминальных бронхиол (размер инокулюма), вирулентности бактерий и, с другой стороны, от состояния защиты нижних дыхательных путей. Статус защитной системы хозяина определяет, будет ли микроорганизм размножаться и вызывать пневмонию, или будет уничтожен факторами защиты.
Итак, для развития аспирационной пневмонии необходимо наличие двух условий:
1) нарушение местных факторов защиты дыхательных путей: закрытия глотки, кашлевого рефлекса, активного мукоцилиарного клиренса и др.
2) патологический характер аспирационного материала: высокая кислотность, большое количество микроорганизмов, большой объем материала и др.
Факторы риска
К факторам риска развития аспирационных состояний относятся снижение уровня сознания, нарушение глотания (дисфагия), нарушение функции кардиального сфинктера пищевода, плохое гигиеническое состояние полости рта (табл. 1) .
Во время комы практически любой этиологии (инсульты и другие цереброваскулярные события, передозировка снотворных, транквилизаторов и наркотических препаратов), при судорожных состояниях, общей анестезии происходит нарушение нормального глоточного рефлекса и секрет ротоглотки затекает в дыхательные пути, т.е. происходит аспирация.
Длительный прием алкоголя приводит к нарушению факторов иммунной защиты, кашлевого рефлекса и к орофарингеальной колонизации патогенными микроорганизмами, включая, кроме традиционной анаэробной флоры, Staphylococcus aureus и грамотрицательные микроорганизмы (Klebsiella spp, Enterobacter spp, Pseudomonas spp). Высокая частота аспирационных событий у алкоголиков связана с эпизодами бессознательных состояний во время алкогольных эксцессов, нарушениями сна, рвотой и моторными нарушениями пищевода.
Дисфагия является одним из самых сильных предикторов развития АП. В проспективном исследовании J. Croghan et al. было обнаружено, что в течение 12 месяцев АП возникла у 50% лиц с дисфагией и аспирацией, документированными во время видеофлюорографии, в то время как в группе больных без подтвержденной дисфагии в течение того же срока АП была выявлена в 12,5% .
Во многих работах показана сильная ассоциация между нарушением моторики пищевода и частотой развития АП: при гастроэзофагеальном рефлюксе и болезнях пищевода, состояниях после гастроэктомии, при зондовом питании.
Плохое состояние полости рта также является фактором риска АП. Нормальная микрофлора ротоглотки содержит анаэробы в концентрации 108 микроорганизмов/мл (Fusobacterium, Bacteroides, Prevotella, анаэробные кокки) и аэробы в концентрации 107 микроорганизмов в 1 мл (в основном, кокки). Число микроорганизмов снижается у людей без зубов и значительно повышается при наличии гингивита и периодонтита – до 1011 в 1 мл .
Характеристика аспирированного материала
Характер материала, аспирированного в дыхательные пути, также имеет огромное значение в патогенезе аспирационных пневмоний. Высокая концентрация микроорганизмов в аспирате, а также наличие в нем высоковирулентных патогенов обеспечивают преодоление защитных сил макроорганизма и развитие инфекции .
Кроме того, химические свойства аспирата являются фактором, определяющим характер повреждения легких. Очень низкий рН аспирата (< 2,5) приводит к развитию химического пневмонита – неинфекционного повреждения легких, характеризующегося нейтрофильным воспалением. Данный тип поражения легких приводит к нарушению барьера слизистой дыхательных путей, повышая риск развития бактериальной инфекции.
Низкая кислотность желудочного содержимого также является фактором риска развития АП. У госпитализированных больных при рН желудочного сока более 3,5–4,0 происходит колонизация желудка грамотрицательными бактериями, поэтому вмешательства, повышающие рН желудка (Н2–блокаторы), могут рассматриваться, как факторы риска АП, особенно у больных, находящихся в отделениях интенсивной терапии.
Большой объем аспирата или наличие в нем крупных частиц приводит к механической обструкции дыхательных путей, развитию ателектазов, застою бронхиального секрета, опять же повышая риск развития легочной инфекции. По некоторым данным, наиболее опасна аспирация материала растительного происхождения.
Аспирационные синдромы
Аспирация в трахеобронхиальное дерево может приводить к различным последствиям: от полного отсутствия каких-либо клинических событий до развития острого респираторного дисстресс-синдрома, дыхательной недостаточности и смерти больного. В 1975 г. J. Bartlett и S. Gorbach предложили рассматривать аспирационный синдром, как «тройную угрозу»: 1) механическая обструкция дыхательных путей; 2) химический пневмонит; 3) бактериальная пневмония . Хотя очевидно, что лишь последний аспирационный синдром может быть отнесен к категории «аспирационная пневмония», но и первые два могут быть рассмотрены, как состояния, способные приводить к развитию аспирационной пневмонии примерно в 30% случаев.
Клиническая картина
Аспирационная пневмония имеет довольно большой удельный вес среди всех форм пневмоний,. Так, по данным мультицентрового исследования O.Leroy et al., около 23% тяжелых форм пневмоний в отделениях интенсивной терапии приходится на АП .
АП вызывается микроорганизмами, в нормальных условиях колонизирующими верхние дыхательные пути, т.е. маловирулентными бактериями, в большинстве случаев, анаэробами. АП может рассматриваться, как плевролегочная инфекция, которая при отсутствии терапии проходит следующие этапы развития: пневмонит (пневмония), некротизирующая пневмония (формирование очагов деструкции размерами менее 1 см, без уровней жидкости), абсцесс легких (одиночные или множественные полости размерами более 2 см), эмпиема плевры (рис. 1–4). Распределение аспирированного материала, а, следовательно, и локализация инфекционных очагов в легких зависят от положения тела больного в момент аспирации. Чаще всего АП развивается в задних сегментах верхних долей и верхних сегментах нижних долей (зависимые сегменты), если аспирация произошла в то время, когда больной находился в горизонтальном положении, и в нижних долях (больше справа), если больной находился в вертикальной позиции.

Рис. 1. Рентгенологическая картина АП нижней доли правого легкого у мужчины 18 лет, возникшей после аспирации во время алкогольного опьянения (изменение тени сердца связано с врожденным пороком сердца).

Рис. 2. Некротизирующая пневмония верхней доли правого легкого у мужчины 56 лет, возникшая после массивной аспирации во время судорожного синдрома.

Рис. 3. Абсцесс легкого у мужчины 58 лет, страдающего алкоголизмом.
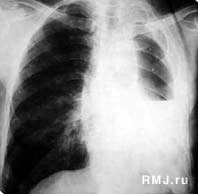
Рис. 4. Аспирационная пневмония нижней доли левого легкого и левосторонний пио-пневмоторакс у женщины 67 лет, перенесшей инсульт и страдающей дисфагией.
В отличие от пневмонии, вызванной типичными внебольничными штаммами (пневмококк), АП развивается постепенно, без четко очерченного острого начала (табл. 2). У многих больных через 8–14 дней после аспирации развиваются абсцессы легких или эмпиема. При появлении очагов деструкции примерно у половины больных отмечается продукция мокроты со зловонным гнилостным запахом, возможно развитие кровохарканья. Отсутствие гнилостного запаха даже при формировании абсцесса не исключает значения анаэробов в генезе АП, т.к. некоторые анаэробные микроорганизмы (микроаэрофильные стрептококки) не приводят к образованию продуктов метаболизма, обладающих гнилостным запахом. Другие симптомы АП не отличаются от других форм пневмонии: кашель, диспное, плевральные боли, лихорадка, лейкоцитоз. Однако у многих больных их развитию предшествуют несколько дней, а иногда и недель маловыраженных клинических признаков (слабость, субфебрильная лихорадка, кашель, у ряда больных – снижение веса и анемия) . При АП, вызванной анаэробами, у больных практически никогда не наблюдается ознобов. К важным особенностям клинической картины можно отнести фоновые состояния больного: болезни периодонта, нарушение глоточного рефлекса, алкоголизм, эпизоды нарушения сознания.

Характерные клинические особенности аспирационной пневмонии:
• постепенное начало
• документированная аспирация или факторы, предрасполагающие к развитию аспирации
• отсутствие ознобов
• зловонный запах мокроты, плевральной жидкости
• локализация пневмонии в зависимых сегментах
• некротизирующая пневмония, абсцесс, эмпиема
• наличие газа над экссудатом в плевральной полости
• красная флюоресценция мокроты или плевральной жидкости в ультрафиолетовом свете (инфекция, вызванная Porphyromonas)
• отсутствие роста микроорганизмов в аэробных условиях.
Летальность при аспирационных пневмониях достигает 22%. Независимыми предикторами плохого прогноза являются неэффективная начальная антибактериальная терапия, бактериемия, госпитальная суперинфекция .
Микробиология АП
Причинными факторами большинства АП являются анаэробы (около 50%), чаще всего комбинация этих микроорганизмов (как минимум, два патогена), реже комбинация анаэробов и аэробов (40%) и еще реже – аэробами (10%) . Роль анаэробов в генезе АП была впервые установлена в 1970–х годах при использовании для забора материала пункции трахеи с аспирацией секрета (метод транстрахеальной аспирации). Структура патогенов, вызывающих АП, за последние годы практически не изменилась, некоторые изменения претерпела таксономическая классификация части микроорганизмов.
Наиболее частыми причинными анаэробными микроорганизмами при АП являются Fusobacterium nucleatum, Prevotella malanogenica (ранее относившаяся к роду Bacteroides), Porphyromonas spp (ранее относившиеся к роду Bacteroides), Streptococcus intermedius (ранее называвшиеся Peptostreptococcus), микроаэрофильные стрептококки. Кроме того, определенное значение также имеют и микроорганизмы рода Bacteroides (B.buccae, B.oris, B.oralis и др), однако подчеркивается, что роль Bacteroides fragilis при аспирационной пневмонии преувеличена . В некоторых исследованиях микроорганизм Veilonella parvula являлся причиной до 12% всех аспирационных пневмоний . Все перечисленные микроорганизмы менее вирулентны по сравнению с аэробными возбудителями внебольничных пневмоний, с чем и связано менее бурное течение воспалительного процесса. Исключение составляет Fusobacterium necrophorum, который обладает исключительно вирулентными свойствами, но в настоящее время пневмония, вызванная этим патогеном, встречается очень редко.
Возбудители аспирационных пневмоний:
Анаэробные бактерии
• Prevotella malanogenica
• Porphyromonas spp
• Fusobacterium nucleatum
• Fusobacterium necrophorum
• Bacteroides spp (B.buccae, B.oris, B.oralis и др.)
• Veilonella parvula
• Streptococcus intermedius
Аэробные бактерии
• Staphylococcus aureus
• Streptococcus pyogenes
• Streptococcus viridans
• Haemophilus influenzae (особенно тип b)
• Eikenella corrodens
• Klebsiella pneumoniae
• Escherichia coli
• Enterobacter cloacae
• Proteus mirabilis
• Pseudomonas aeruginosa
Получение культуры анаэробных микроорганизмов является довольно сложной задачей и требует соблюдения, как минимум, трех условий: правильный забор материала, его транспорт и посев на специальные среды.
Следует подчеркнуть, что экспекторированная мокрота не может быть использована для получения культуры анаэробов, так как в норме они в больших количествах присутствуют в верхних дыхательных путях и неизбежно контаминируют мокроту. При наличии эмпиемы плевральная жидкость является хорошим источником для этиологической диагностики. Положительная гемокультура также может приблизить к идентификации причинного патогена, однако аспирационная пневмония нечасто ассоциирована с бактериемией.
Забор материала из нижних дыхательных путей для получения анаэробных культур возможен при использовании методов, позволяющих избежать контаминации образца микрофлорой ротоглотки.
Чаще других используются метод транстрахеальной аспирации (ТТА) и метод защищенной щеточной биопсии (ЗЩБ). Несмотря на хорошую информативность, ТТА в настоящее время используется гораздо реже, чем раньше (хотя по–прежнему широко применяется в некоторых центрах Европы и в Японии). Причина – недостатки метода ТТА: инвазивность, невозможность проведения у интубированных больных, риск кровотечения. Хорошей альтернативой ТТА является метод ЗЩБ – получение материала во время фибробронхоскопии при помощи бронхиальной щетки, защищенной от контаминации внутри двойного телескопического катетера, закрытого биодеградирующей пробкой. Данный метод в настоящее время широко используется для диагностики респиратор–ассоциированных пневмоний. Однако есть данные о применении ЗЩБ при аспирационной пневмонии, причем результаты микробиологических исследований материала нижних дыхательных путей, полученного при помощи ЗЩБ, примерно такие же, как при использовании ТТА: при остром абсцессе легких анаэробы были изолированы в 74% случаев . Полученный материал должен быть немедленно помещен в анаэробную среду (транспортная емкость с анаэробной средой) и как можно быстрее доставлен в микробиологическую лабораторию. Определенное значение может иметь и выбор сред для культивирования анаэробов .
Среди аэробных бактерий в генезе АП имеют значение такие микроорганизмы, как Staphylococcus aureus, Streptococcus pyogenes, Streptococcus vitridans, Haemophilus influenzae (особенно тип b), Eikenella corrodens, Klebsiella pneumoniae, Escherichia coli, Enterobacter cloacae, Proteus mirabilis, Pseudomonas aeruginosa . Аэробные микроорганизмы выделяют особенно часто при нозокомиальных АП, кроме того, их доля очень высока среди больных с тяжелой АП, требующей госпитализации в отделения интенсивной терапии . Объяснением такого различия микробного пейзажа по сравнению с внебольничной АП является высокая колонизация аэробными микроорганизмами (особенно грамотрицательными) ротоглотки и параназальных синусов у тяжелых больных, находящихся в стационаре.
Роль анаэробов в генезе нозокомиальных АП менее значима по сравнению с аэробами, хотя в ряде исследований было показано, что доля анаэробов в этиологии нозокомиальных АП (в том числе и респиратор–ассоциированных) может достигать 23–35% .
Лечение
Антибактериальная терапия является основным компонентом лечения аспирационной пневмонии. Выбор антибиотика зависит от тяжести АП (см. ниже), окружения, в котором возникла пневмония, и наличия или отсутствия факторов риска для колонизации дыхательных путей грамотрицательными микроорганизмами .
Критерии тяжелой пневмонии (American Thoracic Society, Am Rev Respir Dis 1993; 148: 1418– 1426):
• Частота дыхания более 30 в 1 мин
• Потребность в искусственной вентиляции легких
• Тяжелая дыхательная недостаточность (PaO2 / FiO2 < 250 мм рт.ст.)
• Двухсторонняя пневмония по данным рентгенографии, увеличение размера инфильтрата на 50% и более в течение 48 часов
• Шок (систолическое давление менее 90 мм рт.ст. или диастолическое давление менее 60 мм рт.ст.)
• Потребность в вазопрессорных препаратах более 4 часов;
• Диурез менее 20 мл/час, острая почечная недостаточность, требующая проведения диализа.
Основной причиной АП, возникшей вне стационара, являются анаэробы, поэтому назначаемые антибиотики должны быть активными по отношению к ним (Fusobacterium spp, Prevotella spp, Porphyromonas spp, Bacteroides spp, анаэробные и микроаэрофильные Streptococci). Учитывая сложность получения культур анаэробных микроорганизмов, терапия в большинстве случаев является эмпирической. Традиционным выбором для терапии АП и абсцесса легких долгое время считался пенициллин G (бензилпенициллин), назначаемый внутривенно в относительно высоких дозах (12–20 млн ед. в сутки). Однако, как показали исследования последних лет, около 30% всех анаэробов продуцируют b–лактамазы, а доля резистентных штаммов среди Bacteroides spp достигает 90% . Кроме того, весомая доля аэробных бактерий, участвующих в развитии аспирационных пневмоний в ассоциации с анаэробами или без них, также ставит под вопрос пенициллин G, как препарат выбора при аспирационной пневмонии .
В настоящее время предпочтение отдается клиндамицину (внутривенно 600 мг каждые 8 часов с последующим переходом на прием per os 300 мг каждые 6 часов), который обладает большей активностью по сравнению с пенициллином против анаэробов (в т.ч. и Bacteroides spp). В нескольких сравнительных исследованиях эффективности пенициллина G и клиндамицина при некротизирующей пневмонии и абсцессе легких было показано, что при использовании клиндамицина удается чаще добиться клинического успеха, достигается более быстрое снижение лихорадки и наблюдается меньшее число рецидивов легочных инфекций. В исследовании F. Gudiol et al., включавшем 37 больных с некротизирующей пневмонией, успех антибактериальной терапии составил 18 случаев из 19 при использовании клиндамицина и 10 из 18 – при терапии пенициллином . Число анаэробов, резистентных к клиндамицину, составляет около 5% (4–22% в группе Bacteroides fragilis) .
К эффективной эмпирической терапии аспирационных пневмоний также относят комбинацию внутривенных пенициллина G и метронидазола (500 мг каждые 8–12 часов). Метронидазол обладает высокой активностью в отношении практически всех анаэробов, число резистентных штаммов составляет не более 12% . Следует подчеркнуть, что метронидазол не должен назначаться в виде монотерапии, т.к. в ряде исследований частота неуспеха антибактериальной терапии анаэробных легочных инфекций составляла до 50%. Причинами такой низкой эффективности монотерапии метронидазолом являются: 1) отсутствие активности в отношении микроаэрофильных и аэробных стрептококков, которые при АП присутствуют в культурах до 50% случаев; 2) относительно низкая активность по отношению к грамположительным анаэробам.
К препаратам первой линии для терапии АП некоторые согласительные документы относят также и «защищенные» пенициллины (комбинация b–лактам + ингибитор b–лактамаз) . Высокая эффективность амоксициллина/клавуланата была продемонстрирована в мультицентровом проспективном исследовании P. Germaud et al., включавшем 57 больных с абсцессом легких, некротизирующей пневмонией и эмпиемой плевры (у 27 из них предшествующая антибактериальная терапия оказалась неэффективной) – терапия амоксициллином/клавуланатом оказалась успешной у 52 больных (91%) . Кроме амоксициллина/клавуланата (средняя доза 1,2 г каждые 8 часов в/в), высокой анаэробной активностью обладают также и другие «защищенные» пенициллины: ампициллин/сульбактам (3 г каждые 6 часов в/в), тикарциллин/клавуланат (3,2 г каждые 6–8 часов в/в), пиперациллин/тазобактам (4,5 г каждые 8 часов в/в) (табл. 3).

Карбапенемы (имипенем/циластатин и меропенем) обладают высокой активностью против анаэробов, поэтому они могут быть использованы при аспирационных пневмониях, особенно при их тяжелом течении. В исследованиях in vitro доля анаэробов, чувствительных к имипенему/циластатину приближается к 100%. В одном из клинических исследований, посвященных использованию карбапенемов при аспирационных пневмониях, эффективность имипенема/циластатина в монотерапии составила 78,6%, отсутствие клинического эффекта было отмечено у больных с инфекцией, вызванной P.aeruginosa . Имепенем и меропенем обладают примерно одинаковой активностью в отношении анаэробных микроорганизмов (оба препарата назначаются в/в в дозе 0,5–1 г каждые 8 часов). Преимуществом «защищенных» пенициллинов и карбапенемов является их широкий антибактериальный спектр, включающий грамположительные и грамотрицательные аэробы, что позволяет широко использовать их в монотерапии при тяжелых внебольничных и госпитальных аспирационных пневмониях.
К препаратам, обладающим плохой активностью при анаэробных инфекциях, а следовательно, и при АП, относятся аминогликозиды, офлоксацин, ципрофлоксацин, цефтазидим, цефтриаксон, азтреонам и триметоприм/сульфаметоксазол.
Из группы цефалоспоринов наибольшую активность по отношению к анаэробам имеют цефамицины (цефокситин, цефотетан, цефметазол), однако до 30% микроорганизмов группы B.fragilis резистентны к ним.
Среди перспективных препаратов для терапии АП необходимо отметить новые фторхинолоны – моксифлоксацин, гатифлоксацин и тровафлоксацин . Также есть экспериментальные данные о высокой активности новых макролидов (кларитромицин) против анаэробов . Клинических данных об эффективности новых фторхинолонов и макролидов при АП пока нет.
Предложенные схемы антибактериальной терапии нуждаются в модификации при тяжелой пневмонии, при возникновении пневмонии в стационаре и наличии факторов риска колонизации дыхательных путей больного грамотрицательными микроорганизмами (см. ниже). В таких ситуациях очень высока вероятность вирулентных аэробных патогенов как причины АП, поэтому рекомендовано дополнительное «прикрытие» также и грамотрицательных микроорганизмов, а иногда и метициллин–резистентных S.aureus. Особую проблему представляют пневмонии, вызванные P.aeruginosa, поэтому в качестве препаратов эмпирической терапии при госпитальной АП рекомендовано использовать комбинацию антибиотиков, активных против P.aeruginosa (ципрофлоксацин, цефтазидим, цефперазон) и против анаэробов (клиндамицин или метронидазол). Также возможно использование карбапенемов (имипенем/циластатин, меропенем) или «защищенных» пенициллинов в виде монотерапии или в комбинации с аминогликозидами или фторхинолонами (табл. 3). После назначения эмпирической антимикробной терапии, последующие посевы мокроты и трахеальных аспиратов (у интубированных больных) могут помочь в выявлении P.aeruginosa и других аэробных микроорганизмов, а также в дальнейшей коррекции терапии.
Факторы риска колонизации грамотрицательными микроорганизмами:
• Кома
• Снижение питательного статуса
• Интубация трахеи
• Оперативное вмешательство
• Сахарный диабет
• Почечная недостаточность
• Хронические легочные заболевания
• Курение
• Предшествующее использование антибиотиков
• Длительная госпитализация.
Путь назначения антибактериальной терапии определяется тяжестью аспирационной пневмонии. Больные с тяжелой пневмонией и с осложненными формами пневмонии должны получать парентеральную терапию, при менее тяжелом течении возможно назначение пероральных препаратов. Ответ на антибактериальную терапию у 80% больных с аспирационными пневмониями наступает в течение первых 5 дней лечения. Продолжительность курса антимикробной терапии у больных без абсцесса или эмпиемы составляет около 14 дней. При наличии абсцесса лихорадка может сохраняться 5–10 дней и более, несмотря на адекватную антибактериальную терапию. Больным с абсцессами и эмпиемами необходимо назначение парентеральной терапии до достижения клинического ответа (снижение лихорадки, тенденция к нормализации числа лейкоцитов, уменьшение кашля и диспноэ), после чего, при условии нормальной абсорбции из желудочно–кишечного тракта, возможен переход на терапию антибиотиками per os (клиндамицин 300 мг каждые 6 часов; амоксициллин 500 мг каждые 8 часов + метронидазол 500 мг каждые 6–8 часов; амоксициллин/клавуланат 625 мг каждые 8 часов). Рекомендуемая длительность антибактериальной терапии у больных с абсцессом легких и эмпиемой плевры составляет 2–3 месяца .
При наличии абсцесса легких и эмпиемы плевры могут понадобиться дополнительные мероприятия (бронхоскопия, хирургические методы). Дренирование абсцессов часто достигается при обеспечении хорошей экспекторации мокроты и проведении физиотерапевтических процедур (перкуссия, вибрационный массаж). При медленном разрешении абсцесса, локальной обструкции бронхиального дерева (инородное тело, опухоль) адекватный дренаж может быть достигнут при помощи бронхоскопических методов, в т.ч. и трансбронхиальной катетеризации. Хирургическое вмешательство может понадобиться при больших размерах абсцесса (более 6 см) и при осложнениях абсцесса (легочное кровотечение, формирование бронхоплевральной фистулы). Альтернативой хирургическому вмешательству может быть чрескожная катетеризация полости абсцесса, которая показана больным, не отвечающим на антибиотики и имеющим периферическую локализацию абсцесса. Для лечения эмпиемы плевры, кроме использования антибиотиков, часто требуются также дополнительные методы для обеспечения дренирования плевральной полости: повторные аспирации экссудата, установка дренажной трубки, введение в плевральную полость фибринолитиков, торакоскопия, открытая торакоскопия, хирургическая декортикация.
3. Bartlett JG. Anaerobic bacterial infections of the lung and pleural space. Clin Infect Dis 1993; 16 Suppl 4: 248–5.
6. Bartlett JG, Gorbach SL: The triple threat of aspiration pneumonia. Chest 1975; 68: 560–6.
8. Finegold SM. Aspiration pneumonia. Rev Infect Dis 1991;13 Suppl 9: 737– 2.
9. Bartlett JG. Anaerobic bacterial pneumonitis. Am Rev Respir Dis 1979; 119: 19–23.
Грачёва Г. Ю., ветеринарный врач ОРИТ Ветеринарной клиники доктора Сотникова, г. Санкт-Петербург.
Аспирационный синдром (в литературе можно встретить термин «аспирационный пневмонит») определяется как острое повреждение легких вследствие вдыхания химических раздражителей, таких как кислое содержимое желудка, углеводороды, соленая или пресная вода (например, при утоплении). Наиболее распространенной причиной аспирационного синдрома является вдыхание содержимого желудка.
Аспирационная пневмония относится к легочной бактериальной инфекции, которая развивается после аспирации, но различие между аспирационным синдромом и аспирационной пневмонией плохо определено у ветеринарных пациентов. Аспирационная пневмония может возникнуть в результате бактериального поражения легких, поврежденных в случае аспирации, поскольку обсеменение ротоглотки патогенными бактериями, такими как Pasteurella spp., чрезвычайно распространено у собак и кошек. Аспирация соленой воды, масел и жидких углеводородов может быть включена в определение аспирационной пневмонии, даже если сопутствующая бактериальная инфекция при этом отсутствует.
Принятая двухфазная модель острого повреждения легких после кислотной аспирации была утверждена на основании экспериментов, проводимых на мышах, где оценивались изменения проницаемости легких после прямой трахейной инстилляции соляной кислоты и описывалась хронология происходивших гистологических изменений1.
Первая фаза повреждения легких, которая начинается сразу после аспирации, является результатом прямого воздействия кислого аспирата. Первоначально это химический ожог, который повреждает бронхиальный и альвеолярный эпителий и эндотелий легочных капилляров. Легочная капиллярная проницаемость увеличивается после кислотной стимуляции сенсорных нейронов в гладкой мускулатуре трахеобронхиального дерева. Эти сенсорные нейроны участвуют в контроле тонуса гладких мышц бронхов и проницаемости сосудов, и их стимуляция вызывает высвобождение множества нейропептидов тахикинина, таких как вещество Р и нейрокинин А, а также нейрогенное воспаление, сужение бронхов, выделение слизи из бронхов, кашель, расширение сосудов и увеличение их проницаемости. Изменения проницаемости сосудов максимально проявляются через 1–2 ч. после аспирации. Гистологически повреждение первой фазы состоит из эпителиальной и эндотелиальной дегенерации, некроза альвеолярных клеток I типа и внутриальвеолярного кровоизлияния.
Вторая фаза кислотно-индуцированного повреждения легких начинается через 4–6 ч. после аспирации и может продолжаться до 2 дней. Она характеризуется дополнительным, более значительным увеличением проницаемости легочных капилляров и экстравазации белка по сравнению с первой фазой, что может приводить к отеку легких и еще большему ухудшению газообмена. Нейтрофилы первоначально привлекаются в легкие хемотаксическими медиаторами, такими как интерлейкин-8, фактор некроза опухоли-α и воспалительный белок макрофага-2, высвобождаемый альвеолярными макрофагами после начального эпизода аспирации. Вторая фаза включает генерацию локализованного провоспалительного состояния путем активации секвестрированных нейтрофилов. Интерлейкин-8 является основным стимулом для хемотаксиса нейтрофилов, а также активирует рецепторы эндотелия β2-интегрина нейтрофилов, опосредует трансэндотелиальную миграцию нейтрофилов и инициирует их для активации. Комбинированные кислотно-дисперсные аспираты вызывают более выраженную и продолжительную экспрессию фактора некроза опухоли-α, чем аспирация одной кислоты. Нейтрофилы повреждают ткани путем производства и высвобождения свободных радикалов кислорода и протеолитических ферментов. Высокие уровни сериновых протеаз, выделяемых секвестрированными активированными нейтрофилами, по-видимому, играют более важную роль в повреждении тканей, чем активные формы кислорода, полученные из лейкоцитов.
На контралатеральное легкое эти процессы влияют даже в том случае, если аспирация односторонняя. Активация комплемента в результате дегрануляции тучных клеток, стимулируемая тахикининами, опосредует этот ответ. На моделях морских свинок высвобождение тахикинина в легких происходит после стимуляции пищевода желудочной кислотой из-за наличия неадренергических нехолинергических нейронных сетей между пищеводом и трахеей.
Аспирационная пневмония может развиваться одновременно с аспирационным синдромом, если аспирированное содержимое обсеменено бактериями. Также аспирационная пневмония может возникать вследствие аспирационного синдрома с последующей бактериальной колонизацией дыхательных путей. Вероятные бактерии включают комменсалы, например Staphylococcus spp., кишечные палочки, такие как E. coli и Klebsiella spp., Mycoplasma spp., и первичные респираторные патогены, включая Pasteurella spp., Pseudomonas spp., Bordetella spp. и Streptococcus spp. Аспирация желудочного сока усиливает адгезию бактерий к дыхательному эпителию и уменьшает легочный клиренс бактерий.
В конечном итоге изменения проницаемости сосудов становятся причиной образования отека легких, фокального ателектаза и коллапса альвеол, что приводит к гиповентиляции и шунтированию. Воспалительный ответ на бактериальную инфекцию усугубляет это, и гипоксия может развиваться вследствие несоответствия вентиляционно-перфузионного отношения (V/Q, где V – вентиляция, Q – перфузия) и снижения податливости легких.
Степень повреждения легких зависит от pH, объема, осмоляльности и наличия нестерильных твердых частиц в аспирате. Серьезное гистологическое повреждение вызывают аспираты с уровнем pH, более кислым, чем 1,5, но если уровень pH выше, чем 2,4, то незначительное или нулевое повреждение ими не вызвано. Твердые частицы вызывают повреждение легких вследствие обструкции дыхательных путей, пролонгирования воспалительного ответа, а также являются источником и очагом бактериальной инфекции. Аспирация содержимого желудка с твердыми частицами может привести к серьезному повреждению легких, даже если уровень рН будет выше 2,51.
Аспирационная пневмония чаще встречается у пожилых пациентов. Клинический анамнез важен для определения потенциальных причин. Наиболее распространенные причины аспирационной пневмонии у собак включают заболевание пищевода, рвоту, неврологические расстройства, заболевание гортани и постанестетическую аспирацию. Оппортунистические инфекции осложняют начальное событие аспирации. Распространена смешанная инфекция с анаэробной популяцией. Аспирационная пневмония обычно характеризуется распределением в наиболее зависимую долю легкого (т. е. в правую среднюю), однако возможно распространение в любую другую долю или сразу в оба легких. Пневмония должна быть заподозрена в том числе у собак с неспецифическими признаками вялости, снижением аппетита и/или повышенной утомляемостью и одышкой2.
Аспирационная пневмония диагностируется на основании анамнеза (если при сборе анамнеза обнаружены условия, при которых аспирация вероятна), клинических признаков (наличие одышки, утомляемости), рентгенограмм грудной клетки, бактериальных культур, выделенных из лаважа трахеи, и аутопсии (фото 1, 2).
В крупнейшем на сегодняшний день ретроспективном исследовании были рассмотрены истории болезни 240 собак с аспирационной пневмонией из 488 собак контрольной группы3. Частота случаев аспирационной пневмонии, диагностированных с помощью рентгенограммы грудной клетки, составила 0,17%. Процедуры, которые обладают повышенным риском аспирации, – лапаротомия, операции верхних дыхательных путей, нейрохирургия, торакотомия и эндоскопия. Пациенты с мегаэзофагусом и ранее диагностированным респираторным или неврологическим заболеванием также более склонны к развитию аспирационной пневмонии. У 69% собак с двумя или более факторами, связанными с риском аспирации, развилась аспирационная пневмония.
Большинство лекарств, применяемых во время анестезии, и большинство процедур, требующих анестезии (при использовании в монорежиме), не способны вызывать аспирацию и приводить к аспирационному синдрому, однако для пациентов с множественными факторами риска вероятность развития аспирационной пневмонии значительно повышается4.
Количество пораженных долей легких у пациентов в исследовании имело прямую корреляцию с выживаемостью. У животных с двумя (или более) вовлеченными долями легкого прогноз был хуже, чем у пациентов с вовлечением одной доли. Другим важным открытием было то, что 77% образцов лаважа дыхательных путей дали положительный рост культур, а почти в половине образцов было выделено два или более видов бактерий. 43% образцов имели смешанный рост как грамположительных, так и грамотрицательных бактерий, причем чаще всего выделяли кишечную палочку. Присутствие кишечной палочки не было связано с повышенной летальностью. В целом прогноз, касающийся пациентов с аспирационной пневмонией в данном исследовании, оказывался хорошим, если обеспечивались надлежащая поддерживающая терапия и антибиотикотерапия широкого спектра действия5.
Потенциальные предрасполагающие факторы развития аспирационной пневмонии у кошек аналогичны тем, которые зарегистрированы у собак и людей. Аспирационная пневмония возникает у кошек после рвоты, анестезии или приема энтерального питания. Выживаемость пациентов высока после лечения антибиотиками и поддерживающей терапии, при этом 89% кошек в исследовании дожили до выписки6.
Лечение
Лечение аспирационной пневмонии традиционно включает в себя антибиотикотерапию, инфузионную терапию и энтеральную поддержку. Чаще всего госпитализация для проведения интенсивной терапии длится около 3 дней.
Интересен следующий факт: использование антибиотиков не рекомендовано в гуманной медицине при аспирационном синдроме до появления клинических признаков развивающейся пневмонии. Однако в ветеринарной медицине антибиотикотерапия – это терапия первой линии, причем пробы на культуры должны быть взяты до назначения препаратов.
При нестабильности состояния пациентов и невозможности получить культуральные пробы с помощью лаважа назначается эмпирическая терапия препаратами широкого спектра действия (β-лактамные антибиотики, цефалоспорины в сочетании с флюороквинолонами). Есть ряд исследований, описывающих наличие анаэробных микроорганизмов в пробах, полученных из верхних дыхательных путей у животных с аспирационной пневмонией3.
Развитие аспирационной пневмонии неразрывно связано с появлением синдрома системного воспалительного ответа. Инфузионная терапия, направленная на поддержание гидратации и волемии, а также системного артериального давления, должна быть начата уже при подозрении на аспирацию поскольку при иных условиях все обстоятельства, перечисленные выше, будут усиливать повреждение легочной ткани. Предпочтительны сбалансированные кристаллоидные растворы («Стерофундин», «Нормофундин», «Плазма-Лит»)8.
Показана оксигенотерапия с помощью назальных катетеров, масок, камер (фото 3, 4).
ИВЛ с положительным давлением должна быть начата при регистрации серьезной гипоксемии. Есть ряд исследований, демонстрирующих, что при ИВЛ с положительным давлением обеспечиваются адекватная оксигенация и более быстрое восстановление пациентов9.
Применение ингаляций, стероидов и бронходилататоров не рекомендуется!3
Заключение
Аспирационная пневмония является одним из самых частых осложнений у неврологических пациентов и пациентов с диагностированным инородным телом в ЖКТ. Заболевание встречается гораздо чаще, чем предполагалось, однако диагностируется in vitro реже, чем хотелось бы. Быстрое выявление проблемы и оперативно назначенное лечение – единственный способ сократить смертность таких пациентов. Изучение последних рекомендаций и исследований в этой области дает понимание необходимости в первую очередь профилактических мер по предотвращению аспирации. Назначение прокинетиков, антиэметиков, соблюдение правил энтерального кормления, установка гастростом, обеспечение необходимого моциона – это самые доступные меры профилактики заболевания на сегодняшний день.
Литература: